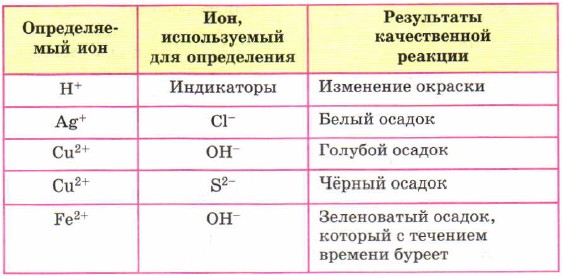
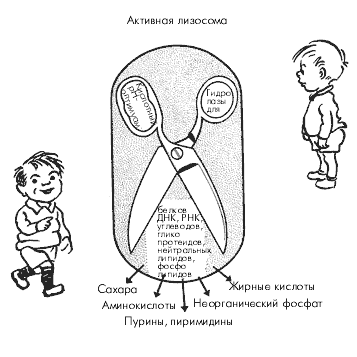
İon tanıma cədvəli. Analizdə ionometriya metodlarının tətbiqi. a) Sodyum sulfidin təyini
Keyfiyyətli analiz metodları müəyyən ionlar şəklində elementlərin müəyyənləşdirilməsinə imkan verən ion reaksiyalarına əsaslanır. Reaksiyalar zamanı seyrək həll olunan birləşmələr əmələ gəlir, rəngli mürəkkəb birləşmələr məhlulda rəng dəyişikliyi ilə oksidləşir və ya azalır.
Spar həll olunan birləşmələrin əmələ gəlməsi ilə eyniləşdirmək üçün həm qrup, həm də fərdi çöküntülərdən istifadə olunur. Ag +, Pb 2+, Hg 2+ ionları üçün qrup çökdürücülər NaCl; kationlar üçün Ca 2+, Sr 2+, Ba 2+ - (NH 4) 2 CO 3, Al 3+, Cr 3+, Fe 3+, Fe 2+, Mn 2+, Co 2+, Ni 2 ionları üçün +, Zn 2+ - (NH 4) 2 S.
Bir çox üzvi və qeyri-üzvi reagentlər var ki, onlar çöküntülər və ya kationları olan (rəngli) kompleks birləşmələr (cədvəl):
| Reagent | Formula | Kation | Reaksiya məhsulu |
| Əlizarin | C 14 H 6 O 2 (OH) 2 | Al 3+ | Parlaq qırmızı çöküntü |
| Benzidin | C 12 H 8 (NH 2) 2 | Cr 6+, Mn 7+ | Mavi birləşmə |
| Kalium heksahidroksostibiat | K | Na + | Ağ çöküntü |
| Natrium heksanitrokobaltat | Na 3 Co (NO 2) 6 | K + | Sarı çöküntü |
| Kalium heksasiyanoferat (II) | K 4 | Fe 3+ | Tünd mavi çöküntü |
| α-Dimetilglyoxime | C 4 N 2 H 8 O 2 | Cu 2+ | Qırmızı-qəhvəyi çöküntü |
| Dipikrilamin | 2 NH | Ni 2+, Fe 2+, Pb 2+ | Parlaq qırmızı çöküntü |
| Xloroform Ditizon | C 13 H 12 N 4 S | K + | Narıncı qırmızı çöküntü |
| Kalium dikromatı | K 2 Cr 2 O 7 | Zn 2+ | Moruq qırmızı həlli |
| Magneson IREA | C 16 H 10 O 5 N 2 SClNa | Ca 2+ | Narıncı çöküntü |
| Murexid | C 8 H 6 N 6 O 6 | Mg 2+ | Parlaq qırmızı həll |
| Rodamin B | C 24 H 21 O 3 N 2 Cl | Ca 2+ | Qırmızı həll |
| Xromogen qara | C 20 H 13 O 7 N 3 S | Sr 2+, Ba 2+ - Mg 2+ | Bənövşəyi həll Mavi həll Şərab qırmızı məhlulu |
Dəyişən metal birləşmələri ocağın alovunu bir rəngə və ya digərinə ləkələyir. Buna görə, tədqiq olunan maddə bir platin və ya nichrom məftillə sobanın rəngsiz alovuna daxil edilərsə, alov maddədə müəyyən elementlərin iştirakı ilə rənglənir, məsələn, rənglərdə: parlaq sarı (natrium), bənövşəyi (kalium), kərpic qırmızı ( kalsium), carmine qırmızı (stronsium), sarı yaşıl (mis, bor), solğun mavi (qurğuşun, arsen).
Anionlar ümumiyyətlə duzların həll olunma qabiliyyətinə və ya redoks xüsusiyyətlərinə görə təsnif edilir. Buna görə bir çox anion (SO 4 2 -, SO 3 2 -, CO 3 2 -, SiO 3 2 -, F -, PO 4 3 -, CrO 4 2 - və başqaları) neytral və ya bir az turşu mühitdə BaCl 2 qrup reaktivinə malikdir. , bariy duzları və bu anionlar suda bir qədər həll edildiyindən. AgNO 3 Cl -, Br -, I -, SCN - S 2 -, ClO -, 4 ionları üçün HNO 3 həllində bir qrup reagent rolunu oynayır. Kationlara gəldikdə, müəyyən anionlar üçün reagentlər var (masa):
Redion xüsusiyyətlərinə görə anionların təsnifatı cədvəldə verilmişdir:
Bir maddənin kimyəvi eyniləşdirilməsi əsasən yağış, mürəkkəbləşmə, oksidləşmə və azalma, zərərsizləşdirmə reaksiyalarına əsaslanır, bu müddət ərzində rəngli bir çökmə çöküntü, məhlulda rəng dəyişikliyi və ya qazlı maddələr buraxılır.
Təcrübə 1. sulfat ionlarının aşkarlanması
Bir test borusuna 1-2 ml natrium sulfat məhlulu, digərində 1-2 ml kalium sulfat məhlulu tökün. Bariy xlorid həllini hər iki boruya damla əlavə edin. Müşahidə olunanları izah edin.
Alınan duzların elektrolitik dissosiasiyasının və mübadilə reaksiyasının tənliklərini düzəldin. Tam və qısaldılmış ion reaksiya tənliklərini yazın.
Bariy ionları Ba 2+ üçün hansı birləşmələr reagent kimi xidmət edə bilər?
Bir reagentdən istifadə edərək ion aşkarlanmasının mahiyyəti nədir?
Təcrübə 2. Xlorid ionlarının təyini Cl -
Çözümlülük masasından, xlorid ionu Cl olan hansı duzların həll olunmadığını (az miqdarda həll olun) tapın. Əldə etdiyiniz reagentlərdən istifadə edərək natrium xlorid məhlulunda xlorid ionlarının olduğunu sübut edin.
Duzların dissosiyasına, metabolik reaksiyalara və yerinə yetirilən reaksiyaların tam və qısaldılmış ion tənliklərinə görə tənliklər tərtib edin.
Təcrübə 3. Sülfat ionlarının və xlorid ionlarının təyini Cl -
İki boruda kalium xlorid və maqnezium sulfatın məhlulları var. Bir test borusunda kalium xloridinin, digərində isə maqnezium sulfatın məhlulu olduğunu sübut etmək üçün hansı reaksiyalardan istifadə etmək olar?
Solüsyonu ilk borudan yarıya bölün və iki boruya köçürün. Bir test borusuna qurğuşun (II) nitrat məhlulunu, digərində - bariy xlorid həllini tökün. Borulardan hansı çökdü? Duzlardan hansının - KCl və ya MgSO 4 - ilk boruda olur?
İkinci borudan həllini ilk boruda tapılmamış anionun olması üçün sınayın. Bunu etmək üçün, test həllinə qurğuşun (II) nitrat bir həll əlavə edin. Müşahidə olunanları izah edin.
Sizin həyata keçirdiyiniz reaksiyaların mübadiləsi reaksiyalarının və ionların aşkarlanması reaksiyalarının tam və azaldılmış ion tənliklərini tərtib edin.
Təcrübə 4
Aşağıdakı maddələrin keyfiyyət tərkibini təsdiqləyən reaksiyalar həyata keçirin: a) bariy xlorid; b) maqnezium sulfat; c) ammonium karbonat. Bu sınağı başa çatdırmaq üçün 12-ci cədvəldən istifadə edin.
Cədvəl 12
İon təyini



KASİTA YAXŞI REALLAR
Kation
Ekspozisiya və ya reagent
İşarələr
Li +
Alov
Na +
Alov
Sarı rəngləmə
K +
Alov
Bənövşəyi rəngləmə
Ca 2+
Alov
Kərpic qırmızı ləkə
Sr 2+
Alov
Carmine qırmızı ləkə
Ba 2+
S0 4 2-
Turşu həll olmayan ağ çökmə: Ba 2+ + S0 4 2- BaS0 4
Alov
Sarı yaşıl boyanma
Cu 2+
Su
Nəmli Cu 2+ ionları mavi rəngdədir
OH -
Mavi çökmə Cu 2+ + 2OH - → Cu (OH) 2 ↓
Pb 2+
S 2-
Ag +
Cl -
Ağ çöküntü; HNO 3-də həll olunmur, əksinə həll olunur.
NH 3 H 2 0:
Ag + + Cl - AgCl
Fe 2+
kalium heksasiyanoferrat (III) (qırmızı qan duzu) K 3
Mavi yağıntılar:
K + + Fe 2+ + 3- KFe 4
3Fe 2+ +2 3- Fe 3 2
OH -
Fe 2+ + 2ОН - → Fe (OH) 2 ↓-in oksidləşməsi nəticəsində havada qəhvəyi rəngdə olan ağ (açıq yaşıl) rəngli toplu flokulyant çöküntü.
Fe 3+
kalium heksasiyanoferrat (II) (sarı)
qan duzu)
K 4
Mavi yağıntılar:
K + + Fe 3+ + 4- KFe
4Fe 3+ + 3 4- Fe 4 3
rhodanid ionu
NCS -
Fe 3+ + 3NCS - \u003d Fe (NCS) 3 parlaq qırmızı boyanma görünüşü
OH -
Qəhvəyi flokulyant çöküntü Fe 3+ + 3ON - → Fe (OH) 3 ↓
Al 3+
qələvi (hidroksidin amfoter xüsusiyyətləri)
Artıq qələvi və turşu məhlullarında əriyən ağ bərk çöküntülər Al 3+ + 3OH - → Al (OH) 3 ↓
Zn 2+
OH -
Artıq qələvi və turşu məhlullarında əriyən ağ bərk çöküntülər Zn 2+ + 2OH - → Zn (OH) 2 ↓
NH 4 +
qələvi istilik
Ammonyak qoxusu: NH 4 + + OH - NH 3 + H 2 0
H +
(turşu mühit)
Göstəricilər: litmus, metil narıncı
qırmızı rəngləmə
qırmızı rəngləmə
ANİLERƏ QANUNSUZ reaksiyalar
Anion
Reagent
İşarələr
S0 4 2-
Ba 2+ (həll olunan bariy duzları)
Ağ bir çöküntü, turşularda həll olunmayan yağıntı:
Ba 2+ + S0 4 2- BaS0 4
N0 3 -
conc. H 2 S O 4 və C
Cu ionlarını ehtiva edən mavi bir həll meydana gəlməsi 2+
qəhvəyi qaz təkamülü (YOX 2
)
Cu + 4H NO 3 Cu(Xeyr 3) 2 + 2NO 2 + 2H 2 0
RO 4 3-
ag + ionları
Neytral bir mühitdə açıq sarı yağıntılar: ZAg + + P0 4 3- Ag 3 P0 4
CrO 4 2-
ba ionları 2+
Sarı bir çöküntü, sirkə turşusunda həll olunmur, lakin HCI-də həll olunur: Ba 2+ + CrO 4 2- BaCr0 4
S 2-
pb 2+ ionları
Yağış: Pb 2+ + S 2- PbS
H + (turşu məhlulları)
Çürük yumurtaların qoxusu ilə qaz təkamülü 2H + + S 2- → H 2 S
CO 3 2-
h + ionları
Qazın təkamülü 2Н + + СО 3 2- Н 2 0 + С0 2
ca 2+ ionları
ağ bir çöküntü içərisində çöküntü
turşular: Ca 2+ + C0 3 2- \u003d CaCO3
SO 3 2-
h + ionları
Xarakterik bir qoxu görünüşü S0 2: 2Н + + SO 3 2- Н 2 0 + S0 2
S i O 3 2-
h + ionları
Jelatinli çöküntü 2N + + Si O 3 2- H 2 SiO 3 ↓
F -
ca 2+ ionları
Yağış-ağ çökmə: Ca 2+ + 2F - CaF 2
Cl -
ag + ionları
Ağ çöküntü, HN03-də həll olunmur, əksinə həll olunur. NH 3 H 2 0: Ag + + CI - AgCl
AgCI + 2 (NH 3 H 2 0) + + CI - + 2H 2 O
Br -
ag + ionları
Açıq sarı çöküntülər HN0 3-də həll olunmur: Ag + + Br - \u003d AgBr Çağırış işıqda qaralır
I -
ag + ionları
HNO 3 və NH 3 nisbətində həll olunmayan sarı bir çöküntülər: Ag + + I - AgI çöküntüsü işığında qaralır
OH -
(qələvi mühit)
göstəricilər: litmus
fenolftalein
mavi rəngləmə
moruq ləkəsi
Bəzi qeyri-insani maddələrin təyin edilməsi
Maddə
Reagent
Bir reaksiya əlamətləri
CO 2 rəngsiz və qoxusuz qaz, toksik olmayan, suda həll olunur
əhəng suyu Ca (OH) 2
Ca (OH) 2 + C0 2 CaCO 3 + H 2 0, CaCO 3 + C0 2 + H 2 0 Ca (HC0 3) 2 Ağ çöküntü və keçərkən həll olun. C0 2
barit su Ba (OH) 2
Ba (OH) 2 + C0 2 BaCO 3 + H 2 0, BaCO 3 + C0 2 + H 2 0 Ba (HC0 3) 2 Keçən zaman ağ yağıntılar və ərimələr C0 2
SO 2 rəngsiz qaz, kəskin bir qoxu olan, zəhərli, suda həll olunur
əhəng suyu Ca (OH) 2
Ca (OH) 2 + S 0 2 CaSO 3 + H 2 0, CaSO 3 + S 0 2 + H 2 0 Ca (HS 0 3) 2 Keçiddə ağ çöküntü və həll S0 2
barit su Ba (OH) 2
Ba (OH) 2 + S0 2 BaSO 3 + Н 2 0, BaSO 3 + S0 2 + Н 2 0 Ba (НS0 3) 2 Keçən zaman ağ yağıntılar və ərimələr S0 2
H 2 S rəngsiz qaz, çürük qoxusu iləyumurta, zəhərli, suda həll olunur
Pb 2+, Cu 2+, Ag + duzlarını həll edin
Qara çöküntülər əmələ gəlir, turşu məhlullarında həll olunmur, onlar qızdırıldıqda həll olunur. HNO 3 Pb 2+ + H 2 S \u003d PbS + 2H +
Cu 2+ + H 2 S \u003d CuS + 2H +
2Ag + + H 2 S \u003d Ag 2 S + 2H +
NH 3 rəngsiz qaz, kəskin bir qoxu olan, suda çox həll olunur, zəhərlidir
H 2 0, göstəricilər
Ammonyak məhlulu (ammonyak su, ammiak) göstəriciləri rəngləndirir: litmus - mavi, metil narıncı - sarı, fenolftalein - moruqda.
HCl (qaz)
Ağ tüstü meydana gəlir
NH 3 + Hcl \u003d NH 4 Cl
O 2 rəngsiz və qoxusuz qaz, suda biraz həll olunur
Yanan məşəl
İşıqlı işıq
C + O 2 \u003d CO 2
A) Xlorid ionlarının təyini
Təbii və içməli suyun ionların tərkibi üçün onometrik təhlili, analiz edilmiş ionun bir həllinə batırılmış bir ion seçici membran elektrodunun tarazlıq potensialını ölçməyə əsaslanır. Potensial bir monomer istifadə edərək 1 M kalium nitrat məhlulu ilə doldurulmuş bir duz körpüsü ilə təchiz olunmuş bir istinad elektroduna nisbətən ölçülür (Şəkil 12.1).
Fərdi maddələrin konsentrasiyasını birbaşa potensiometriya və ya potensiometrik titrləmə ilə müəyyən etmək üçün potensiometrik ölçmələr aparıldıqda, bir göstərici elektrod və bir istinad elektrodundan ibarət bir hücrə qurulur. Bir qayda olaraq, adi bir çəngəldir. Hüceyrədəki məhlul mexaniki və ya maqnit karıştırıcı istifadə edərək qarışdırılır.
Təhlil olunan ionun konsentrasiyası kalibrləmə qrafikinə əsasən tapılır. Qrafik koordinatlarda qurulub "E - (-lgС) ”.
Avadanlıqlar və reagentlər
C1 ionu üçün ion seçici elektrod.
10 ml-də ölçülən borular.
100, 250 ml-lik şüşəli eynəklər.
Kağızı süzün.
Kalium xlorid
Kalium nitrat, 1M həll.
1 M kalium nitrat məhlulu ilə yaradılan daimi ion gücü olan bir sıra standart kalium xloridinin (10 "-10 'M) dəqiq həlli dəqiq bir nümunə əsasında hazırlanır.İon selektiv elektrodun potensialının kalium xlorid konsentrasiyasından asılılığı götürülür və kalibrləmə qrafiki qurulur.Hazırların artan konsentrasiyası üçün ölçülər aparılır. Hər ölçmədən sonra elektrodlar distillə edilmiş su ilə yuyulur və süzgəc kağızı ilə qurudulur.
C x (mol / l) qurulmuş kalibrləmə cədvəlindən istifadə edərək içməli və təbii suda xlorid ionları.
Xlorid ionlarının konsentrasiyası (g / l) qramla formula ilə hesablanır
Ölçmə nəticələri cədvəl şəklində daxil edilir. 12.8.
Cədvəl 12.8
Suda xlor ionlarının ionometrik təyini nəticələri
B) Ftorid ionlarının təyini
Təbii və sənaye obyektlərini təhlil edərkən, asidli məhlullarda və ya Fe 3+ və L1 3+ ionlarının iştirakı ilə F ionunun bu metalların zəif dağılmış turşu HF və flüor kompleksləri şəklində olduğunu xatırlamaq lazımdır. Buna görə pH, məhlulda 5-7 dəyərinə uyğunlaşdırılır və dəmir və alüminium ionları ilə daha güclü komplekslər yaradan natrium sitrat əlavə olunur.
Avadanlıqlar və reagentlər
Göstərici elektrod - ion F üçün ion seçici elektrod. Əməliyyatdan əvvəl elektrod gün ərzində 0.001 M NaF-da saxlanılır. Ölçmədən əvvəl, yuyulur və distillə edilmiş suda 10-20 dəqiqə buraxılır, sonra süzgəc kağızı ilə qurudulur.
İstinad elektrod, gümüş xlorid.
Gücü 50 ml olan polietilen eynəklər.
Həcmi flasks, 100 ml başına 6 ədəd, 1000 ml 1 ədədə.
50, 100, 1000 ml tutumlu silindrlər.
10 və 25 ml ölçülən borular.
Standart məhlul - 0,1 M natrium flüorid məhlulu (4,200 g nümunə 1000 ml həcmli bir flakonda həll olunur).
Fon həlli 1M natrium sulfat məhluludur (142 q Na 2 S0 4 və ya 322 q Na 2 S0 4? UN 2 0 1000 ml həcmli bir flakonda həll olunur).
Azot turşusu, 0,01 M həll.
Ammonyak, 0,01 M sulu məhlul.
Tərif Təsviri
Ölçmələr üçün həllər hazırlayarkən, eyni miqdarda arxa elektrolit standart və analiz edilmiş həllərə daxil edilir. Bu vəziyyətdə, bütün həll yollarında ion gücünün sabit olduğunu qəbul etmək olar.
10 ", 10" 2, 10 3, 10 10 5, 10 6 nisbətində NaF (M) konsentrasiyası olan altı məhlul, 1 M Na 2 S0 4 məhlulu ilə ardıcıl seyreltmə yolu ilə 10 "M flüorid ion konsentrasiyası ilə əsas standart məhluldan hazırlanır. 10 ml 10 "M NaF məhlulu 100 ml həcmli bir şüşə qaba tökülür və həcmi bir fon həlli ilə işarəyə verilir (1 M Na 2 S0 4). Arxa plazma ilə ardıcıl seyreltmə yolu ilə çıxarılan 10 2 M NaF həllindən, qalan həllər oxşar şəkildə hazırlanır. Ən az konsentrasiyası olan məhluldan başlayaraq fluoroselektiv elektrodun potensialı bütün standart məhlullarda ardıcıl olaraq ölçülür və ölçü nəticələri Cədvələ bənzər bir masa şəklində yazılır. 9.8. Ölçmə nəticələrinə əsasən bir kalibrləmə qrafiki qurun.
Təhlil olunan məhlulda flüor ionunun konsentrasiyasını təyin edərkən eyni ion gücü ilə bir həll hazırlamaq lazımdır. Bunun üçün 5 ml test məhlulu 50 ml qabda 1M Na 2 S0 4 ilə seyreltilir. PH göstərici kağız ilə yoxlanılır və 0.01 M HNO: j və ya NH 4 OH ilə 5.0-5.5 arasında dəyişir.
Bu məhluldakı fluoroselektiv elektrodun potensialı ölçülür. Kalibrləmə qrafiki pX \u003d -lg dəyərini təyin edir. Nəticələr cədvəl şəklində qeyd olunur.
Nəzarət tapşırıqlarında florid ionunun tərkibini müəyyənləşdirmək, müəllimdən cavabı yoxlamaq və nisbi ölçmə səhvini hesablamaq lazımdır.
C) nitrat ionlarının təyini
Nitrate ionlarının tərkibi üçün təbii və içməli suyun ionometrik təhlili, analiz edilmiş ionun həllinə batırılmış bir ion selektiv membran elektrodunun tarazlıq potensialını ölçməyə əsaslanır. Membrana dörddə bir ammonium duzlu maye ion dəyişdiricisi daxildir. Potensial kalium xloridinin doymuş bir həlli ilə doldurulmuş bir gümüş xlorid elektroduna nisbətdə bir monomerdə ölçülür.
Avadanlıqlar və reagentlər
İon NQ üçün ion seçici elektrod, - hoh.
Gümüş xlorid istinad elektrodu.
10 ml pipet.
100 və 250 ml üçün şüşəli eynəklər.
Kalium xlorid
Kalium nitrat, 10 "M həll.
Kalium sulfat, 1M həll.
1. Nitrate ionlarının kalibrləmə qrafiki üsulu ilə təyini.
A 10 M. M kalium nitrat standart məhlulu dəqiq çəkilərlə hazırlanır 1 M kalium sulfat məhlulu (von L) ilə yaradılan daimi ion qüvvəsi olan 10 2 -10 5 M məhlullar ilkin standart məhlulun ardıcıl seyreltilməsi yolu ilə hazırlanır ion seçici elektrod potensialının kalium nitrat konsentrasiyasından asılılığı aradan qaldırılır. Ölçmə nəticələri Cədvəl 9.8-a bənzər bir cədvəl şəklində daxil edilir.Halibrasiya qrafiki qurulub.Həlllər konsentrasiyasının artması üçün ölçülər aparılır.Hər bir ölçmədən sonra elektrodlar distillə yuyulur su və filter kağız ilə qurudulmuş.
Təhlil olunan məhlulların tarazlıq potensialını ölçün. Konsentrasiyanı təyin edin X ilə (mol / l) qurulmuş kalibrləmə cədvəlindən istifadə edərək içməli və təbii suda nitratlar. Nəticələr cədvəl şəklində daxil edilir.
Nitrat ionlarının konsentrasiyası g / l ilə formula ilə hesablanır
burada M (N0 3) ionun molyar kütləsi, 62,01 g / mol-a bərabərdir.
2. Nitrat ionlarının aşqarlar üsulu ilə təyini.
10 "M kalium nitrat standart məhlulu dəqiq bir çəki istifadə edərək hazırlanır. 1 M kalium sulfat məhlulu (fon A) ilə yaradılan daimi ion qüvvəsi olan konsentrasiyalar 10 10 -10 JM, ilkin standart məhlulun ardıcıl seyreltilməsi yolu ilə hazırlanır. İon seçici elektrodun potensialının kalium nitratının konsentrasiyasından asılılığı aradan qaldırılır. və bir kalibrləmə qrafiki qurun.Ölçmələr məhlulun konsentrasiyasının artması üçün aparılır.Hər bir ölçmədən sonra elektrodlar distillə edilmiş su ilə yuyulur və süzgəc kağızı ilə qurudulur. Ölçmə tarixləri cədvəl 12.9 şəklində tərtib edilir.
Cədvəl 12.9
PNO-dan asılı olaraq potensialın ölçülməsi nəticələri:, bir kalibrləmə qrafiki qurmaq
İon gücünün dəyəri hər bir həll üçün düstura görə hesablanır

Çözümün ion gücü nə qədər böyükdürsə, hər bir ionun aktivlik əmsalı nə qədər aşağı olarsa və aktiv konsentrasiyası da aşağı olar.
Fəaliyyət əmsalı cədvəl məlumatları (cədvəl. 12.10) və ya Debye-Hückel düsturu ilə tapılır ![]()
Fəaliyyət əmsalı
PN0 3 dəyəri nitrat ionunun fəaliyyətinin mənfi logarifması kimi hesablanır:
Bir asılılıq qrafiki qurun "E - pN0 3 "və elektrod funksiyasının yamacını (5) müəyyənləşdirin (millivoltsda). Yaranan yamacın dəyəri aşqar metodunda hesablama düsturunda istifadə olunur. Bunun nəzəri dəyərdən necə fərqləndiyini qeyd etmək lazımdır (0.059 / və 25 ° C).
Təhlil olunan nümunədəki nitrit ionunun konsentrasiyasını müəyyən etmək üçün standart KNO həllinin əlavə edilməsindən əvvəl və sonra potensialı (/;) ölçmək lazımdır; j. Bunun üçün təhlil edilmiş məhlulun 20.00 ml-lik bir qarışığı quru bir şüşəyə qoyulur, elektrodlar ona endirilir və potensialı (?,) Ölçülür. Sonra 1-2 ml mikropipetdən istifadə edərək 2-3 damcı KN0 3 standart həllini əlavə edin. Hər əlavə edildikdən sonra həll maqnit qarışdırıcı ilə qarışdırılır. Sonra potensialı (? 2) ölçün və analiz olunan həll (D) ilə əlaqəli dəyişikliyini təyin edin E = E., - ?,). Dəyişiklik üçün itələyin AE nümunənin bir hissəsinə 2-3 qatqı təqdim edərək 30 mV-dən az olmamalıdır.
Əlavə edilmiş məhlulun P st həcmini C st konsentrasiyası, təhlil edilmiş məhlulun həcmini bilməklə bir neçə aşqar üçün təyinetmə nəticəsini hesablayın V r (20 ml) və formulaya görə laqeyd seyreltmə

harada AE - əlavə edildikdən sonra potensialdakı müşahidə olunan dəyişiklik, mV; 5 - cədvələ uyğun olaraq təyin olunan elektrod funksiyasının dikliyi, mV. Təhlil olunan məhluldakı nitrat ionlarının tərkibi (g / l ilə) düsturla hesablanır
![]()
burada M (NQ 3) ionun molyar kütləsi, 62,01 g / mol-a bərabərdir.