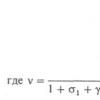Как образуется в природе озон. Химическая формула озона. Структурная формула озона. Использование О3 в медицине и промышленности
1. Что мы знаем об ОЗОНЕ?
Озон (от греческого ozon - пахнущий) - газ голубого цвета с резким запахом, сильный окислитель. Озон аллотроп кислорода. Молекулярная формула О3. Тяжелее кислорода в 2,5 раза. Используется для обеззараживания воды, продуктов питания и воздуха.
Технологии
Основываясь на технологии коронического разряда озона, был разработан многофункциональный анионный озонатор Green World, который использует озон для дезинфекции и стериализации.
Характеристики химического элемента озона
Озон, научное название которого О3, получается в процессе соединения трех атомов кислорода.Обладает высокими окислительными функциями, которые эффективны при дезинфекции и стеарилизации. Он способен уничтожить большинство бактерий в воде и воздухе. Его считают эффективным дезинфектором и антисептиком. Озон является важным компонентом атмосферы. В нашей атмосфере содержится 0.01ppm-0.04ppm озона, который балансирует уровень бактерий в природе. Озон также образуется в природе при разрядах молнии во время грозы. Во время электрического разряда молнии появляется приятный сладкий запах, который мы называем свежим воздухом.
Молекулы озона неустойчивы и очень быстро распадаются на молекулы кислорода. Благодаря этому качеству озон является ценным газом и очистителем воды. Молекулы озона соединяются с молекулами других веществ и распадаются, в итоге он окисляет органические соединения, превращая их в безвредные углекислый газ и воду. По причине того, что озон легко распадается на молекулы кислорода, он значительно менее токсичен, чем другие дезинфекционные вещества, такие как хлор. Эго твкже называют «самый чистый окислитель и дезинфикатор».
Свойства озона - убивает микроорганизмы
1. убивает бактерии
а) убивает большую часть коли-бактерий и стафилококков в воздухе
б) убивает 99.7% коли-бактерий и 99.9% стафилококков на поверхности предметов
в) убивает 100% of коли-бактерий, стафилококков и микробы группы сальмонелла в фосфатных соединениях
г) убивает 100% of коли-бактерий в воде
2. уничтожает споры бактерий
а) уничтожает brevibacteiumspores
б) способность уничтожать бактерии в воздухе
в) убивает 99.999% brevibacteiumspores в воде
3. разрушает вирусы
а) разрушает 99.99% HBsAg и 100% HAAg
б) разрушает вирус гриппа в воздухе
в) разрушает PVI и вирус Геппатита А в воде в течении нескольких секунд или минут
г) разрушает вирус SA-11 в воде
д) когда концентрация озона в сыворотке крови достигает 4мг/л, он способен разрушить HIV в 106cd50/ml
а) убивает 100% aspergillusversicolor и penicillium
б) убивает 100% aspergillusniger, fusariumoxysporumf.sp.melonogea и fusariumoxysporumf.sp. lycopersici
в) убивает aspergillus niger и candida bacteria
2. Как образуется озон в природе?
Образуется из молекулярного кислорода (О2) при электрическом разряде или под действием ультрафиолетового излучения. Особенно это ощутимо в местах, богатых кислородом: в лесу, в приморской зоне или около водопада. При попадании солнечных лучей, в капле воды кислород преобразуется в озон. Также Вы чувствуете запах озона после грозы, когда он образуется при электрическом разряде.
3. Почему воздух после грозы кажется чище?
Озон окисляет примеси органических веществ и обеззараживает воздух, придавая приятную свежесть (запах грозы). Характерный запах озона проявляется при концентрациях 10-7 %.
4. Что такое озоносфера? Каково ее влияние на жизнь на планете?
Основная масса озона в атмосфере расположена на высоте от 10 до 50 км с максимальной концентрацией на высоте 20-25 км, образуя слой, называемый озоносферой.
Озоносфера отражает жесткое ультрафиолетовое излучение, защищает живые организмы от губительного действия радиации. Именно, благодаря образованию "озона из кислорода воздуха стала возможна жизнь на суше.
5. Когда был открыт озон и какова история его использования?
Впервые озон описан в 1785г. голландским физиком Мак Ван Марум.
В 1832г. проф. Базельского университета Шонбейн опубликовал книгу «Получение озона химическим способом». Он же дал ему название «озон» от греческого «пахнущий».
В 1857г. Вернер фон Сименс сконструировал первую техническую установку для очистки питьевой воды. С тех пор озонирование позволяет получить гигиенически чистую воду.
К 1977г. во всем мире действует более 1000 установок по озонированию питьевой воды. В настоящее время 95% питьевой воды в Европе обрабатывается озоном. Большое распространение озонирование получило в Канаде и США. В России действует несколько крупных станций, которые используются для доочистки питьевой воды, подготовки воды плавательных бассейнов, при глубокой очистке сточных вод в оборотном водоснабжении автомобильных моек.
Впервые озон как антисептическое средство был использован во время первой мировой войны.
С 1935г. стали использовать ректально введение озонокислородной смеси для лечения различных заболеваний кишечника (проктит, геморрой, язвенный колит, свищи, подавление патогенных микроорганизмов, восстановление кишечной флоры).
Изучение действия озона позволили использовать его в хирургической практике при инфекционных поражениях, лечении туберкулеза, пневмонии, гепатитов, герпетической инфекции, анемии и пр.
В Москве в 1992г. под руководством Заслуженного деятеля науки РФ д.м.н. Змызговой А..В. создан «Научно-практический центр озонотерапии», где озон используется для лечения широкого круга заболеваний. Продолжаются разработки эффективных неповреждающих методов воздействия с использованием озона. Сегодня озон считается популярным и эффективным средством обеззараживания воды, воздуха и очищения продуктов питания. Так же кислородно-озоновые смеси используются в лечении различных заболеваний, косметологии и многих сферах хозяйствования.
6. Можно ли дышать озоном? Является ли озон вредным газом?
Действительно, дышать озоном высоких концентраций опасно, он способен сжечь слизистую оболочку дыхательных органов.
Озон является сильным окислителем. Здесь кроются его положительные и вредоносные свойства. Все зависит от концентрации, т.е. от процентного соотношения содержания озона в воздухе. Действие его подобно огню... В малых количествах он поддерживает и оздоравливает, в больших количествах - может погубить.
7. В каких случаях используются низкие и высокие концентрации озона?
Относительно высокие концентрации используются для дезинфекции, а более низкие концентрации озона не повреждают белковые структуры и способствуют заживлению.
8. Каково действие озона на вирусы?
Озон подавляет (инактивирует) вирус как вне, так и внутри клетки, частично разрушая его оболочку. Прекращается процесс его размножения и нарушается способность вирусов соединяться с клетками организма.
9. Как проявляется бактерицидное свойство озона при воздействии на микроорганизмы?
При воздействии озона на микроорганизмы, в том числе на дрожжи, локально повреждается их клеточная мембрана, что приводит к их гибели или невозможности размножаться. Отмечено повышение чувствительности микроорганизмов к антибиотикам.
В экспериментах установлено, что газообразный озон убивает практически все виды бактерий, вирусов, плесневых и дрожжеподобных грибов и простейших. Озон в концентрациях от 1 до 5 мг/л приводит к гибели 99,9% эшерихии коли, стрептококков, мукобактерий, филококков, кишечной и синегнойной палочек, протеев, клебсиеллы и др. в течении 4-20 мин.
10. Как действует озон в неживой природе?
Озон реагирует с большинством органических и неорганических веществ. В процессе реакций образуется кислород, вода, оксиды углерода и высшие оксиды других элементов. Все эти продукты не загрязняют окружающую среду и не приводят к образованию концерагенных веществ в отличие от соединений хлора и фтора.
11. Могут ли быть опасными соединения, образующиеся в жилых помещениях при озонировании воздуха?
Концентрации озона, создаваемые бытовым озонатором приводят к образованию безвредных соединений в жилых помещениях. В результате озонирования помещения происходит увеличение содержания кислорода в воздухе и очистка от вирусов и бактерий.
12. Какие соединения образуются в результате озонирования воздуха в закрытых помещениях?
Большинство компонентов, окружающих нас соединений, реагируют с озоном, приводя к образованию безвредных соединений.
Большинство из них распадаются на углекислый газ, воду и свободный кислород. В ряде случаев образуются неактивные (безвредные) соединения (оксиды). Есть еще так называемые нереагентные вещества - оксиды титана, кремния, кальция и т.д. Они в реакцию с озоном не вступают.
13. Надо ли озонировать воздух в помещениях с кондиционерами?
После прохождения воздуха через кондиционеры и нагревательные приборы в воздухе снижается содержание кислорода и не снижается уровень токсичных компонентов воздуха. К тому же, старые кондиционеры сами являются источником загрязнения и заражения. «Синдром закрытых помещений» - головная боль, усталость, частые респираторные заболевания. Озонирование таких помещений просто необходимо.
14. Можно ли дезинфицировать кондиционер?
Да, можно.
15. Эффективно ли применение озонирования воздуха для устранения запахов прокуренных помещений и помещений после ремонта (запахи краски, лака)?
Да, эффективно. Обработку следует провести несколько раз, сочетая с влажной уборкой.
16. Какие концентрации озона губительны для бактерий, грибков в домашнем воздухе?
Концентрация 50-и частиц озона на 1000000000 частиц воздуха значительно снижает загрязнение воздуха. Особенно сильное воздействие оказывается на ешерихию коли, сальмонеллу, стафилококк, кандиду, аспергиллиус.
17. Проводились ли исследования воздействия озонированного воздуха на людей?
В частности, описан эксперимент, который проводился в течение 5-и месяцев с двумя группами людей - контрольной и тестируемой.
Воздух в помещении тестируемой группы наполнялся озоном с концентрацией 15 частиц озона на 1000000000 частиц воздуха. Все испытуемые отмечали хорошее самочувствие, исчезновение раздражительности. Медики отметили повышение содержания кислорода в крови, укрепление иммунной системы, нормализацию давления, исчезновение многих симптомов стресса.
18. Не является ли озон вредным для клеток организма?
Концентрации озона, создаваемые бытовыми озонаторами, подавляют вирусы и микроорганизмы, но не повреждают клеток организма, т.к. озон не повреждает кожу. Здоровые клетки организма человека имеют естественную защиту от повреждающего действия окисления (антиоксидантную). Иначе говоря, действие озона избирательно по отношению к живым организмам.
Это не исключает применения мер предосторожности. Во время процесса озонирования нахождение в помещении нежелательно, а после проведения озонирования помещение следует проветрить. Озонатор надо поместить в недоступное для детей место или предусмотреть невозможность его включения.
19. Какова производительность озонатора?
При нормальном режиме - 200 мг/час, при усиленном - 400 мг/час. Какова концентрация озона в помещении в результате работы озонатора? Концентрация зависит от объема помещения, от места расположения озонатора, от влажности воздуха и температуры. Озон не стойкий газ и быстро разлагается, поэтому концентрация озона сильно зависит от времени. Ориентировочные данные 0,01 - 0,04 РРm.
20. Какие концентрации озона в воздухе считаются предельными?
Безопасными считаются концентрации озона в пределах 0,5 - 2,5 РРm (0,0001 мг/л).
21. Для чего применяется озонирование воды?
Озон применяется для обеззараживания, удаления примесей, запаха и цветности воды.
1. В отличие от хлорирования и фторирования воды при озонировании в воду не вносится ничего постороннего (озон быстро распадается). При этом минеральный состав и pН остаются без изменений.
2. Озон обладает наибольшим обеззараживающим свойством против возбудителей болезней.
3. Разрушаются органические вещества в воде, предотвращая тем самым дальнейшее развитие микроорганизмов.
4. Без образования вредных соединений разрушаются большинство химикатов. К ним относятся пестициды, гербициды, нефтепродукты, моющие средства, соединения серы и хлора, являющиеся концерагенами.
5. Окисляются до неактивных соединений металлы, в том числе железо, марганец, алюминий, и пр. Окислы выпадают в осадок и легко фильтруются.
6. Быстро распадаясь озон превращается в кислород, улучшая вкусовые и лечебные свойства воды.
23. Каков показатель кислотности воды, прошедшей озонирование?
Вода имеет слабощелочную реакцию РН = 7,5 - 9,0. Эта вода рекомендуется для питья.
24. На сколько увеличивается содержание кислорода в воде после озонирования?
Содержание кислорода в воде увеличивается в 12 раз.
25. Как быстро распадается озон в воздухе, в воде?
В воздухе через 10 мин. концентрация озона уменьшается на половину, образуя кислород и воду.
В воде через 20-30 мин. озон распадается на половину, образуя гидроксильную группу и воду.
26. Как влияет нагрев воды на содержание в ней кислорода?
Содержание кислорода в воде после нагрева снижается.
27. От чего зависит концентрация озона в воде?
Концентрация озона зависит от примесей, температуры, кислотности воды, материала и геометрии емкости.
28. Почему используется молекула О 3 , а не О 2 ?
Озон примерно в 10 раз лучше растворим в воде, чем кислород, и хорошо сохраняется. Чем ниже температура воды, тем больше время сохранения.
29. Почему полезно пить насыщенную кислородом воду?
Использование озона усиливает потребление глюкозы тканями и органами, увеличивает насыщаемость кислородом плазмы крови, уменьшает степень кислородного голодания, улучшает микроциркуляцию.
Озон оказывает положительное действие на метаболизм печени и почек. Поддерживает работу сердечной мышцы. Уменьшает частоту дыхания и увеличивает дыхательный объем.
30. Для чего предназначен бытовой озонатор?
Бытовой озонатор можно использовать для:
дезинфекции и дезодорации воздуха в жилых помещениях, в ванной и туалетной комнатах, бытовках, шкафах, холодильнике и пр.;
обработки пищевых продуктов (мясо, рыба, яйца, овощи и фрукты);
улучшения качества воды (дезинфекция, обогащение кислородом, устранение хлора и др. вредных примесей);
домашней косметологии (устранение перхоти, угрей, полоскание горла, чистка зубов, устранение грибковых заболеваний, приготовление озонированного масла);
ухода за домашними животными и рыбками;
полива комнатных растений и обработка семян;
отбеливания и придания цветности белью;
обработки обуви.
31. Каков эффект применения озона в медицинской практике?
Озон оказывает антибактериальное, антивирусное действие (инактивация вирусов и уничтожение спор).
Озон активизирует и нормализует ряд биохимических процессов.
Эффект, получаемый при озонотерапии, характеризуется:
активизацией процессов детоксикации, происходит подавление
активности внешних и внутренних токсинов;
активизацией процессов метаболизма (обменных процессов);
усилением микроциркуляции (кровоснабжение
улучшением реологических свойств крови (кровь становитсяподвижной);
имеет четко выраженный обезболивающий эффект.
32. Как действует озон на иммунитет человека?
Повышается клеточный и гуморальный иммунитет. Активизируется фагоцитоз, усиливается синтез интерферонов и прочих неспецифических систем организма.
33. Как влияет озонирование на процессы метаболизма?
Использование озона усиливает потребление глюкозы тканями и органами, увеличивает насыщаемость кислородом плазмы крови, уменьшает степень кислородного голодания, улучшает микроциркуляцию. Озон оказывает положительное действие на метаболизм печени и почек. Поддерживает работу сердечной мышцы. Уменьшает частоту дыхания и увеличивает дыхательный объем.
34. Озон образуется при проведении сварочных работ и при работе ксерокса. Вреден ли этот озон?
Да, вреден, так как при этом образуются опасные примеси. Озон, вырабатываемый озонатором, чист и поэтому безвреден.
35. Есть ли разница между индустриальными, медицинскими и бытовыми озонаторами?
Индустриальные озонаторы дают большую концентрацию озона, опасную для домашнего применения.
Медицинские и бытовые озонаторы близки по показателям производительности, но медицинские рассчитаны на большее время непрерывной работы.
36. Каковы сравнительные характеристики дезинфекции при использовании ультрафиолетовых установок и озонаторов?
Озон по своим свойствам уничтожения бактерий и вирусов в 2,5 - 6 раз эффективнее ультрафиолетовых лучей и в 300 - 600 раз эффективнее хлора. При этом в отличии от хлора озон уничтожает даже цисты глистов и вируса герпеса и туберкулеза.
Озон удаляет из воды органические и химические вещества, разлагая их до воды, углекислого газа, образуя осадок неактивных элементов.
Озон легко окисляет соли железа и марганца, образуя нерастворимые вещества, которые устраняются отстаиванием или фильтрацией. В результате озонированная вода безопасна, прозрачна и приятна на вкус.
37. Можно ли дезинфицировать посуду с помощью озона?
Да! Хорошо дезинфицировать детскую посуду, посуду для консервирования и пр. Для этого поместить посуду в емкость с водой, опустить воздуховод с рассекателем. Обрабатывать в течение 10-15 мин.
38. Из каких материалов должна быть посуда для озонирования?
Стеклянная, керамическая, деревянная, пластмассовая, эмалированная (баз сколов и трещин). Нельзя использовать металлическую, в том числе алюминиевую и медную посуду. Резина не выдерживает контакта с озоном.
Анионный озонатор от американской корпорации Green World поможет Вам не только сохранить, но и значительно укрепить здоровье. Вы имеете возможность использовать в своем доме незаменимый прибор - анионный озонатор, который объединил в себе все качества и функциональные возможности как ионизатора воздуха, так и озонатора (многофункционального...
Озонатор для автомобиля снабженподсветкой и ароматизатором. Одновременно может быть включен режим озонации и ионизации. Эти режимы могут быть включены и по отдельности. Этот озонатор незаменим при дальних поездках, когда увеличивается утомляемость водителя, ухудшается зрение и память. Озонатор снимаетсонливость, придавая бодрость за счет притока...
ОЗОН (О 3) — аллотропная модификация кислорода, его молекула состоит из трех атомов кислорода и может существовать во всех трех агрегатных состояниях. Молекула озона имеет угловую структуру в форме равнобедренного треугольника с вершиной 127 o . Однако замкнутого треугольника не образуется, а молекула имеет строение цепи из 3-х атомов кислорода с расстоянием между ними 0,224 нм. В соответствии с этой молекулярной структурой дипольный момент составляет 0,55 дебай. В электронной структуре молекулы озона имеются 18 электронов, которые образуют мезомерностабильную систему, существующую в различных пограничных состояниях. Пограничные ионные структуры отражают дипольный характер молекулы озона и объясняют его специфическое реакционное поведение в сравнении с кислородом, который образует радикал с двумя неспаренными электронами. Молекула озона состоит из трех атомов кислорода. Химическая формула этого газа– O 3 Реакция образования озона: 3O 2 + 68 ккал/моль (285 кДж/моль) ⇄ 2O 3 Молекулярная масса озона – 48 При комнатной температуре озон — это бесцветный газ с характерным запахом. Запах озона чувствуется при концентрации 10 -7 М. В жидком состоянии озон — это темно-синий цвет с температурой плавления -192,50 С. Твердый озон представляет собой кристаллы черного цвета с температурой кипения -111,9 гр.С. При температуре 0 гр. и 1 атм. = 101,3 кПа плотность озона составляет 2,143 г/л. В газообразном состоянии озон диамагнитен и выталкивается из магнитного поля, в жидком -слабопарамагнитен, т.е. обладает собственным магнитным полем и втягивается в магнитное поле.
Химические свойства озона
Молекула озона неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно превращается в двухатомный кислород с выделением тепла. Повышение температуры и понижение давления увеличивают скорость разложения озона. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение. Химическая активность озона очень велика, это мощный окислитель. Он окисляет почти все металлы (за исключением золота, платины и иридия) и многие неметаллы. Продуктом реакции в основном является кислород. Озон растворяется в воде лучше, чем кислород, образуя нестойкие растворы, причём скорость его разложения в растворе в 5 -8 раз выше, чем в газовой фазе, чем в газовой фазе (Разумовский С.Д., 1990). Это обусловлено, по-видимому, не спецификой конденсированной фазы, а его реакциями с примесями и ионом гидроксила, поскольку скорость распада очень чувствительна к содержанию примесей и рН. Растворимость озона в растворах хлорида натрия подчиняется закону Генри. С увеличением концентрации NaCl в водном растворе растворимость озона уменьшается (Тарунина В.Н. и соавт.,1983). Озон имеет очень высокое сродство к электрону (1,9 эВ), что и обуславливает его свойства сильного окислителя, превосходимого только фтором (Разумовский С.Д., 1990).Биологические свойства озона и его влияние на организм человека
Высокая окисляющая способность и то, что во многих химических реакциях, протекающих с участием озона, образуются свободные радикалы кислорода, делают этот газ крайне опасным для человека. Как газообразный озон влияет на человека:- Раздражает и повреждает ткани органов дыхания;
- Воздействует на холестерин в крови человека, образуя нерастворимые формы, что приводит к атеросклерозу;
- Долгое нахождение в среде с повышенной концентрацией озона может стать причиной мужского бесплодия.
- Максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м 3
- Среднесуточная предельно допустимая концентрация (ПДК с.с.) – 0,03 мг/м 3
- Предельно допустимая концентрация (ПДК) в воздухе рабочей зоны – 0,1 мг/м 3 (при этом, порог человеческого обоняния приближённо равен 0,01 мг/м 3).
Вредные и полезные свойства озона
Озон присутствует в двух слоях атмосферы. Тропосферный или приземный озон, находящийся в ближайшем к поверхности Земли слое атмосферы-в тропосфере – опасен. Он вреден и для человека, и для других живых организмов. Он губительно воздействует на деревья, посевы сельскохозяйственных культур. Кроме того, тропосферный озон-один из главных „ингредиентов“ городского смога. В тоже время стратосферный озон очень полезен. Разрушение образованного им озонового слоя (озонового экрана) приводит к тому, что поток ультрафиолетового излучения на земную поверхность увеличивается. Из-за этого возрастает количество заболеваний раком кожи (в том числе наиболее опасного его вида-меланомы), случаев катаракты. Воздействие жесткого ультрафиолета ослабляет иммунитет. Избыточное УФ-излучение может также стать проблемой для сельского хозяйства, так как посевы некоторых культур чрезвычайно чувствительны к ультрафиолету. В то же время следует помнить, что озон – ядовитый газ, и на уровне земной поверхности он является вредоносным загрязнителем. Летом из-за интенсивного солнечного излучения и жары в воздухе образуется особенно много вредоносного озона.Взаимодействие озона и кислорода друг с другом. Сходства и различия.
Озон – аллотропная форма кислорода. Аллотропия – существование одного и того же химического элемента в виде двух и более простых веществ. В данном случае и озон (O3) и кислород (O 2) образованы химическим элементом О. Получение озона из кислорода Как правило, исходным веществом для получения озона выступает молекулярный кислород (O 2), а сам процесс описывается уравнением 3O 2 → 2O 3 . Эта реакция эндотермична и легко обратима. Для смещения равновесия в сторону целевого продукта (озона) применяются определенные меры. Один из способов получения озона – использование дугового разряда. Термическая диссоциация молекул резко возрастает с ростом температуры. Так, при Т=3000К - содержание атомарного кислорода составляет ~10 %. Температуру в несколько тысяч градусов можно получить при помощи дугового разряда. Однако при высокой температуре озон разлагается быстрее молекулярного кислорода. Чтобы предотвратить это, можно сместить равновесие, сначала нагрев газ, а затем резко его охладив. Озон в данном случае-промежуточный продукт при переходе смеси O 2 +O к молекулярному кислороду. Максимальная концентрация O 3 , которую можно получить при таком способе производства, достигает 1 %. Этого достаточно для большинства промышленных целей. Окислительные свойства озона Озон - мощный окислитель, намного более реакционноспособный по сравнению с двухатомным кислородом. Окисляет почти все металлы и многие неметаллы с образованием кислорода: 2 Cu 2+ (aq) + 2 H 3 O + (aq) + O 3(g) → 2 Cu 3+ (aq) + 3 H 2 O (1) + O 2(g) Озон может участвовать в реакциях горения, температура горения при этом выше, чем при горении в атмосфере двухатомного кислорода: 3 C 4 N 2 + 4 O 3 → 12 CO + 3 N 2 Стандартный потенциал озона равен 2.07 В, поэтому молекула озона неустойчива и самопроизвольно превращается в кислород с выделением тепла. При небольших концентрациях озон разлагается медленно, при высоких — со взрывом, т.к. его молекула обладает избыточной энергией. Нагревание и контакт озона с ничтожными количествами органических веществ (гидроокиси, перекиси, металлы переменной валентности, их окислы) резко ускоряет превращение. Напротив, присутствие небольших количеств азотной кислоты стабилизирует озон, а в сосудах из стекла и некоторых пластмасс или чистых металлов озон при -78 0 C. практически разлагается. Сродство озона к электрону равняется 2 эв. Таким сильным сродством обладает только фтор и его окислы. Озон окисляет все металлы (за исключением золота и платиновых), а также большинство других элементов. Хлор участвует в реакциях с озоном с образованием гипохлора ОCL. Реакции озона с атомарным водородом являются источником образования гидроксильных радикалов. Озон имеет максимум поглощения в УФ-области при длине волны 253,7 нм с молярным коэффициентом экстинции: E = 2,900 На основании этого УФ-фотометрическое определение концентрации озона вместе с йодо-метрическим титрованием принято за международные стандарты. Кислород, в отличие от озона, в реакцию с KI не вступает.Растворимость озона и его стабильность в водных растворах
Скорость разложения озона в растворе в 5-8 раз выше, чем в газовой фазе. Растворимость озона в воде в 10 раз выше, чем кислорода. По данным разных авторов величина коэффициента растворимости озона в воде колеблется от 0,49 до 0,64 мл озона/ мл воды. В идеальных термодинамических условиях равновесие подчиняется закону Генри, т.е. концентрация насыщенного раствора газа пропорциональна его парциальному давлению. C S = B × d × Рi где: С S — концентрация насыщенного раствора в воде; d — масса озона; Pi — парциальное давление озона; B — коэффициент растворения; Выполнение закона Генри для озона как метастабильного газа условно. Распад озона в газовой фазе зависит от парциального давления. В водной среде имеют место процессы, выходящие за область действия закона Генри. Вместо него в идеальных условиях действует закон Gibs-Dukem-Margulesdu. В практике принято выражать растворимость озона в воде через соотношение концентрации озона в жидкой среде к концентрации озона в газовой фазе: Насыщение озоном зависит от температуры и качества воды, поскольку органические и неорганические примеси изменяют рН среды. При одинаковых условиях в водопроводной воде концентрация озона составляет 13 mg/l, в бидистиллированной воде — 20mg/l. Причиной этого является значительный распад озона из-за различных ионных примесей в питьевой воде.Распад озона и период полураспада (т 1/2)
В водной среде распад озона сильно зависит от качества воды, температуры и рН среды. Повышение рН среды ускоряет распад озона и снижает при этом концентрацию озона в воде. Аналогичные процессы происходят при повышении температуры. Период полураспада озона в бидистиллированной воде составляет 10 часов, в деминерализованной воде — 80 минут; в дистиллированной воде — 120 минут. Известно, что разложение озона в воде является сложным процессом реакций радикальных цепей: Максимальное количество озона в водном образце наблюдается в течение 8-15 минут. Через 1 час в растворе отмечаются только свободные радикалы кислорода. Среди них важнейшим является гидроксильный радикал (ОН’) (Staehelin G., 1985), и это необходимо принимать во внимание при использовании озонированной воды в терапевтических целях.
Поскольку в клинической практике находят применение озонированная вода и озонированный физиологический раствор, нами проведена оценка этих озонированных жидкостей в зависимости от концентраций, используемых в отечественной медицине. Основными методами анализа явились йодометрическое титрование и интенсивность хемилюминесценции с использованием прибора биохемилюминометра БХЛ-06 (производство Нижний Новгород) (Конторщикова К. Н., Перетягин С. П., Иванова И. П. 1995).
Явление хемилюминесценции связано с реакциями рекомбинации свободных радикалов, образующихся при разложении озона в воде. При обработке 500 мл би- или дистиллированной воды барботированием озоно-кислородной газовой смесью с концентрацией озона в пределах 1000-1500 мкг/л и скоростью потока газа 1 л/мин в течение 20 минут хемилюминесценция выявляется в течение 160 минут. Причем в бидистиллированной воде интенсивность свечения существенно выше, чем в дистиллированной, что объясняется наличием примесей, гасящих свечение.
Растворимость озона в растворах NaCl подчиняется закону Генри, т.е. уменьшается с увеличением концентрации солей.
Физиологический раствор обрабатывали озоном с концентрацией 400, 800 и 1000 мкг/л в течение 15 минут. Общая интенсивность свечения (в mv) увеличивалась с ростом концентрации озона. Продолжительность свечения составляет 20 минут. Это объясняется более быстрой рекомбинацией свободных радикалов и отсюда гашением свечения за счет наличия в физиологическом растворе примесей.
Несмотря на высокий окислительный потенциал, озон обладает высокой селективностью, которая обусловлена полярным строением молекулы. Мгновенно реагируют с озоном соединения, содержащие свободные двойные связи (-С=С-). В результате чувствительными к действию озона являются ненасыщенные жирные кислоты, ароматические аминокислоты и пептиды, прежде всего содержащие SH- группы.
Согласно данным Криге (1953) (цит. По Vieban R. 1994), первичным продуктом взаимодействия молекулы озона с биоорганическими субстратами является 1-3 диполярная молекула. Эта реакция является основной при взаимодействии озона с органическими субстратами при рН < 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
Максимальное количество озона в водном образце наблюдается в течение 8-15 минут. Через 1 час в растворе отмечаются только свободные радикалы кислорода. Среди них важнейшим является гидроксильный радикал (ОН’) (Staehelin G., 1985), и это необходимо принимать во внимание при использовании озонированной воды в терапевтических целях.
Поскольку в клинической практике находят применение озонированная вода и озонированный физиологический раствор, нами проведена оценка этих озонированных жидкостей в зависимости от концентраций, используемых в отечественной медицине. Основными методами анализа явились йодометрическое титрование и интенсивность хемилюминесценции с использованием прибора биохемилюминометра БХЛ-06 (производство Нижний Новгород) (Конторщикова К. Н., Перетягин С. П., Иванова И. П. 1995).
Явление хемилюминесценции связано с реакциями рекомбинации свободных радикалов, образующихся при разложении озона в воде. При обработке 500 мл би- или дистиллированной воды барботированием озоно-кислородной газовой смесью с концентрацией озона в пределах 1000-1500 мкг/л и скоростью потока газа 1 л/мин в течение 20 минут хемилюминесценция выявляется в течение 160 минут. Причем в бидистиллированной воде интенсивность свечения существенно выше, чем в дистиллированной, что объясняется наличием примесей, гасящих свечение.
Растворимость озона в растворах NaCl подчиняется закону Генри, т.е. уменьшается с увеличением концентрации солей.
Физиологический раствор обрабатывали озоном с концентрацией 400, 800 и 1000 мкг/л в течение 15 минут. Общая интенсивность свечения (в mv) увеличивалась с ростом концентрации озона. Продолжительность свечения составляет 20 минут. Это объясняется более быстрой рекомбинацией свободных радикалов и отсюда гашением свечения за счет наличия в физиологическом растворе примесей.
Несмотря на высокий окислительный потенциал, озон обладает высокой селективностью, которая обусловлена полярным строением молекулы. Мгновенно реагируют с озоном соединения, содержащие свободные двойные связи (-С=С-). В результате чувствительными к действию озона являются ненасыщенные жирные кислоты, ароматические аминокислоты и пептиды, прежде всего содержащие SH- группы.
Согласно данным Криге (1953) (цит. По Vieban R. 1994), первичным продуктом взаимодействия молекулы озона с биоорганическими субстратами является 1-3 диполярная молекула. Эта реакция является основной при взаимодействии озона с органическими субстратами при рН < 7,4.
Озонолиз проходит в доли секунды. В растворах скорость этой реакции равна 105 г/моль·с. В первом акте реакции образуется пи-комплекс олефинов с озоном. Он относительно стабилен при температуре 140 0 С и затем превращается в первичный озонид (молозонид) 1,2,3-триоксалан. Другое возможное направление реакции — образование эпоксидных соединений.
Первичный озонид нестабилен и распадается с образованием карбоксильного соединения и карбонилоксида. В результате взаимодействия карбонилоксида с карбонильным соединением образуется биполярный ион, который затем превращается во вторичный озонид 1,2,3 — триоксалан. Последний при восстановлении распадается с образованием смеси 2-х карбонильных соединений, с дальнейшим образованием пероксида (I) и озонида (II).
 Озонирование ароматических соединений протекает с образованием полимерных озонидов. Присоединение озона нарушает ароматическое сопряжение в ядре и требует затрат энергии, поэтому скорость озонирования гомологов коррелирует с энергией сопряжения.
Озонирование насушенных углеводородов связано с механизмом внедрения.
Озонирование серо- и азотосодержащих органических соединений протекает следующим образом:
Озонирование ароматических соединений протекает с образованием полимерных озонидов. Присоединение озона нарушает ароматическое сопряжение в ядре и требует затрат энергии, поэтому скорость озонирования гомологов коррелирует с энергией сопряжения.
Озонирование насушенных углеводородов связано с механизмом внедрения.
Озонирование серо- и азотосодержащих органических соединений протекает следующим образом:
 Озониды обычно плохо растворимы в воде, но хорошо в органических растворителях. При нагревании, действии переходных металлов распадаются на радикалы.
Количество озонидов в органическом соединении определяется йодным числом. Йодное число — масса йода в граммах, присоединяющееся к 100 г органического вещества. В норме для жирных кислот йодное число составляет 100-400, для твердых жиров 35-85, для жидких жиров — 150-200.
Впервые озон, как антисептическое средство был опробован A. Wolff еще в 1915 во время первой мировой войны. Последующие годы постепенно накапливалась информация об успешном применении озона при лечении различных заболеваний. Однако длительное время использовались лишь методы озонотерапии, связанные с прямыми контактами озона с наружными поверхностями и различными полостями тела. Интерес к озонотерапии усиливался по мере накопления данных о биологическом действии озона на организм и появления сообщений из различных клиник мира об успешном использовании озона при лечении целого ряда заболеваний.
История медицинского применения озона начинается с XIX века. Пионерами клинического применения озона были западные ученые Америки и Европы, в частности, C. J. Kenworthy, B. Lust, I. Aberhart, Е. Payer, E. A. Fisch, Н. Н. Wolff и другие. В России о лечебном применении озона было известно мало. Только в 60-70 годы в отечественной литературе появилось несколько работ по ингаляционной озонотерапии и по применению озона в лечении некоторых кожных заболеваний, а с 80-х годов в нашей стране этот метод стал интенсивно разрабатываться и получать более широкое распространение. Основы для фундаментальных разработок технологий озонотерапии были во многом определены работами Института химической физики АМН СССР. Книга «Озон и его реакции с органическими веществами» (С. Д. Разумовский, Г. Е. Зайков, Москва, 1974 г.) явилась отправной точкой для обоснования механизмов лечебного действия озона у многих разработчиков.
В мире широко действует Международная озоновая ассоциация (IOA), которая провела 20 международных конгрессов, а с 1991 года в работе этих конгрессов принимают участие и наши врачи и ученые.
Совершенно по-новому сегодня рассматриваются проблемы прикладного использования озона, а именно в медицине. В терапевтическом диапазоне концентраций и доз озон проявляет свойства мощного биорегулятора, средства, способного во многом усилить методы традиционной медицины, а зачастую выступать в качестве средства монотерапии.
Применение медицинского озона представляет качественно новое решение актуальных проблем лечения многих заболеваний. Технологии озонотерапии используются в хирургии, акушерстве и гинекологии, стоматологии, неврологии, при терапевтической патологии, инфекционных болезнях, дерматологии и венерических болезнях и целом ряде других заболеваний. Для озонотерапии характерна простота исполнения, высокая эффективность, хорошая переносимость, практическое отсутствие побочных действий, она экономически выгодна. Лечебные свойства озона при заболеваниях различной этиологии основаны на его уникальной способности воздействовать на организм. Озон в терапевтических дозах действует как иммуномодулирующее, противовоспалительное, бактерицидное, противовирусное, фунгицидное, цитостатическое, антистрессовое и аналгезирующее средство. Его способность активно коррегировать нарушенный кислородный гомеостаз организма открывает большие перспективы для восстановительной медицины. Широкий спектр методических возможностей позволяет с большой эффективностью использовать лечебные свойства озона для местной и системной терапии.
В последние десятилетия на передний план вышли методы, связанные с парентеральным (внутривенным, внутримышечным, внутрисуставным, подкожным) введением терапевтических доз озона, лечебный эффект которых связан, в основном, с активизацией различных систем жизнедеятельности организма. Кислородно-озоновая газовая смесь при высоких (4000 — 8000 мкг/л) концентрациях в ней озона в эффективна при обработке сильно инфицированных, плохо заживающих ран, гангрене, пролежней, ожогов, грибковых поражениях кожи и т.п. Озон в высоких концентрациях можно также использовать как кровоостанавливающее средство. Низкие концентрации озона стимулируют репарацию, способствуют эпителизации и заживлению.
В лечении колитов, проктитов, свищей и ряда других заболеваний кишечника используют ректальное введение кислородно-озоновой газовой смеси. Озон, растворенный в физиологическом растворе, успешно применяют при перитоните для санации брюшной полости, а озонированную дистиллированную воду в челюстной хирургии и др.
Для внутривенного введения используется озон, растворенный в физиологическом растворе или в крови больного.
Пионерами Европейской школы было высказано постулирующее положение о том, что главной целью озонотерапии
является:
«Стимуляция и реактивация кислородного метаболизма без нарушения окислительно-восстановительных систем»,- это значит, что при расчете дозировок на сеанс или курс, озонотерапевтическое воздействие должно находиться в пределах, в которых ферментативно выравниваются радикальные кислородные метаболиты или избыточно полученный пероксид» (З. Риллинг, Р. Фибан 1996 в кн. Практика озонотерапии).
В зарубежной медицинской практике для парентерального введения озона используются, в основном, большая и малая аутогемотерапии. При проведении большой аутогемотерапии, взятая у пациента кровь тщательно смешивается с определенным объемом кислородно-озоновой газовой смеси, и сразу же капельно вводится обратно в вену того же пациента. При малой аутогемотерапии озонированная кровь вводится внутримышечно. Терапевтическая доза озона в этом случае выдерживается за счет фиксированных объемов газа и концентрации озона в нем.
Озониды обычно плохо растворимы в воде, но хорошо в органических растворителях. При нагревании, действии переходных металлов распадаются на радикалы.
Количество озонидов в органическом соединении определяется йодным числом. Йодное число — масса йода в граммах, присоединяющееся к 100 г органического вещества. В норме для жирных кислот йодное число составляет 100-400, для твердых жиров 35-85, для жидких жиров — 150-200.
Впервые озон, как антисептическое средство был опробован A. Wolff еще в 1915 во время первой мировой войны. Последующие годы постепенно накапливалась информация об успешном применении озона при лечении различных заболеваний. Однако длительное время использовались лишь методы озонотерапии, связанные с прямыми контактами озона с наружными поверхностями и различными полостями тела. Интерес к озонотерапии усиливался по мере накопления данных о биологическом действии озона на организм и появления сообщений из различных клиник мира об успешном использовании озона при лечении целого ряда заболеваний.
История медицинского применения озона начинается с XIX века. Пионерами клинического применения озона были западные ученые Америки и Европы, в частности, C. J. Kenworthy, B. Lust, I. Aberhart, Е. Payer, E. A. Fisch, Н. Н. Wolff и другие. В России о лечебном применении озона было известно мало. Только в 60-70 годы в отечественной литературе появилось несколько работ по ингаляционной озонотерапии и по применению озона в лечении некоторых кожных заболеваний, а с 80-х годов в нашей стране этот метод стал интенсивно разрабатываться и получать более широкое распространение. Основы для фундаментальных разработок технологий озонотерапии были во многом определены работами Института химической физики АМН СССР. Книга «Озон и его реакции с органическими веществами» (С. Д. Разумовский, Г. Е. Зайков, Москва, 1974 г.) явилась отправной точкой для обоснования механизмов лечебного действия озона у многих разработчиков.
В мире широко действует Международная озоновая ассоциация (IOA), которая провела 20 международных конгрессов, а с 1991 года в работе этих конгрессов принимают участие и наши врачи и ученые.
Совершенно по-новому сегодня рассматриваются проблемы прикладного использования озона, а именно в медицине. В терапевтическом диапазоне концентраций и доз озон проявляет свойства мощного биорегулятора, средства, способного во многом усилить методы традиционной медицины, а зачастую выступать в качестве средства монотерапии.
Применение медицинского озона представляет качественно новое решение актуальных проблем лечения многих заболеваний. Технологии озонотерапии используются в хирургии, акушерстве и гинекологии, стоматологии, неврологии, при терапевтической патологии, инфекционных болезнях, дерматологии и венерических болезнях и целом ряде других заболеваний. Для озонотерапии характерна простота исполнения, высокая эффективность, хорошая переносимость, практическое отсутствие побочных действий, она экономически выгодна. Лечебные свойства озона при заболеваниях различной этиологии основаны на его уникальной способности воздействовать на организм. Озон в терапевтических дозах действует как иммуномодулирующее, противовоспалительное, бактерицидное, противовирусное, фунгицидное, цитостатическое, антистрессовое и аналгезирующее средство. Его способность активно коррегировать нарушенный кислородный гомеостаз организма открывает большие перспективы для восстановительной медицины. Широкий спектр методических возможностей позволяет с большой эффективностью использовать лечебные свойства озона для местной и системной терапии.
В последние десятилетия на передний план вышли методы, связанные с парентеральным (внутривенным, внутримышечным, внутрисуставным, подкожным) введением терапевтических доз озона, лечебный эффект которых связан, в основном, с активизацией различных систем жизнедеятельности организма. Кислородно-озоновая газовая смесь при высоких (4000 — 8000 мкг/л) концентрациях в ней озона в эффективна при обработке сильно инфицированных, плохо заживающих ран, гангрене, пролежней, ожогов, грибковых поражениях кожи и т.п. Озон в высоких концентрациях можно также использовать как кровоостанавливающее средство. Низкие концентрации озона стимулируют репарацию, способствуют эпителизации и заживлению.
В лечении колитов, проктитов, свищей и ряда других заболеваний кишечника используют ректальное введение кислородно-озоновой газовой смеси. Озон, растворенный в физиологическом растворе, успешно применяют при перитоните для санации брюшной полости, а озонированную дистиллированную воду в челюстной хирургии и др.
Для внутривенного введения используется озон, растворенный в физиологическом растворе или в крови больного.
Пионерами Европейской школы было высказано постулирующее положение о том, что главной целью озонотерапии
является:
«Стимуляция и реактивация кислородного метаболизма без нарушения окислительно-восстановительных систем»,- это значит, что при расчете дозировок на сеанс или курс, озонотерапевтическое воздействие должно находиться в пределах, в которых ферментативно выравниваются радикальные кислородные метаболиты или избыточно полученный пероксид» (З. Риллинг, Р. Фибан 1996 в кн. Практика озонотерапии).
В зарубежной медицинской практике для парентерального введения озона используются, в основном, большая и малая аутогемотерапии. При проведении большой аутогемотерапии, взятая у пациента кровь тщательно смешивается с определенным объемом кислородно-озоновой газовой смеси, и сразу же капельно вводится обратно в вену того же пациента. При малой аутогемотерапии озонированная кровь вводится внутримышечно. Терапевтическая доза озона в этом случае выдерживается за счет фиксированных объемов газа и концентрации озона в нем.
Научные достижения отечественных учёных стали регулярно докладываться на международных конгрессах и симпозиумах
- 1991 г. – Куба, Гавана,
- 1993 г. – США Сан-Франциско,
- 1995 г. – ФранцияЛилль,
- 1997 г. – Япония, Киото,
- 1998 г. – Австрия, Зальцбург,
- 1999г. – Германия,Баден-Баден,
- 2001 г. – Англия, Лондон,
- 2005 г. – Франция,Страсбург,
- 2009 г. – Япония, Киото,
- 2010 г. — Испания, Мадрид
- 2011 г.Турция(Стамбул),Франция (Париж),Мексика(Канкун)
- 2012г. – Испания, Мадрид
Всероссийские научно-практические конференции с Международным участием по озонотерапии
I – «ОЗОН В БИОЛОГИИ И МЕДИЦИНЕ» – 1992 г ., Н.Новгород II – «ОЗОН В БИОЛОГИИ И МЕДИЦИНЕ» – 1995 г ., Н.Новгород III – «ОЗОН И МЕТОДЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ» – 1998 г ., Н.Новгород IV – «ОЗОН И МЕТОДЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ» – 2000 г ., Н.Новгород V – «ОЗОН В БИОЛОГИИ И МЕДИЦИНЕ» – 2003 г ., Н.Новгород VI – «ОЗОН В БИОЛОГИИ И МЕДИЦИНЕ» – 2005 г ., Н.Новгород «I Конференция по озонотерапии Азиатско-Европейского союза озонотерапевтов и производителей медоборудования»– 2006 г ., Большое Болдино, Нижегородская область VII – «ОЗОН В БИОЛОГИИ И МЕДИЦИНЕ» – 2007 г ., Н.Новгород У111 – «Озон, активные формы кислорода и методы интенсивной терапии в медицине» — 2009, г.Н.Новгород К 2000 г. Российская школа озонотерапии окончательно сформировала свой, отличающийся от Европейского, подход к применению озона как лечебного средства. Главные отличия — широкое использование физиологического раствора в качестве носителя озона, применение значительно более низких концентраций и доз озона, разработанные технологии экстракорпоральной обработки больших объёмов крови (озонированное искусственное кровообращение), индивидуальный выбор доз и концентраций озона при системной озонотерапии. В стремлении большинства российских врачей использовать наименьшие из эффективных концентраций озона нашел отражение основной принцип медицины — «не навреди». Безопасность и эффективность Российских методик озонотерапии многократно обоснована и доказана применительно к различным областям медицины. В результате многолетних фундаментально-клинических исследований нижегородскими учёными была «Установлена неизвестная закономерность формирования адаптационных механизмов организма млекопитающих при системном воздействии низкими терапевтическими дозами озона, заключающаяся в том, что пусковым механизмом является влияние озона на про- и антиоксидантный баланс организма и обусловленная умеренной интенсификацией свободно-радикальных реакций, что, в свою очередь, увеличивает активность ферментативного и неферментативного звеньев антиоксидантной системы защиты» (Конторщикова К. Н., Перетягин С. П.), на которую авторы получили открытие (Диплом № 309 от 16 мая 2006 г.). В работах отечественных учёных нашли развитие новые технологии и аспекты использования озона с лечебными целями:- Широкое использование в качестве носителя растворенного озона физиологического раствора (0,9% раствор NaCl)
- Применение сравнительно малых концентраций и доз озона при системном воздействии (внутрисосудистое и внутрикишечное введение)
- Внутрикостные вливания озонированных растворов
- Внутрикоронарное введение озонированных кардиоплегических растворов
- Тотальная экстракорпоральная обработка озоном больших объемов крови при искусственном кровообращении
- Низкопоточная озонокислородная терапия
- Внутрипортальное введение озонированных растворов
- Применение озона на театре военных действий
- Сопровождение системной озонотерапии методами биохимического контроля
- Озонотерапия — немедикаментозный метод лечебного воздействия, позволяющий получать положительные результаты при патологии различного генеза.
- Биологическое действие парентерально введенного озона проявляется на уровне низких концентраций и доз, что сопровождается клинически выраженными позитивными лечебными эффектами, имеющими четко выраженную дозозависимость.
- Опыт Российской и Европейской школ озонотерапии свидетельствует о том, что использование озона в качестве лечебного средства значительно повышает эффективность лекарственной терапии, позволяет в ряде случаев заменить или уменьшить фармакологическую нагрузку на пациента. На фоне озонотерапии восстанавливаются собственные кислородзависимые реакции и процессы больного организма.
- Технические возможности современных медицинских озонаторов, обладающих возможностями сверхточной дозировки, позволяют применять озон в диапазоне низких терапевтических концентраций аналогично общепринятым фармакологическим средствам.
Озон (Оз) - бесцветный газ, обладающий раздражающим острым запахом. Молекулярная масса 48 г/моль, плотность относительно воздуха 1,657 кг/м. Концентрация озона в воздухе у порога обоняния достигает 1 мг/м. В малых концентрациях на уровне 0,01-0,02 мг/м (в 5 раз ниже предельно допустимой для человека концентрации), озон придает воздуху характерный запах свежести и чистоты. Так, например, после грозы едва уловимый запах озона неизменно ассоциируется с чистым воздухом.
Известно, что молекула кислорода состоит из 2-х атомов: 0 2 . При определенных условиях молекула кислорода может диссоциировать, т.е. распадаться на 2 отдельных атома. В природе эти условия: создаются во время грозы при разрядах атмосферного электричества и в верхних слоях атмосферы, под воздействием ультрафиолетового излучения солнца (озоновый слой Земли). Однако атом кислорода не может существовать отдельно и стремится сгруппироваться вновь. В ходе такой перегруппировки образуются 3-х атомные молекулы .
Молекула, состоящая из 3-х атомов кислорода, называется озон или активированный кислород, представляет собой аллотропную модификацию кислорода и имеет молекулярную формулу 0 3 (d = 1.28 A, q = 11.6.5°).
Следует отметить, что связь третьего атома в молекуле озона относительно непрочна, что обуславливает нестабильность молекулы в целом и ее склонность к самораспаду. Именно благодаря этому свойству озон является сильным окислителем и исключительным по эффективности дезинфицирующим средством.
Озон широко распространен в природе. Он всегда образуется в воздухе во время грозы за счет атмосферного электричества, а также под воздействием коротковолновых излучений и потоков быстрых частиц при естественном распаде радиоактивных веществ в ядерных реакциях, космических излучениях и т. п. Образование озона происходит также при испарении воды с больших поверхностей, особенно таянии снега, окислении смолистых веществ, фотохимическом окислении ненасыщенных углеводородов и спиртов. Повышенное образование озона в воздухе хвойных лесов и на берегу моря объясняется окислением древесной смолы и морских водорослей. Так называемая озоносфера, образующаяся в верхних слоях атмосферы, представляет собой защитный слой земной биосферы вследствие того, что озон интенсивно поглощает биологически активное УФ излучение солнца (с длиной волны менее 290 нм).
В приземной слой атмосферы озон заносится из нижней стратосферы. Концентрация озона в атмосфере колеблется в пределах 0,08-0,12 мг/м. Однако перед созреванием кучевых облаков возрастает ионизация атмосферы, в результате которой значительно увеличивается образование озона, концентрация его в воздухе может превышать 1,3 мг/м .
Озон - высокоактивная, аллотропная форма кислорода. Образование озона из кислорода выражают уравнением
3О2= 20 3 - 285 кДж/моль, (1)
из которого следует, что стандартная энтальпия образования озона положительна и равна 142,5 кДж/моль. Кроме того, как показывают коэффициенты уравнения, в ходе этой реакции из трех молекул газа получаются две молекулы, т. е. энтропия системы уменьшается. В итоге стандартное отклонение энергии Гиббса в рассматриваемой реакции также положительно (163 кДж/моль). Таким образом, реакция превращения кислорода в озон самопроизвольно протекать не может, для ее осуществления необходима затрата энергии. Обратная же реакция - распад озона протекает самопроизвольно, так как в ходе этого процесса энергия Гиббса системы уменьшается. Иначе говоря, озон - неустойчивое вещество, быстро рекомбинируется, превращаясь в молекулярный кислород:
20з = 302 + 285 кДж/моль. (2)
Скорость реакции зависит от температуры, давления смеси и концентрации озона в ней. При нормальной температуре и давлении реакция протекает медленно, при повышенной температуре распад озона ускоряется. При небольших концентрациях (без посторонних примесей) в нормальных условиях озон разлагается довольно медленно. С повышением температуры до 100°С и более скорость разложения значительно возрастает. Механизм распада озона, в котором участвуют гомогенные и гетерогенные системы, довольно сложен и зависит от внешних условий.
Основные физические свойства озона представлены в таблице 1.
Знание физических свойств озона необходимо для правильного его использования в технологических процессах в невзрывоопасных концентрациях, проведения синтеза и разложения озона в оптимальных безопасных режимах, оценки его активности в различных средах.
Свойства озона характеризуются его активностью к излучениям различного спектрального состава. Озон интенсивно поглощает микроволновые, инфракрасные и ультрафиолетовые излучения .
Озон химически агрессивен и легко вступает в химические реакции. Реагируя с органическими веществами, он вызывает разнообразные окислительные реакции при сравнительно низкой температуре. На этом, в частности, основано бактерицидное действие озона, который применяется для обеззараживания воды. Окислительные процессы, инициируемые озоном, часто являются цепными.
Химическая активность озона обусловлена в большей мере тем, что диссоциация молекулы
0 3 ->0 2 + О (3)
требует затраты энергии немногим более 1 эВ. Озон легко отдает атом кислорода, обладающий высокой активностью. В некоторых случаях молекула озона может целиком присоединиться к органическим молекулам, образуя неустойчивые соединения, которые легко распадаются под действием температуры или света с образованием различных кислородсодержащих соединений.
Реакциям озона с органическими веществами посвящено большое количество исследований, в которых показано, что озон способствует вовлечению кислорода в окислительные процессы, что некоторые реакции окисления при обработке реагентов озонированным кислородом начинаются при более низких температурах.
Озон активно вступает в реакции с ароматическими соединениями, реакция при этом может идти как с разрушением, так и без разрушения ароматического ядра.
В реакциях озона с натрием, калием, рубидием, цезием, которые идут через промежуточный неустойчивый комплекс М + Оˉ Н + О3ˉ с последующей реакцией с озоном, образуются озониды. Ион Оˉ 3 может образовываться и в реакциях с органическими соединениями .
Для промышленных целей озон получают обработкой атмосферного воздуха или кислорода в специальных аппаратах - озонаторах. Разработаны конструкции озонаторов, работающих на повышенной частоте тока (500-2000 Гц), и озонаторы с каскадным разрядом, не требующие предварительной подготовки воздуха (очистки, осушки) и охлаждения электродов. Энергетический выход озона в них достигает 20-40 г/кВт-ч.
Преимущество озона по сравнению с другими окислителями состоит в том, что озон может быть получен на месте потребления из кислорода воздуха, для чего не требуется подвозки реагентов, сырья и т. д. Получение озона не сопровождается выделением кумулирующихся вредных веществ. Озон легко нейтрализовать. Стоимость озона сравнительно невелика.
Из всех известных окислителей только кислород и ограниченный круг перекисных соединений принимает участие в естественных биопроцессах.
Молекулярная формула озона в химии О 3 . Его относительная молекулярная масса составляет 48. В составе соединения есть три атома О. Так как формула кислорода и озона включает в себя один и тот же химический элемент, в химии их называют аллотропными модификациями.
Физические свойства
При обычных условиях химическая формула озона - газообразное вещество, обладающее специфическим запахом, имеющим светло-голубой цвет. В природе данное химическое соединение можно ощутить во время прогулки после грозы по сосновому бору. Так как формула озона О 3 , он тяжелее кислорода в 1,5 раза. В сравнении с О 2 растворимость озона значительно выше. При нулевой температуре 49 его объемов легко растворяется в 100 объемах воды. В незначительных концентрациях вещество не обладает свойством токсичности, ядом озон является только в значительных объемах. Предельной допустимой концентрацией считают 5% количества в воздухе О 3 . В случае сильного охлаждения он легко сжижается, а при понижении показателя температуры до -192 градусов становится твердым веществом.
В природе
Молекула озона, формула которого была представлена выше, в природе образуется при грозовом разряде из кислорода. Кроме того, О 3 формируется при окислении смолы хвойных пород, он уничтожает вредные микроорганизмы, считается полезным для человека.
Получение в лаборатории
Как можно получить озон? Вещество, формула которого О 3 , образуется при пропускании через сухой кислород электрического разряда. Процесс осуществляется в специальном приборе - озонаторе. В его основе - две стеклянные трубки, которые вставлены одна в другую. Внутри располагается металлический стержень, снаружи есть спираль. После подключения к катушке высокого напряжения между внешней и внутренней трубкой возникает разряд, и кислород превращается в озон. Элемент, формула которого представлена в виде соединения с ковалентной полярной связью, подтверждает аллотропию кислорода.
Процесс превращения в озон кислорода является эндотермической реакцией, предполагающей существенные затраты энергии. В связи с обратимостью такого превращения наблюдается разложение озона, что сопровождается уменьшением энергии системы.
Химические свойства
Формула озона объясняет его окислительную способность. Он способен взаимодействовать с разными веществами, теряя при этом атом кислорода. Например, в реакции с иодидом калия в водной среде происходит выделение кислорода, образование свободного йода.
Молекулярная формула озона поясняет его способность вступать в реакцию практически со всеми металлами. Исключение составляют золото и платина. Например, после пропускания через озон металлического серебра наблюдается его почернение (образуется оксид). Под действием этого сильного окислителя наблюдается разрушение резины.
В стратосфере озон образуется благодаря действию УФ-облучения Солнца, формируя слой озона. Эта оболочка защищает поверхность планеты от негативного воздействия солнечной радиации.
Биологическое действие на организм
Повышенная окислительная способность данного газообразного вещества, образование свободных радикалов кислорода свидетельствуют о его опасности для организма человека. Какой вред способен нанести человеку озон? Он повреждает и раздражает ткани дыхательных органов.
Озон действует на холестерин, содержащийся в крови, вызывая атеросклероз. При продолжительном нахождении человека в среде, которая содержит повышенную концентрацию озона, развивается мужское бесплодие.
В нашей стране данный окислитель относят к первому (опасному) классу вредных веществ. Его среднесуточная ПДК не должна превышать 0,03 мг на кубический метр.
Токсичность озона, возможность его применения для уничтожения бактерий и плесени, активно применяют для дезинфекции. Стратосферный озон - прекрасный защитный экран земной жизни от ультрафиолетового излучения.
О пользе и вреде озона
Это вещество находится в двух слоях земной атмосферы. Тропосферный озон опасен для живых существ, негативно действует на сельскохозяйственные культуры, деревья, является компонентом городского смога. Стратосферный озон приносит человеку определенную пользу. Распад его в водном растворе зависит от рН, температуры, качества среды. В медицинской практике применяют озонированную воду различной концентрации. Озонотерапия предполагает прямой контакт данного вещества с организмом человека. Впервые подобная методика была применена в девятнадцатом веке. Американские исследователи проанализировали способность озона к окислению вредных микроорганизмов, рекомендовали медикам использовать это вещество при лечении простудных заболеваний.
В нашей стране озонотерапия начала применяться только в конце прошлого века. В терапевтических целях этот окислитель проявляет характеристики сильного биорегулятора, который способен увеличить результативность традиционных методик, а также проявить себя в качестве эффективного самостоятельного средства. После разработки технологии озонотерапии у медиков появилась возможность результативно бороться со многими заболеваниями. В неврологии, стоматологии, гинекологии, терапии, специалисты с помощью этого вещества борются с разнообразными инфекциями. Озонотерапия характеризуется простотой метода, его эффективностью, отличной переносимостью, отсутствием побочных эффектов, незначительными затратами.
Заключение
Озон является сильным окислителем, способным бороться с вредными микробами. Данное свойство широко применяют в современной медицине. В отечественной терапии озон используют в качестве противовоспалительного, иммуномодулирующего, противовирусного, бактерицидного, антистрессового, цитостатического средства. Благодаря его способности восстанавливать нарушения кислородного обмена, дает ему отличные возможности для лечебно-профилактической медицины.
Среди инновационных методик, основанных на окислительной способности данного соединения, выделим внутримышечное, внутривенное, подкожное введение данного вещества. Например, обработка пролежней, грибковых поражений кожи, ожогов, смесью кислорода и озона признана эффективной методикой.
В высоких концентрациях озон можно применять в качестве кровоостанавливающего средства. При низких концентрациях он способствует репарации, заживлению, эпителизации. Это вещество, растворенное в физиологическом растворе, является отличным средством для санации челюсти. В современной европейской медицине широкое распространение получила малая и большая аутогемотерапия. Оба метода связаны с введением в организм озона, использованием его окислительной способности.
В случае большой аутогемотерапии происходит введение озонового раствора заданной концентрацией в вену пациента. Малая аутогемотерапия характеризуется внутримышечным введением озонированной крови. Помимо медицины, этот сильный окислитель востребован в химическом производстве.
Впервые озон получен и исследован Шенбейном в 1840. Озон—газ голубоватого цвета, резкого характерного запаха;
Сжиженный озон — жидкость тёмно-синего цвета, твердый озон — тёмно-фиолетовая кристаллическая масса. Озон растворим в четыреххлористом углероде, в ледяной уксусной кислоте, в жидком азоте, в воде. Образуется при пропускании тихого электрического разряда через воздух или кислород (свежий запах после грозы обусловлен наличием небольших количеств озона в атмосфере), окислении влажного фосфора, действии лучей радия, ультрафиолетовых или катодных лучей на кислород воздуха, разложении перекиси водорода, электролизе серной кислоты (и др.
кислородсодержащих кислот), действии фтора на воду и т. д. Содержание в земной атмосфере ничтожно; слои воздуха вблизи земной поверхности содержат озона меньше, чем высшие слои атмосферы; на высоте 1.050 м
(в области Монблана) Леви нашел 0—3,7 мг,
на высоте 3.000 м
—9,4 мг.
озона на 100 м куб
воздуха. В технике и лабораториях для получения озона применяются аппараты—озонаторы. Для озонирования кислород или воздух пропускается между двумя электродами, соединенными с источником тока высокого напряжения.
Озон в чистом виде выделяется из смеси озона с кислородом при охлаждении жидким воздухом. Озон легко разлагается, причем разложение чистого озона ускоряется в присутствии двуокиси марганца, свинца, окислов азота. В присутствии воды разложение озона замедляется, сухой озон при 0° разлагается в 30 раз быстрее, чем влажный озон при 20,4°. Озон обладает чрезвычайно сильным окислительным действием. Он выделяет йод из йодистого калия, окисляет ртуть, переводит сернистые металлы в сернокислые соли, обесцвечивает органические красители и т. д. Озон разрушает каучуковые трубки. Эфир, спирт, светильный газ, вата при соприкосновении с сильно озонированным кислородом воспламеняются. При действии озона на ненасыщенные органические соединения образуются продукты присоединения озониды. Озон применяется для стерилизации воды, для дезодорирования - уничтожения дурного запаха, в препаративной органической практике.
Физические свойства
Химические свойства и методы получения
Список использованной литературы
- Волков, А.И., Жарский, И.М. Большой химический справочник / А.И. Волков, И.М. Жарский. - Мн.: Современная школа, 2005. - 608 с ISBN 985-6751-04-7.