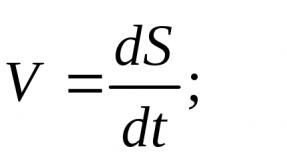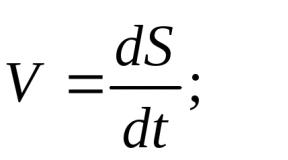Процесс омыления. Химические свойства жиров. Химические реакции триглицеридов
Каждый, кто уже пытался варить мыло с нуля, наверняка знает, что такое мыльный калькулятор. Но как он работает, и откуда берутся выдаваемые им показатели? В этой статье мы поговорим о базовых принципах мыловарения и расскажем, что такое щелочь, почему без нее никак нельзя изготовить мыло «с нуля», как рассчитывать ее количество и почему нужно разводить ее в воде.
Омыление.
Омылением называется реакция щелочного гидролиза жиров, сущность которой состоит в расщеплении молекула жира (масла) на глицерин и жирные кислоты; последние в щелочной среде образуют соли (которые суть и есть наше мыло):
Однако, если мы просто положим сухие шарики щелочи в твердое или даже жидкое масло, то ровным счетом ничего не произойдет. Жиры гидролизуются и становятся в состоянии реагировать с щелочью только в водной среде.
Таким образом, поскольку щелочь всегда действует в водном растворе, эту формулу можно представить более просто:
Щелочь + Вода + Жир = Мыло + Глицерин
Как видно из этой формулы, обойтись без щелочи в процессе мыловарения никак нельзя. Если же заморачиваться с суровой химией на дому все же не хочется, то ваш выбор – мыло из основы. Основа содержит уже готовые соли жирных кислот, так что проводить омыление самому не придется. Но продолжим про мыло с нуля.
Природные масла представляют собой смесь, содержащую различные по строению и массе молекулы жиров. Чтобы реакция омыления в такой смеси прошла полностью, и при этом не образовался избыток едкой щелочи, необходимо точно подобрать количества взаимодействующих компонентов.
Это можно сделать и самостоятельно, зная состав каждого масла и рассчитав параметры соответствующих химических реакций. Однако, чтобы облегчить мыловарам эту задачу была составлена таблица омыления для наиболее часто используемых масел (см. таблицу в конце статьи).
Кстати, в отличие от мыльного калькулятора, эту таблицу можно распечатать и взять с собой на необитаемый остров, где нет электричества и интернета. Ну, если вы внезапно захотите поварить мыло в совсем полном одиночестве.
Для получения твердого мыла используется NaOH (едкий натр или каустическая сода), тогда как для жидкого рекомендуется применять KOH (едкое кали, оно же каустический поташ).
Чтобы просто и быстро определить, сколько щелочи необходимо для полного омыления нужного количества масла надо умножить массу масла на коэффициент из таблицы. А для приготовления мыла из смеси нескольких масел нужно отдельно посчитать количество щелочи, необходимое для каждого из компонентов, а затем просто сложить полученные веса.
Пример: рассчитаем количество едкого натра, необходимое для полного омыления 0,5 кг масла ши и 0,5 кг кунжутного.
Ши: 500 грамм умножаем на табличный коэффициент масла какао для NaOH, т. е. на 0,1282 и получаем: 500*0,1282 = 64,1 грамма NaOH.
Кунжут: аналогично, 1000*0,1376 = 68,8 грамма NaOH.
Всего потребуется 64,1+ 68,8 = 132,9 грамма щелочи.
Необходимое разведение щелочи.
Не стоит забывать, что масса щелочи считается для твердого порошка (или гранул) 100%-й щелочи, а не для ее водного раствора. Остановимся на этом подробнее. Дело в том, что наиболее часто используемый принцип разбавл ения – брать воду из расчета 33% от веса масел. Это значение стоит «по умолчанию» в большинстве мыльных калькуляторов:

Однако надо понимать, что сама вода как таковая в реакцию не вступает, и уж тем более, никак не реагирует с маслом, а служит реакционной средой, растворителем! Она нужна именно для создания реакционной среды – чтобы щелочь могла полноценно проявить свои свойства, а также для гидролизации жира, т.е. его подготовки к собственно химическому взаимодействию.
Таким образом, главное, на что влияет количество добавленной воды – это по сути скорость затвердевания сваренного мыла. При этом даже правильнее рассчитывать воду не сколько от масла/жира, а от всей реакционной массы. Обычно это требуется при варке совсем небольших объемов мыла или при использовании незнакомых рецептов, где важно не переборщить с водой или подозревается долгое затвердевание:
Пример:
разведем щелочь водой в количестве 33% от массы реакционной смеси.
*для 100 граммов кокосового масла это 0,33*(100+18,3) = 39 граммов,
*а для 100 граммов масла жожоба = 0,33*(100+6,6) = 35,2 грамма.
Если по каким-то причинам вам нужно, чтобы мыло сохло помедленнее – разводите щелочь в большем количестве воды. И наоборот, чтобы ускорить процесс, добавьте ее меньше.
Важная деталь! Не стоит разводить щелочь с водой меньше, чем 1:1! То есть масса воды всегда должна быть равна или больше, чем масса щелочи.
Таблица коэффициентов омыления.
|
|
|
|||
|
Арахисовое |
|||||
|
Абрикосовых косточек |
|||||
|
Аргановое |
|||||
|
Виноградных косточек |
|||||
|
Воск пчелиный |
|||||
|
Воск карнаубский |
|||||
|
Грецкого ореха |
|||||
|
Дерева Ши (Карите) |
|||||
|
Жир говяжий |
|||||
|
Жир гусиный |
|||||
|
Жир куриный |
|||||
|
Жир молочный |
|||||
|
Жир овечий |
|||||
|
Жир свиной |
|||||
|
Жир утиный |
|||||
|
Зародышей пшеницы |
|||||
|
Зародышей риса |
|||||
|
Кукурузное |
|||||
|
Касторовое |
|||||
|
Кокосовое |
|||||
|
Конопляное |
|||||
|
Кунжутное |
|||||
|
Лавра благородного |
|||||
|
Лесного ореха |
|||||
|
Макадамии |
|||||
|
Маракуйя |
|||||
|
Миндальное |
|||||
|
Оливковое |
|||||
|
Ослинника |
|||||
|
Пальмовое |
|||||
|
Персиковых косточек |
|||||
|
Подсолнечное |
|||||
|
Рапсовое |
|||||
|
Сафлоровое |
|||||
|
Тмина черного |
|||||
|
Тыквенное |
|||||
|
Шиповника |
|||||
|
Стеарин пальмовый |
При перепечатке или копировании статьи просим указывать активную ссылку на сайт и авторство.
краткое содержание других презентаций«Удивительные свойства воды» - Поведение воды. Много тайн. Нанотрубочная вода. Температуры кипения и замерзания. Дейтерий. Сухая вода. Исследования Масару Эмото. Удивительные свойства воды. Вода вокруг нас. Физические свойства воды. Тяжёлая вода.
«Химическая промышленность мира» - Минеральные удобрения. Значение химической промышленности. Химическая промышленность мира. Лидеры по производству. Азотные удобрения. Химическая промышленность. Полимерные материалы. Фосфорные удобрения. Лидеры по производству серной кислоты. Основная химия. Крупнейшие транснациональные корпорации. Калийные удобрения. Принцип размещения.
««Амины» 10 класс» - Строение. Химические свойства. Классификация аминов. Задание. Изомерия аминов. Номенклатура аминов. Что такое амины. Основные свойства аминов. Химические свойства аминов. Ацетилен. Физические свойства. Горение. Амины. Аммиак.
«Использование алюминия» - Знаете ли вы о недостатках алюминиевых кастрюль? Содержание алюминия в организме человека (на 70 кг массы тела) составляет 61 мг. Алюминий, ртуть, свинец и кадмий – враги человека в быту. Принимает участие в построении эпителиальной и соединительной тканях. Алюминий играет важную биологическую роль в жизни человека. Какую вы используете посуду? Определить, насколько широко алюминиевая посуда используется в быту в наше время.
«Свойства алканов» - Физические свойства алканов. Природный газ. Соединения. Номенклатура ИЮПАК. Галогенирование метана. Изучите информацию параграфа. Правила работы за компьютером. Алканы. Природные источники углеводородов. Химические свойства алканов. Вариант специальных упражнений. Алкены и алкины. Предельные углеводороды. Природный газ как топливо. Водород. Решаем задачи. Базовый уровень. Номенклатура.
«Теория органической химии» - Гипотезы химии. Органическая химия. Строение органических молекул. Спирты. Основные классы органических соединений. Человек. Продукты. Простые эфиры. Галогены. Функции. Времена Средневековья. Ионы. Альдегиды. Ученики. Немного из истории. Разработка теории валентности. Определение органической химии.
Лабораторная работа № 6
Свойства липидов
Опыт 1. Эмульгирование жира.
Принцип метода. При взбалтывании жира с водой, раствором желчи, белка, мыла, соды образуется эмульсия. Вода с жиром дает нестойкую, а остальные растворы стойкую эмульсию.
Это обусловлено тем, что поверхностно – активные частицы желчных кислот, белка, мыла обволакивают капельки жира и препятствуют их слиянию. Эмульгирование жира содой обусловлено образованием мыла в результате взаимодействия углекислого натрия с присутствующими в жире свободными жирными кислотами.
Порядок выполнения работы.
В 4 пробирки наливают по 1 мл: в первую – дистиллированной воды, во вторую – 1% раствора яичного белка, в третью – 1% раствора мыла, в четвертую – 1% раствора углекислого натрия Na 2 CO 3 10H 2 O. В каждую пробирку добавляют по 2 капли растительного масла и тщательно взбалтывают.
Результаты работы заносят в таблицу:
Примечание: Степень эмульгирования выражают знаком плюс (+),
Отсутствие эмульгирования выражают знаком минус (–).
Опыт 2. Омыление жиров (гидролиз).
В результате гидролиза происходит расщепление связей в молекулах глицеридов при действии воды, причем элементы воды присоединяются по месту возникающих свободных валентностей с образованием двух структурных элементов жиров - жирных кислот и глицерина. Участвующая в реакции вода диссоциирует на водород и гидроксил. Водород присоединяется к кислотному остатку, а гидроксил - к спиртовому радикалу. Практически процесс распада триглицеридов протекает последовательно, с образованием промежуточных продуктов реакции – моно- и диглицеридов:
Глубина гидролитического распада определяется содержанием свободных жирных кислот и характеризуется величиной кислотного числа жира (КЧ).
Скорость гидролитического расщепления жиров находится в прямой зависимости от концентрации водородных ионов, которые, как и ионы гидроксила, являются катализаторами этой реакции. Процесс гидролиза протекает значительно быстрее в присутствии некоторых металлов или их оксидов, например Zn, ZnO, CaO, MgO.
Низкомолекулярные кислоты сильно меняют вкус и запах жира. По этим изменениям и определяется пищевая порча жира. Из-за гидролиза особенно сильно изменяются органолептические показатели коровьего и кокосового масел, имеющих в своем составе низкомолекулярные летучие жирные кислоты. Высокомолекулярные жирные кислоты вкуса и запаха не имеют, а потому увеличение их содержания при гидролизе не изменяет органолептических показателей жира.
Принцип метода. Омыление – это гидролиз сложных эфиров под действием щёлочи. При этом получается соль органической кислоты (мыло, т. е. смесь солей высших жирных кислот) и спирт (глицерин – трёхатомный спирт)
Омыление жиров производится в автоклавах, щелочью или ферментативным путем (фермент липаза). Быстрее омыление происходит в водно-спиртовом растворе и спиртово-щелочном растворе.
Схема омыления жира:
Порядок выполнения работы.
В пробирку отвешивают 2 г. жира и приливают 5 мл. 1%-ного спиртового раствора щелочи. Пробирку закрывают пробкой со стеклянной трубой (холодильником) и ставят в водяную баню на 10-12 мин. при (t=80 o C). После окончания омыления (образуется однородный раствор мыла) смесь выливают в фарфоровую чашку, добавляют воду и при нагревании на водяной бане удаляют спирт.
Полученный раствор мыла используют для определения составных частей жира.
Оформление опыта: результат опыта и уравнение реакции записывают в тетрадь.
1. Реакция гидролиза или омыления.
Реакция этерификации является обратимой, поэтому в присутствии кислот будет протекать обратная реакция, называемая гидролизом, в результате которой образуются исходные жирные кислоты и спирт:
Реакция гидролиза ускоряется под действием щелочей; в этом случае гидролиз необратим:
так как получающаяся карбоновая кислота со щелочью образует соль:
2. Реакция присоединения.
Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород.
3. Реакция восстановления.
Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов.
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
Механизм протекания реакции этерификации. Рассмотрим в качестве примера получение этилового эфира бензойной кислоты:
Каталитическое действие серной кислоты состоит в том, что она активирует молекулу карбоновой кислоты. Бензойная кислота протонируется по атому кислорода карбонильной группы (атом кислорода имеет неподеленную пару электронов, за счет которой присоединяется протон). Протонирование приводит к превращению частичного положительного заряда на атоме углерода карбоксильной группы в полный, к увеличению его электрофильности. Резонансные структуры (в квадратных скобках) показывают делокализацию положительного заряда в образовавшемся катионе. Молекула спирта за счет своей неподеленной пары электронов присоединяется к активированной молекуле кислоты. Протон от остатка спирта перемещается к гидроксильной группе, которая при этом превращается в «хорошо уходящую» группу Н 2 О. После этого отщепляется молекула воды с одновременным выбросом протона (возврат катализатора).
Приготовление мыла - один из самых древних химических синтезов. Конечно, этот процесс гораздо «моложе», чем процесс получения этилового спирта; очевидно, стремление к чистоте появилось у человека много позже желания к отравлению алкоголем. Когда германские племена во времена Цезаря варили козье сало с поташем, вымытым из пепла костров, они проводили ту же самую реакцию, которая осуществляется сейчас в грандиозных масштабах современными мыловарами, а именно гидролиз глицеридов. В результате гидролиза образуются соли карбоновых кислот и глицерин.
Мыло, которое мы используем, представляет собой смесь натриевых солей жирных кислот с длинной цепью - именно смесь, поскольку жир, из которого его синтезируют, является смесью. Мыло может отличаться по составу и методу получения: если его делают из оливкового масла, то получают кастильское мыло; для того чтобы мыло было прозрачным, к нему добавляют спирт; для того чтобы оно плавало, его делают пенообразным; к мылу можно добавить душистые вещества, красители и антисептики; если используется калиевая соль вместо натриевой соли, то получается жидкое мыло. Однако с химической точки зрения все мыла одинаковы и природа их действия во всех случаях одна и та же.

Рис. 20.1. Эмульгирование масла в воде в присутствии мыла. Неполярные углеводородные цепи растворимы в масле; полярные группы - растворимы в воде. Одинаково заряженные капли отталкивают друг друга.
Очищающее действие мыла - чрезвычайно сложный процесс. Некоторое представление о факторах, определяющих его, можно получить из следующей упрощенной картины. Молекула мыла имеет полярный конец - и неполярный конец - длинную цепь, состоящую из 12-18 атомов углерода; полярный конец растворим в воде, а неполярный - в масле. Обычно капли масла при контакте с водой стремятся слиться так, что образуется два слоя - масла и воды, но в присутствии мыла картина резко меняется. Неполярные концы молекул мыла растворяются в каплях масла, в то время как карбоксилатные концы остаются в водной фазе (рис. 20.1). Из-за наличия отрицательно заряженных карбоксилатных групп каждая капля масла окружена ионной оболочкой. Отталкивание одинаковых зарядов удерживает капли масла от слияния, в результате чего образуется устойчивая эмульсия масла в воде. Очищающее действие мыла обусловлено тем, что оно эмульгирует жир и сало, содержащие грязь. Как будет показано ниже, подобное эмульгирующее, а следовательно, и очищающее действие свойственно не только солям карбоновых кислот, но также любым
молекулам, содержащим длинный неполярный остаток и полярную группу (разд. 20.25).
Жесткая вода содержит кальциевые и магниевые соли, которые реагируют с мылом с образованием нерастворимых кальциевых и магниевых солей карбоновых кислот.