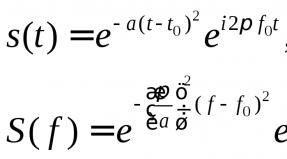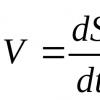Окисление жирных кислот (β-окисление). последовательность. реакции. B-окисление жирных кислот Окисление пальмитиновой кислоты
Как уже указывалось, значительную часть энергии, извлекаемой в процессе окисления, животный организм получает из жирных кислот, которые расщепляются путем окисления при β-углеродном атоме.
β-Окисление жирных кислот было впервые изучено в 19004 г. Ф. Кноопом. В дальнейшем было установлено, что β-окисление осуществляется только в митохондриях. Благодаря работам Ф. Линена с сотрудниками (1954-1958 г.г.) были выяснены основные ферментативные процессы окисления жирных кислот. В честь ученых, открывших данный путь окисления жирных кислот, процесс β-окисления получил название цикла Кноопа-Линена .
β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА. Метаболический путь - β-окисление - назван так потому, что реакции окисления жирной кислоты происходят у β-углеродного атома. Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК (цикле трикарбоновых кислот) служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования. β-Окисление жирных кислот происходит только в аэробных условиях.
Все реакции многостадийного окисления ускоряются специфическими ферментами. β-окисление высших жирных кислот является универсальным биохимическим процессом, протекающим во всех живых организмах. У млекопитающих этот процесс происходит во многих тканях, в первую очередь в печени, почках и сердце. Окисление жирных кислот происходит в митохондриях. Ненасыщенные высшие жирные кислоты (олеиновая, линолевая, линоленовая и др.) предварительно восстанавливаются до предельных кислот.
Проникновению жирных кислот в митохондриальный матрикс предшествует их активация путем образования соединения с коэнзимом А (НS~КоА), содержащего макроэргическую связь. Последняя, видимо, способствует более гладкому протеканию реакций окисления образовавшегося соединения, которое называют ацилкоэнзимом А (ацил-КоА).
Взаимодействие высших жирных кислот с КоА ускоряется специфическими лигазами - ацил-КоА-синтетазами трех видов, специфичных соответственно для кислот с коротким, средним и длинным углеводородными радикалами. Они локализованы в мембранах эндоплазматической сети и в наружной мембране митохондрий. По-видимому, все ацил-КоА-синтетазы являются мультимерами; так, фермент из микросом печени имеет молекулярную массу 168 кДа и состоит из 6 идентичных субъединиц. Реакция активации жирных кислот протекает в 2 этапа:
а) сначала жирная кислота реагирует с АТФ с образаванием ациладенилата:
RCOOH + ATФ → RCO~AMФ + ФФ
б) затем идет образование активированной формы ацил-КоА:
RCO~AMФ + НS~КоА → RCO~SKoA + AMФ
Пирофосфат (ФФ) быстро гидролизуется под действием пирофосфатазы, в результате чего вся реакция оказывается необратимой: ФФ + H 2 O → 2Ф
Суммарное уравнение :
RCOOH + ATФ+ НS~КоА→ RCO~SKoA + AMФ + 2Ф
Жирные кислоты с короткой и средней длиной цепи (от 4 до 12 атомов углерода) могут проникать в матрикс митохондрий путём диффузии, там происходит их активация. Жирные кислоты с длинной цепью, которые преобладают в организме человека (от 12 до 20 атомов углерода), активируются ацил-КоА синтетазами, расположенными на внешней мембране митохондрий.
Внутренняя мембрана митохондрий непроницаема для длинноцепочных ацил-КоА, образовавшихся в цитоплазме. Переносчиком активированных жирных кислот служит карнитин (витамин В т) , который поступает с пищей или синтезируется из незаменимых аминокислот лизина и метионина.
В наружной мембране митохондрий находится фермент карнитинацилтрансфераза I (карнитин-палъмитоилтрансфераза I), катализи- рующий реакцию с образованием ацилкарнитина:
RCO~SKoA + H 3 C- N + -CH 2 -CH-CH 2 -COOH ↔ H 3 C- N + -CH 2 -CH-CH 2 -COOH + HS~KoA
Ацил-КоА Карнитин (В т) Ацилкарнитин Кофермент А
Этот фермент является регуляторным, он регулирует скорость поступления ацильных групп в митохондрии, а, следовательно, и скорость окисления жирных кислот.
Образовавшийся ацилкарнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны и транспортируется с помощью карнитинацилкарнитинтранслоказы на внутреннюю поверхность внутренней мембраны митохондрий, где фермент карнитинацилтрансфераза II катализирует перенос ацила на внутримитохондриальный КоА, то есть обратную реакцию (рис.9).

Рис.9. Перенос жирных кислот с длинным углеводородным радикалом через мембраны митохондрий
Итак, ацил-КоА становится доступным для ферментов β-окисления. Свободный карнитин возвращается на цитозольную сторону внутренней мембраны митохондрий той же транслоказой. После этого ацил-КоА включается в реакции β-окисления.
В матриксе митохондрий происходит катаболизм (распад) ацил-КоА в результате повторяющейся последовательности из четырех реакций .
1) Первой реакцией в каждом цикле является его окисление ферментом ацил-КоА-дегидрогеназой , коферментом которого является ФАД. Дегидрирование происходит между β - и α - атомами углерода, в результате чего в углеродной цепи образуется двойная связь и продуктом этой реакции является еноил-КоА:
R-CH 2 -CH 2 CO~SKoA + ФАД → R-CH=CHCO~SKoA + ФАДН 2
Ацил-КоА Еноил-КоА
2) На втором этапе цикла окисления жирных кислот происходит гидратация двойной связи еноил-КоА, в результате чего образуется β-гидроксиацил-КоА. Реакция катализируется ферментом еноил-КоА-гидратазой :
R-CH=CHCO~SKoA +Н 2 О → R-CH-CH 2 CO~SKoA
Еноил-КоА β- гидроксиацил-КоА
3) На третьем этапе цикла β-гидроксиацил-КоА подвергается дегидрированию (второму окислению) при участии фермента β-гидроксиацил-КоА-дегидрогеназы , коферментом которой является НАД + . Продуктом данной реакции является β-кетоацил-КоА:
R-CH-CH 2 CO~SKoA + НАД + → R-CОCH 2 CO~SKoA + НАДН + Н +
β- гидроксиацил-КоА β- кетоацил-КоА
4) Последняя реакция цикла окисления жирных кислот катализируется ацетил-КоА-ацилтрансферазой (тиолазой) . На этом этапе β-кетоацил-КоА взаимодействует со свободным КоА и расщепляется с образованием, во-первых, двухуглеродного фрагмента, содержащего два концевых углеродных атома исходной жирной кислоты в виде ацетил-КоА, и, во-вторых, КоА-эфира жирной кислоты, укороченной теперь на два атома углерода. По аналогии с гидролизом эту реакцию называют тиолизом :
R-CОCH 2 CO~SKoA + НS~KoA → CH 3 CO~SKoA + R 1 CO~SKoA
β- кетоацил-КоА Ацетил-КоА Ацил-КоА ,
укороченный на
2 углеродных атома
Укороченный ацил-КоА подвергается далее следующему циклу окисления, начинающемуся с реакции, катализируемой ацил-КоА-дегидрогеназой (окисление), затем следует реакция гидратации, реакция второго окисления, тиолазная реакция, то есть этот процесс многократно повторяется (рис.10).
β- Окисление высших жирных кислот протекает в митохондриях. В них же локализованы ферменты дыхательного цикла, ведущие передачу атомов водорода и электронов на кислород в условиях окислительного фосфорилирования АДФ, поэтому β-окисление высших жирных кислот является источником энергии для синтеза АТФ.

Рис.10. Окисление жирной кислоты
Окончательным продуктом β-окисления высших жирных кислот с четным числом углеродных атомов является ацетил-КоА , а с нечетным - пропионил-КоА .
Если бы ацетил-КоА накапливался в организме, то запасы HS~KoA скоро исчерпались бы, и окисление высших жирных кислот остановилось. Но этого не происходит, так как КоА быстро освобождается из состава ацетил-КоА. К этому приводит ряд процессов: ацетил-КоА включается в цикл трикарбоновых и дикарбоновых кислот или весьма близкий к нему глиоксилевый цикл, или ацетил-КоА используется для синтеза стеролов и соединений, содержащих изопреноидные группировки и т.п.
Пропионил-КоА, являющийся конечным продуктом β-окисления высших жирных кислот с нечетным числом углеродных атомов, превращается в сукцинил-КоА, который утилизируется через цикл трикарбоновых и дикарбоновых кислот.
Около половины жирных кислот в организме человека ненасыщенные .
β-Окисление этих кислот идёт обычным путём до тех пор, пока двойная связь не окажется между третьим и четвёртым атомами углерода. Затем фермент еноил-КоА-изомераза перемещает двойную связь из положения 3-4 в положение 2-3 и изменяет цис-конформацию двойной связи на транс-, которая требуется для β-окисления. В этом цикле β-окисления первая реакция дегидрирования не происходит, так как двойная связь в радикале жирной кислоты уже имеется. Далее циклы β-окисления продолжаются, не отличаясь от обычного пути. Основные пути метаболизма жирных кислот демонстрирует ри.11.

Рис.11.Основные пути метаболизма жирных кислот
Недавно было обнаружено, что помимо β-окисления – основного пути катаболизма жирных кислот, в тканях мозга происходит α-окисление жирных кислот с числом атомов углерода (С 13 -С 18), то есть последовательное отщепление одноуглеродных фрагментов от карбоксильного конца молекулы.
Этот тип окисления наиболее характерен для растительных тканей, но может происходить и в некоторых тканях животных. α-Окисление имеет циклический характер, причем цикл состоит из двух реакций.
Первая реакция заключается в окислении жирной кислоты пероксидом водорода в соответствующий альдегид и СО 2 с участием специфической пероксидазы :

В результате этой реакции углеводородная цепь укорачивается на один атом углерода.
Суть второй реакции заключается в гидратации и окслении образовавшегося альдегида в соответствующую карбоновую кислоту под действием альдегиддегидрогеназы , содержащей окисленную форму кофермента НАД:
Затем цикл α-окисления повторяется снова. В сравнении с β-окислением этот тип окисления энергетически менее выгоден.
ω-Окисление жирных кислот. В печени животных и у некоторых микроорганизмов существует ферментная система, обеспечивающая ω-окисление жирных кислот, то есть окисление по концевой СН 3 -группе, обозначаемой буквой ω. Сначала под действием монооксигеназы происходят гидроксилирование с образованием ω-оксикислоты:

Затем ω-оксикислота окисляется в ω-дикарбоновую кислоту под действием соответствующей дегидрогеназы :
Полученная таким образом ω-дикарбоновая кислота укорачивается с любого конца с помощью реакций β-окисления.
Для преобразования энергии, заключенной в жирных кислотах, в энергию связей АТФ существует метаболический путь окисления жирных кислот до СО 2 и воды, тесно связанный с циклом трикарбоновых кислот и дыхательной цепью. Этот путь называется β-окисление , т.к. происходит окисление 3-го углеродного атома жирной кислоты (β-положение) в карбоксильную группу, одновременно от кислоты отщепляется ацетильная группа, включающая С 1 и С 2 исходной жирной кислоты.
Элементарная схема β-окисления
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при липолизе собственных внутриклеточных ТАГ. Суммарное уравнение окисления пальмитиновой кислоты выглядит следующим образом:
Пальмитоил-SКоА + 7ФАД + 7НАД + + 7Н 2 O + 7HS-KoA → 8Ацетил-SКоА + 7ФАДН 2 + 7НАДН
Этапы окисления жирных кислот
1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота должна активироваться в цитозоле. Это осуществляется присоединением к ней коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.
Ацил-SКоА-синтетазы находятся в эндоплазматическом ретикулуме, на наружной мембране митохондрий и внутри них. Существует широкий ряд синтетаз, специфичных к разным жирным кислотам.
Реакция активации жирной кислоты
2. Ацил-SКоА не способен проходить через митохондриальную мембрану, поэтому существует способ его переноса в комплексе с витаминоподобным веществом карнитином (витамин В11). На наружной мембране митохондрий имеется фермент карнитин-ацилтрансфераза I .

Карнитин-зависимый транспорт жирных кислот в митохондрию
Карнитин синтезируется в печени и почках и затем транспортируется в остальные органы. Во внутриутробном периоде и в первые годы жизни значение карнитина для организма чрезвычайно велико. Энергообеспечение нервной системы детского организма и, в частности, головного мозга осуществляется за счет двух параллельных процессов: карнитин-зависимого окисления жирных кислот и аэробного окисления глюкозы. Карнитин необходим для роста головного и спинного мозга, для взаимодействия всех отделов нервной системы, ответственных за движение и взаимодействие мышц. Существуют исследования, связывающие с недостатком карнитина детский церебральный паралич и феномен "смерти в колыбели ".
Дети раннего возраста, недоношенные и дети с малой массой особенно чувствительны к недостаточности карнитина. Эндогенные запасы у них быстро истощаются при различных стрессовых ситуациях (инфекционные заболевания, желудочно-кишечные расстройства, нарушения вскармливания). Биосинтез карнитина недостаточен, а поступление с обычными пищевыми продуктами неспособно поддержать достаточный уровень в крови и тканях.
3. После связывания с карнитином жирная кислота переносится через мембрану транслоказой . Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-SКоА который вступает на путь β-окисления.
4. Процесс собственно β-окисления состоит из 4-х реакций, повторяющихся циклически. В них последовательно происходит окисление (ацил-SКоА-дегидрогеназа), гидратирование (еноил-SКоА-гидратаза) и вновь окисление 3-го атома углерода (гидроксиацил-SКоА-дегидрогеназа). В последней, трансферазной, реакции от жирной кислоты отщепляется ацетил-SКоА . К оставшейся (укороченной на два углерода) жирной кислоте присоединяется HS-КоА, и она возвращается к первой реакции. Все повторяется до тех пор, пока в последнем цикле не образуются два ацетил-SКоА.

Последовательность реакций β-окисления жирных кислот
Расчет энергетического баланса β-окисления
Ранее при расчете эффективности окисления коэффициент P/O для НАДH принимался равным 3,0, для ФАДH 2 – 2,0.
По современным данным значение коэффициента P/O для НАДH соответствует 2,5, для ФАДH 2 – 1,5.
При расчете количества АТФ, образуемого при β-окислении жирных кислот необходимо учитывать:
- количество образуемого ацетил-SКоА – определяется обычным делением числа атомов углерода в жирной кислоте на 2.
- число циклов β-окисления . Число циклов β-окисления легко определить исходя из представления о жирной кислоте как о цепочке двухуглеродных звеньев. Число разрывов между звеньями соответствует числу циклов β-окисления. Эту же величину можно подсчитать по формуле (n/2 -1), где n – число атомов углерода в кислоте.
- число двойных связей в жирной кислоте. В первой реакции β-окисления происходит образование двойной связи при участии ФАД. Если двойная связь в жирной кислоте уже имеется, то необходимость в этой реакции отпадает и ФАДН 2 не образуется. Количество недополученных ФАДН 2 соответствует числу двойных связей. Остальные реакции цикла идут без изменений.
- количество энергии АТФ , потраченной на активацию (всегда соответствует двум макроэргическим связям).
Пример. Окисление пальмитиновой кислоты
- Так как имеется 16 атомов углерода, то при β-окислении образуется 8 молекул ацетил-SКоА . Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН (7,5 АТФ), 1 молекула ФАДН 2 (1,5 АТФ) и 1 молекула ГТФ, что эквивалентно 10 молекулам АТФ. Итак, 8 молекул ацетил-SКоА обеспечат образование 8×10=80 молекул АТФ.
- Для пальмитиновой кислоты число циклов β-окисления равно 7 . В каждом цикле образуется 1 молекула ФАДН 2 (1,5 АТФ) и 1 молекула НАДН (2,5 АТФ). Поступая в дыхательную цепь, в сумме они "дадут" 4 молекулы АТФ. Таким образом, в 7 циклах образуется 7×4=28 молекул АТФ.
- Двойных связей в пальмитиновой кислоте нет .
- На активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ .
- Таким образом, суммируя, получаем 80+28-2 =106 молекул АТФ образуется при окислении пальмитиновой кислоты.
Углеводы составляют основную часть пищевого рациона человека и обеспечивают значительную часть энергетических потребностей организма. При сбалансированном питании суточное количество углеводов в среднем в 4 раза превышает количество белков и жиров.
Роль углеводов в питании:
1. Углеводы выполняют энергетическую функцию. При окислении 1 г углеводов освобождается 4.1 ккал энергии. Глюкоза, до которой расщепляется основная часть углеводов, является основным энергетическим субстратом в организме.
2. Мышечная деятельность сопровождается значительным потреблением глюкозы. При физической работе углеводы расходуются в первую очередь, и только при истощении их запасов (гликоген) в обмен включаются жиры.
3. Углеводы необходимы для нормальной функции центральной нервной системы, клетки которой весьма чувствительны к недостатку глюкозы в крови.
4. Углеводы выполняют структурную функцию. Простые углеводы служат источником образования гликопротеидов, которые составляют основу соединительной ткани.
5. Углеводы принимают участие в обмене белков и жиров. Из углеводов могут образовываться жиры.
6. Углеводы растительного происхождения (целлюлоза, пектиновые вещества) стимулируют моторику кишечника, способствуют выведению накаливающихся в нем токсических продуктов.
Источниками углеводов служат преимущественно растительные продукты, особенно мучные изделия, крупы, сладости. В большинстве продуктов углеводы представлены в виде крахмала и в меньшей степени в виде дисахаридов (молоко, сахарная свекла, фрукты и ягоды). Для лучшего усвоения углеводов необходимо, чтобы большая их часть поступала в организм в виде крахмала.
Крахмал постепенно расщепляется в желудочно-кишечном тракте до глюкозы, которая поступает в кровь небольшими порциями, что улучшает ее утилизацию и поддерживает постоянный уровень сахара в крови. При введении сразу больших количеств Сахаров концентрация глюкозы в крови резко возрастает, и она начинается выделяться с мочой. Наиболее благоприятными считаются такие условия, когда 64% углеводов потребляются в виде крахмала, а 36% - в виде Сахаров.
Норма потребления углеводов зависит от интенсивности труда. При физической работе углеводы требуются в большем количестве. В среднем на 1 кг массы тела требуется 4-6-8 г углеводов в сутки, т.е. примерно в 4 раза больше, чем белков и жиров.
Избыточное потребление углеводов может приводить к тучности и излишней перегрузке ЖКТ, т.к. растительная пища, богатая углеводами, обычно более объемистая, вызывает чувство тяжести, ухудшает общую усвояемость продуктов питания.
Недостаток углеводов в пище также нежелателен из-за опасности развития гипогликемических состояний. Углеводная недостаточность, как правило, сопровождается общей слабостью, сонливостью, снижением памяти, умственной и физической работоспособности, головной болью, снижением усвояемости белков, витаминов, ацидозом и др. В связи с этим количество углеводов в суточном рационе не должно быть меньше 300 г
К группе углеводов тесно примыкают встречающиеся в большинстве растительных продуктов плохо усвояемые организмом человека вещества - пектиновые вещества (неусвояемые углеводы) и клетчатка.
Пектиновые вещества - это растительные желирующие вещества, обладающие высокой сорбционной (поглощающей) способностью. Они благоприятно действуют при лечении заболеваний органов пищеварения, ожогов и язв, а также обладают способностью обезвреживать некоторые ядовитые вещества (особенно активно выводят из организма соли тяжёлых металлов, например соединения свинца).
Много пектиновых веществ в апельсинах, яблоках, чёрной смородине и других фруктах и ягодах.
Клетчатка (другие названия - грубые растительные, или неперевариемые, или пищевые, или диетические, волокна) - это полисахарид, входящий в состав массивных оболочек клеток растительной пищи. Имеет волокнистую, довольно грубую структуру.
Обычные источники пищевых волокон - отруби, хлеб, крупы (особенно гречневая и овсяная). Большие их количества содержатся во многих овощах, фруктах, листьях и стеблях растений; особенно много - в оболочках зерен и в кожуре плодов. При консервировании овощей и плодов пищевые волокна полностью сохраняются (кроме соков без мякоти).
Не обладая высокой калорийностью, большинство овощей и фруктов, тем не менее, благодаря высокому содержанию неусвояемых углеводов, способствуют быстрому и довольно стойкому чувству насыщения: поскольку пищевые волокна обладают способностью впитывать много жидкости, они набухают в желудке, заполняют часть его объема - и в результате насыщение происходит быстрее. Сами же волокна не несут в организм ни единой калории.
Ценность волокон и в том, что, являясь довольно объёмистой составляющей ежедневного питания, человеческим организмом они не перевариваются. Наличие большого количества клетчатки несколько снижает общую усвояемость пищи. Однако и полное ее отсутствие вредно отзывается на работе желудочно-кишечного тракта.
Клетчатка вызывает правильную перистальтику (движение стенок) кишечника и тем самым способствует передвижению пищи по пищеварительному каналу и выведению из организма неусвоенных пищевых веществ.
Необходимое количество клетчатки в пище обеспечивается правильным сочетанием животных и растительных продуктов в суточном рационе.
После расщепления клетчатка, как и другие полисахариды, превращается в сахара. Однако в пищеварительном тракте человека отсутствуют ферменты, которые могли бы осуществить подобное расщепление. Только незначительная часть ее может подвергнугься перевариванию под влиянием находящихся в кишечнике микроорганизмов, основная же масса без изменений удаляется из организма. Благодаря этой внешней бесполезности клетчатка и пектины получили название балластных веществ.
Балластные вещества выполняют важную функцию и в процессе пищеварения: волокна ферментируются кишечными бактериями и буквально помогают перетирать пищу; раздражая нервные окончания кишечных стенок, они усиливают перистальтику. Если пища бедна балластными веществами, нарушается двигательная активность кишечника, поэтому, чтобы избежать этих нарушении рекомендуется использовать грубую пищу, богатую клетчаткой.
Помимо этого пищевые волокна обладают способностью стимулировать обмен веществ, поскольку волокна препятствуют всасыванию токсинов, поступающих с пищей или образующихся в процессе её переработки, и служат своего рода метелкой: продвигаясь по пищеварительному тракту, они прихватывают с собой все, что налипло на стенки, и выводят из организма.
Ещё одно достоинство пищевых волокон - они имеют свойство снижать уровень эндогенного холестерина (это такой холестерин, который не попадает к нам с пищей, а вырабатывается самим организмом в печени из желчных кислот, поступающих в печень из кишечника).
Гемицеллюлоза: как и клетчатка, или целлюлоза, входит в состав клеточных оболочек зерновых продуктов, и небольших количествах содержится в мякоти фруктов и овощей. Она способна удерживать воду и связывать металлы.
Окисление жирных кислот (бета окисление). Роль HS – Ko в этом процессе. Энергия полного окисления стеориновой кислоты до CO 2 c H 2 O . Рассчитать количество образуемых при окислении молекул АТФ.
Активация ЖК происходит в цитоплазме, а бета-окисление - в митохондриях.
Ацил-КоА не может проходить через мембрану митохондрий. Поэтому имеется специальный механизм транспорта ЖК из цитоплазмы в митохондрию при участии вещества "карнитин". Во внутренней мембране митохондрий есть специальный транспортный белок, обеспечивающий перенос. Благодаря этому ацилкарнитин легко проникает через мембрану митохондрий.
По строению цитоплазматическая и митохондриальная карнитинацилтрасферазы различны, отличаются они друг от друга и кинетическими характеристиками. Vmax цитоплазматической ацилкарнитинтрансферазы ниже, чем Vmax митохондриального фермента, а также ниже Vmax ферментов -окисления. Поэтому цитоплазматическая ацилкарнитинтрансфераза является ключевым ферментом распада жирных кислот.
Если жирная кислота попадает в митохондрию, то она обязательно подвергнется катаболизму до ацетил-КоА.
Наиболее компактным «топливом», удовлетворяющим энергетические потребности организма, являются жирные кислоты, что определяется особенностями их химической структуры. В расчете на 1 моль полное окисление жирных кислот высвобождает в несколько раз больше пригодной для использования химической энергии, чем окисление углеводов; например, при окислении 1 моль пальмитиновой кислоты образуется 130 моль АТФ, тогда как при окислении 1 моль глюкозы образуется 38 моль АТФ. В расчете на единицу веса выход энергии различается также более чем в два раза (9 ккал на 1 г жиров против 4 ккал на 1 г углеводов или белков). В основе этого высокого выхода энергии лежит та же причина, которая делает бензин, нефть и другие нефтяные продукты таким эффективным топливом для выработки тепловой и механической энергии, а именно высокая степень восстановленности углерода в длинных алкильных цепях. Основная часть молекулы жирной кислоты состоит из повторяющихся звеньев (СН2)n, т. е. структуры, максимально обогащенной водородом. Как мы видели из предыдущего изложения, энергия, запасаемая в ходе биологических окислительных процессов, образуется в основном в связи с контролируемым переносом электронов от атомов водорода дыхательной цепи, сопряженным с фосфорилирова-нием АДФ до АТФ. Поскольку жирные кислоты построены в основном из углерода и водорода и, таким образом, содержат в своем составе значительно меньше атомов кислорода, чем углеводы, окисление жирных кислот сопровождается поглощением пропорционально большего количества кислорода и, следовательно, образованием большего количества АТФ при окислительном фосфорилировании.
Установлено, что окисление жирных кислот наиболее интенсивно протекает в печени, почках, скелетных и сердечных мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна, т.к. основным источником энергии в мозговой ткани служит глюкоза.
β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА. Метаболический путь - β-окисление - назван так потому, что реакции окисления жирной кислоты происходят у β-углеродного атома. Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования. β-Окисление жирных кислот происходит только в аэробных условиях.
Активация жирных кислот
Перед тем, как вступить в различные реакции, жирные кислоты должны быть активированы, т.е. связаны макроэргической связью с коферментом А:
RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ + PPi.
Реакцию катализирует фермент ацил-КоА син-тетаза. Выделившийся в ходе реакции пирофосфат гидролизуется ферментом пирофосфатазой: Н 4 Р 2 О 7 + Н 2 О → 2 Н 3 РО 4 .
Выделение энергии при гидролизе макроэргической связи пирофосфата смещает равновесие реакции вправо и обеспечивает полноту протекания реакции активации.
Ацил-КоА синтетазы находятся как в цитозоле, так и в матриксе митохондрий. Эти ферменты отличаются по специфичности к жирным кислотам с различной длиной углеводородной цепи. Жирные кислоты с короткой и средней длиной цепи (от 4 до 12 атомов углерода) могут проникать в матрикс митохондрий путём диффузии. Активация этих жирных кислот происходит в матриксе митохондрий. Жирные кислоты с длинной цепью, которые преобладают в организме человека (от 12 до 20 атомов углерода), активируются ацил-КоА синтетазами, расположенными на внешней мембране митохондрий.
Распад активированных жирных кислот происходит в соответствии с гипотезой b - окисления Ф. Кноопа, предложеннойой в 1904 г. b - окисление протекает внутри митохондрий
β-Окисление жирных кислот - специфический путь катаболизма жирных кислот, протекающий в матриксе митохондрий только в аэробных условиях и заканчивающийся образованием ацетил-КоА. Водород из реакций β-окисления поступает в ЦПЭ, а ацетил-КоА окисляется в цитратном цикле, также поставляющем водород для ЦПЭ. Поэтому β-окисление жирных кислот - важнейший метаболический путь, обеспечивающий синтез АТФ в дыхательной цепи.
β-Окисление начинается с дегидрирования ацил-КоА FAD-зависимой ацил-КоА дегидрогеназой с образованием двойной связи между α- и β-атомами углерода в продукте реакции - еноил-КоА. Восстановленный в этой реакции кофермент FADH 2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ (рис. 8-27). В следующей реакции р-окисления по месту двойной связи присоединяется молекула воды таким образом, что ОН-группа находится у β-углеродного атома ацила, образуя β-гидроксиацил-КоА. Затем β-гидроксиацил-КоА окисляется NАD + -зависимой дегидрогеназой. Восстановленный NADH, окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ. Образовавшийся β-кетоацил-КоА подвергается тиолитическому расщеплению ферментом тиолазой, так как по месту разрыва связи С-С через атом серы присоединяется молекула кофермента А. В результате этой последовательности из 4 реакций от ацил-КоА отделяется двухуглеродный остаток - ацетил-КоА. Жирная кислота, укороченная на 2 атома углерода, опять проходит реакции дегидрирования, гидратации, дегидрирования, отщепления ацетил-КоА. Эту последовательность реакций обычно называют "циклом β-окисления", имея в виду, что одни и те же реакции повторяются с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацетильные остатки.
β-Окисление жирных кислот.
Процесс b-окисления является циклическим. За каждый оборот цикла от жирной кислоты отщепляется 2 углеродных атома в виде ацетильного остатка.
После этого укороченный на 2 углеродных атома ацил-КоА снова подвергается окислению (вступает в новый цикл реакций b-окисления). Образующийся Ацетил-КоА может дальше вступить в цикл трикарбоновых кислот.Нужно уметь рассчитывать энергетический выход при распаде жирных кислот. Представленная формула верна для любой насыщенной жирной кислоты, содержащей n углеродных атомов.При распаде ненасыщенных жирных кислот образуется меньше АТФ. Каждая двойная связь в жирной кислоте - это потеря 2-х молекул АТФ. b-окисление наиболее интенсивно протекает в мышечной ткани, почках, печени. В результате b-окисления ЖК образуется Ацетил-КоА. Скорость окисления определяется скоростью процессов липолиза. Ускорение липолиза характерно для состояния углеводного голодания и интенсивной мышечной работы. Ускорение b-окисления наблюдается во многих тканях, в том числе и в печени. В печени образуется больше Ацетил-КоА, чем ей требуется. Печень - "орган-альтруист" и поэтому печень отправляет глюкозу в другие ткани.
Печень стремится направить в другие ткани и свой собственный Ацетил-КоА, но не может, так как для Ацетил-КоА клеточные мембраны непроницаемы. Поэтому в печени из Ацетил-КоА синтезируются специальные вещества, которые называются "кетоновые тела". Кетоновые тела - это особая транспортная форма ацетил-КоА.
Молекула жирной кислоты расщепляется в митохондрии путем постепенного отщепления двууглеродных фрагментов в виде ацетилкоэнзима А (ацетил-КоА).
С17Н35СООН + 26 О2 = 18 СО2 + 18 Н2О.
при окислении стеариновой кислоты клетка получит 146 молекул АТФ.
Окисление жирных кислот протекает в печени, почках, скелетных и сердечных мышцах, в жировой ткани.
Ф.Кнооп высказал предположение, что окисление молекулы жирной кислоты в тканях организма происходит в b-окислении. В результате от молекулы жирной кислоты отщепляются двууглеродные фрагменты со стороны карбоксильной группы. Процесс b-окисления жирных кислот складывается из следующих этапов:
Активация жирных кислот. Подобно первой стадии гликолиза сахаров перед b-окислением жирные кислоты подвергаются активации. Эта реакция протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима А (НS-КоА) и ионов Mg 2+ . Реакция катализируется ацил-КоА-синтетазой:
В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты.
Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление, переносчиком активированных жирных кислот через внутреннюю митохондриальную мембрану служит карнитин (g-триметиламино-b-оксибути-рат):
После прохождения ацилкарнитина через мембрану митохондрий происходит обратная реакция – расщепления ацилкарнитина при участии НS-КоА и митохондриальной карнитин-ацилтрансферазы:
Ацил-КоА в митохондрии подвергается процессу b-окисления.
Этот путь окисления связан с присоединением атома кислорода к углеродному атому жирной кислоты, находящемуся в b-положении:
При b-окислении происходит последовательное отщепление от карбоксильного конца углеродной цепи жирной кислоты двууглеродных фрагментов в форме ацетила-КоА и соответствующее укорачивание цепи жирной кислоты:
В матриксе митохондрии ацил-КоА распадается в результате повторяющейся последовательности четырех реакций (рис.8).
1) окисление с участием ацил-КоА-дегидрогеназы (ФАД-зависимой дегидрогеназы);
2) гидратация, катализируемой еноил-КоА-гидратазой;
3) второго окисления под действием 3-гидроксиацетил-КоА-дегидрогеназы (НАД-зависимой дегидрогеназы);
4) тиолиза с участием ацетил-КоА-ацилтрансферазы.
Совокупность этих четырех последовательностей реакций составляет один оборот b-окисления жирной кислоты (см. рис. 8).
Образовавшийся ацетил-КоА подвергается окислению в цикле Кребса, а ацетил-КоА, укоротившийся на два углеродных атома, снова многократно проходит весь путь b-окисления вплоть до образования бутирил-КоА (4-углеродное соединение), на последнем этапе b-окисления распадается на две молекулы ацетил-КоА.
При окислении жирной кислоты, содержащей n углеродных атомов, происходит n/2-1 цикл b-окисления (т.е. на один цикл меньше, чем n/2, так как при окислении бутирил-КоА сразу происходит образование двух молекул ацетил-КоА) и всего получится n/2 молекул ацетил-КоА.
Например при окислении пальмитиновой кислоты (С 16) повторяется 16/2-1=7 циклов b-окисления и образуется 16/2=8 молекул ацетил-КоА.
Рисунок 8 – Схема b-окисления жирной кислоты
Баланс энергии. При каждом цикле b-окисления образуется одна молекула ФАДН 2 (см. рис. 8; реакция 1) и одна молекула НАДН+Н + (реакция 3). Последняя в процессе окисления дыхательной цепи и сопряженного с ним фосфорилирования дают: ФАДН 2 – 2 молекулы АТФ и НАДН+Н + – 3 молекулы АТФ, т.е. в сумме за один цикл образуется 5 молекул АТФ. При окислении пальмитиновой кислоты образуется 5*7=35 молекул АТФ. В процессе b-окисления пальмитиновой кислоты образуется 8 молекул ацетил-КоА, каждая из которых, «сгорая» в цикле Кребса, дает 12 молекул АТФ, а 8 молекул дадут 12*8=96 молекул АТФ.
Таким образом, всего при полном b-окислении пальмитиновой кислоты образуется 35+96=131 молекула АТФ. С учетом одной молекулы АТФ, потраченной в самом начале на стадии активации жирной кислоты, общий энергетический выход при полном окислении одной молекулы пальмитиновой кислоты составит 131-1=130 молекул АТФ.
Однако, образовавшийся в результате b-окисления жирных кислот ацетил-КоА, может не только окисляться до СО 2 , Н 2 О, АТФ, вступая в цикл Кребса, но использоваться на синтез холестерина, а также углеводов в глиоксилатном цикле.
Глиоксилатный путь специфичен только для растений и бактерий, у животных организмов он отсутствует. Данный процесс синтеза углеводов из жиров подробно описан в методическом указании «Взаимосвязь процессов обмена углеводов, жиров и белков» (см. п. 2.1.1, с. 26).
Триглицериды в форме хиломикрон из эпителиальных клеток тонкого кишечника поступают в печень, легкие, сердце, мышцы и другие органы, где они гидролизуются на глицерин и жирные кислоты. Последние могут быть окислены в высокоэкзергоническом метаболическом пути, известным как }