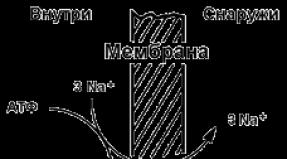
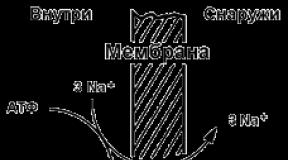
Карбоновые кислоты в природе презентация. Презентация на тему "карбоновые кислоты". Реакция этерификации
Тема: «Художественная культура мусульманского Востока логика абстрактной красоты».
Дата: «___»_______________ 20 «___». Класс: 10.
Урок 8.
Цель : изучить особенности искусства исламского Востока; сформировать представление о национальных чертах храмового зодчества.
Тип урока : Комбинированный.
Оборудование : компьютер, презентация, учебник МХК.
Ход урока.
I . Организационный момент.
II . Актуализация знаний учащихся.
Проверка докладов.
План:
1. Иллюстрации арабески.
2. Искусство мусульманского Востока.
3. Арабская архитектура.
4.Альгамбра с высоты птичьего полета
III . Подготовка к изучению нового материала.
Мусульманский Восток – огромный регион, объединивший разные народы на основе самой молодой из мировых религий – ислама.
Средневековая культура мусульманских стран занимает одно из важнейших мест в истории мировой цивилизации. Сохранились многочисленные памятники Средневековья, свидетельствующие о единой самобытной художественной традиции, которая родилась под влиянием учения об Аллахе. Связь религии с искусством в мусульманской культуре нерасторжима.
IV . Изучение нового материала.
Изобразительное искусство Арабского Востока представлено различными видами орнамента, каллиграфией и замечательной книжной миниатюрой. Самой ранней формой орнаментального искусства является арабеска (от французского «арабский»). Арабеска - европейское название сложного восточного средневекового орнамента, линейно-геометрического узора, состоящего, в основном, из геометрических, каллиграфических и растительных элементов и созданного на основе точного математического расчета.
1. Иллюстрации арабески
Узор включал в себя растительные мотивы, в него вплетались надписи, изображения животных, птиц, людей и фантастических существ. Арабеска служила прекрасным фоном, заполняющим всю пустоту пространства. В них соблюдается мерный ритм, повторяемость рисунка в пределах всей композиции.
Восточные мыслители сравнивали арабеску с музыкой, призванной «создавать новую и более совершенную красоту». Как и в музыке, орнамент обладает большой эмоциональной выразительностью, порождает сложную гамму чувств, настроений и мыслей. Арабеске присущи цвета: яркий кобальт, изумрудно-зеленый, красный и желтый. Восточный орнамент называют «музыкой для глаз».
Коран учит, что Аллаха невозможно видеть или осязать. Поэтому Коран никогда не иллюстрировался. Отсюда же вытекает запрет на изображение видимого мира и живых существ в религиозном искусстве. Главным украшением священных текстом было само письмо – знаменитая арабская каллиграфия. В культуре мусульманского Востока особенно высоко ценилось это искусство. В VII веке возник прямолинейный, угловатый почерк куфи. Куфическое письмо украшает стены монументальных архитектурных сооружений.

История открытия карбоновых кислот: С древнейших времен люди знали, что при скисании вина образуется уксус, который использовали для придания пище кислого вкуса(эта была не единственная кислая приправа). С той же целью использовались листья щавеля, стебли ревеня, сок лимона или ягоды кислицы. Уксусную кислоту научились получать еще в VIII веке, но лишь в 1814 году Якоб Берцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля.




Физические свойства: С 1 - С 3 жидкости с характерным резким запахом С 4 - С 9 вязкие маслянистые жидкости с неприятным запахом С С 10 твердые нерастворимые вещества Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей и существуют в основном в виде димеров. С ростом относительной молекулярной массы температура кипения предельных одноосновных кислот увеличивается.

Окисление первичных спиртов и альдегидов (кислородом на катализаторе; KMnO 4 ; K 2 Cr 2 O 7): R-CH 2 OH RCOH RCOOH Каталитическое окисление метана: 2CH 4 + 3O 2 2H–COOH + 2H 2 O Каталитическое окисление бутана: 2CH 3 –CH 2 –CH 2 –CH 3 +5O 2 4CH 3 COOH + 2H 2 O Ароматические кислоты синтезируют окислением гомологов бензола: 5C 6 H 5 CH 3 +6KMnO 4 +9H 2 SO 4 5C 6 H 5 COOH+3K 2 SO 4 +6MnSO 4 +14H 2 O Получение:





Муравьиная кислота названа так потому, что в момент опасности выделяется муравьями для предупреждения других обитателей муравейника, и защиты от хищников. Муравьиная кислота содержится в хвое, соке крапивы. У теплокровных животных в процессе обмена веществ вырабатывается небольшое количество молочной кислоты, и ее запах позволяет комарам и другим кровососущим насекомым находить свои жертвы. Некоторые дикорастущие травы выделяют масляную кислоту, которая приводит к подавлению роста или гибели близ растущих растений. Интересные факты:

Класс: 10
Презентация к уроку
Назад
Вперёд
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цели:
- Воспитания:
- воспитывать аккуратность в ведении записей в тетрадях;
- приучать к поддержанию чистоты и аккуратности рабочего места;
- воспитывать умение общения в коллективе;
- осознание учениками того, какую значительную роль играют карбоновые кислоты в жизни человека;
- формирование мировоззренческих знаний: показать причинно-следственные связи при рассмотрении строения, свойств, применения данных веществ; переход количественных изменений в качественные при рассмотрении гомологического ряда кислот и изменении их физических свойств с увеличением масс.
- Развития:
- уметь формулировать определение предельным карбоновым кислотам;
- уметь составлять названия представителям класса;
- уметь находить изомеров и гомологов из перечня предложенных веществ;
- уметь составлять уравнения химических реакций, отражающих химические свойства карбоновых кислот.
- Образования:
- сформировать представление о карбоновых кислотах как о классе органических соединений;
- изучить номенклатуру и изомерию предельных карбоновых кислот, а также их классификацию;
- изучить гомологический ряд предельных карбоновых кислот;
- изучить строение карбоновых кислот;
- рассмотреть свойства карбоновых кислот и их применение.
Оборудование и реактивы: уксусная кислота, муравьиная кислота, универсальная лакмусовая бумажка, метиловый оранжевый, водный экстракт калины, медная проволока, гидроксид железа (III), гидрокарбонат натрия, нитрат серебра, нашатырный спирт (для приготовления аммиачного раствора оксида серебра), раствор перманганата калия; держатель пробирок, спички, спиртовка, пробирки; демонстрационные плакаты, демонстрационные препараты (яйца Kinder Сюрприз), мультимедийные средства, видеоопыт (растворимость карбоновых кислот в воде, взаимодействие уксусной кислоты с металлами), натуральные объекты (лимонад, кетчуп), лист фронтальной работы (ЛФР) (Приложение 1 ).
Методы: словесно-наглядный, лабораторный эксперимент, групповая работа.
Методика: традиционный урок, изучение нового.
ХОД УРОКА
– Добрый день!
«Всякое вещество – от самого простого до самого сложного – имеет три различные, но взаимосвязанные стороны – свойство, состав, строение».
В.М. Кедров
Одной из ведущих идей науки химии является
зависимость свойств веществ от их состава и
строения, изучить и подтвердить которую нам
сегодня предстоит.
Сегодняшний урок посвящён особому классу
органических соединений. Какому? Окунёмся в
прошлое.
С древнейших времён люди выращивали виноград и
запасали впрок виноградный сок. При хранении сок
бродил, получалось вино. Если вино скисало,
образовывался уксус. Отсюда и понятно
происхождение слова «уксус» – от греческого
«оксос» – кислый. (Демонстрация рисунка
«столовый уксус»).
Люди стали пользоваться уксусом почти 3000 лет
назад. В древности уксус был единственной
пищевой кислотой. Позднее появилась важная
«добавочка» к различным кулинарным изделиям –
лимонная кислота… Впервые она выделена из сока
незрелых лимонов.
Для придания пище кислого вкуса использовались
листья щавеля, стебли ревеня, сок лимона, ягоды
кислицы (демонстрация рисунков)
. Разумеется,
тогда никто и не думал о том, что кислый вкус во
всех случаях обусловлен присутствием соединений
одного класса. Какого? (Кислот).
Органических
кислот, которые называют карбоновыми.
В состав клюквы, брусники, черники и мёда входит
бензойная кислота. Она широко используется в
пищевой промышленности в качестве консерванта
(Е210) при изготовлении напитков и кетчупов (демонстрация
лимонада и кетчупа)
.
У многих насекомых, образующих семьи или просто
«сообщества» (термиты, муравьи, осы, пчёлы),
вырабатываются в организме особые химические
вещества, с помощью которых они оповещают своих
соплеменников об опасности. Например, рыжие
муравьи обладают феромоном тревоги – муравьиной
кислотой, которая одновременно служит их
оружием.
Муравьиная кислота встречается также в
некоторых растениях, в частности в жгучей
крапиве.
– Ребята, сформулируйте тему урока. (Карбоновые кислоты). Запишите число и тему урока.
Исследуя настои, полученные из корней и листьев разных растений, к концу 18 века Карл Шееле выделил винную, лимонную, яблочную, галловую, щавелевую кислоты.
– Сегодняшний урок посвящён одному из классу органических соединений – карбоновым кислотам. Неорганические кислоты вы изучили.
– Какую цель мы поставим на сегодняшнем уроке? (Определить, обладают карбоновые кислоты свойствами неорганических, изучив их состав и строение).
Показываю формулы некоторых карбоновых кислот (Приложение 2 ).
– Что общего вы видите в их строении? (Одну или
несколько групп ).
– Мысленно «расчлените» неизвестную
функциональную группу на две.
– Какие из изученных групп можно обнаружить в её
составе? (Гидроксильную
и карбо
нильную).
Отсюда и название – карбоксильная
группа.
– А теперь попробуйте сформулировать
определение карбоновым кислотам.
Карбоновые кислоты
– органические
вещества, молекулы которых содержат одну или
несколько карбоксильных групп, соединённых с
углеводородным радикалом.
Вполне очевидно, что познакомиться со всеми
кислотами невозможно. Поэтому обратимся к их
классификации.
– Глядя на формулы кислот, классифицируйте их
на группы по разным критериям.
– По каким критериям вы можете их разделить? (По
природе углеводородного радикала, по
основности).
(Работа ученика у доски).
Карбоновые кислоты (по природе углеводородного радикала) |
||
| Предельные (насыщенные) | Непредельные (ненасыщенные) | Ароматические |
Вспомните классификацию неорганических
кислот.
Что понимается под основностью неорганических
кислот? (Число атомов водорода, способных
замещаться на металл).
Тоже справедливо и для органических кислот.
Карбоновые кислоты (по основности) |
||
| Одноосновные | Двухосновные | Многоосновные |
 |
 |
 |
Итак, карбоновые кислоты бывают предельными,
непредельными и ароматическими, а также
одноосновными, двухосновными и многоосновными.
На сегодняшнем уроке мы изучим одноосновные
предельные карбоновые кислоты
.
Многообразие карбоновых кислот, как и всех
органических соединений, обеспечивают два
важных явления.
Какие это явления? (Изомерия и гомология).
Сформулируйте определение гомологам. (Гомологи
– это вещества, которые имеют одинаковый
качественный состав, но разный количественный
состав (отличаются на одну или несколько групп
–СН 2), имеют сходное строение, а
следовательно – сходные свойства.
У вас на столах находятся листочки, которые вы
вклеите в свои тетради (Приложение
3
). В первой колонке записаны первые
члены гомологического ряда карбоновых кислот и
некоторые наиболее распространённые другие. Во
вторую вы впишите их систематическое название (Самостоятельно
с последующей проверкой)
. Третья, четвёртая
и пятая колонки уже заполнены.
А теперь назовём карбоновые кислоты по
систематической номенклатуре. Вспомним правила
номенклатуры органических соединений на
примере:

В систематической номенклатуре карбоновых
кислот используют окончание -овая кислота
.
Если карбоксильных групп несколько, то
используют приставки ди-
, три-
, тетра-
и т.д. Наиболее часто для карбоновых кислот
применяются исторически возникшие названия,
связанные в большинстве случаев с названием их
природных источников. Поэтому, чтобы в
дальнейшем хорошо ориентироваться в
номенклатуре органических соединений, следует
запомнить названия простейших одноосновных
кислот.
Первый представитель – муравьиная кислота. В его
составе только один атом углерода. Какой
углеводород ему соответствует? (Метан).
Значит, как будет называться карбоновая кислота?
(Метановая кислота).
Запишем название.
| Формула кислоты | Название |
Название кислотного остатка | Формула кислотного остатка | |
Систематическое |
Тривиальное | |||
| HCOOH | Метановая кислота | Муравьиная | формиат | HCOO – |
| CH 3 COOH | Этановая кислота | Уксусная | ацетат | CH 3 COO – |
| C 2 H 5 COOH | Пропановая кислота | Пропионовая | пропионат | C 2 H 5 COO – |
| C 3 H 7 COOH | Бутановая кислота | Масляная | бутират | C 3 H 7 COO – |
| C 4 H 9 COOH | Пентановая кислота | Валериановая | валерат | C 4 H 9 COO – |
| C 5 H 11 COOH | Гексановая кислота | Капроновая | капрат | C 5 H 11 COO – |
| CH 2 =CH–COOH | Пропеновая кислота | Акриловая | акрилат | CH 2 =CH–COO – |
| C 15 H 31 COOH | Гексадекановая кислота | Пальмитиновая | пальмитат | C 15 H 31 COO – |
| C 17 H 35 COOH | Октадекановая кислота | Стеариновая | стеарат | C 17 H 35 COO – |
Мы назвали только одно явление, которое
обеспечивает многообразие альдегидов. А теперь,
посмотрите. (Показываю детям 3 шоколадных яйца
Kinder Сюрприз).
Внешне они абсолютно одинаковы. У
нас тоже есть три абсолютно одинаковые
молекулярные формулы веществ. (На доске
заранее вывешены 3 плаката закрытой стороной).
Открываю их
(Приложение 4
).
Но известно, что это 3 разных вещества. В чём
причина? С каким явлением это связано? (С явлением
изомерии).
Вот так, как внешне шоколадные яйца одинаковы,
внутри содержат совершенно разные игрушки, так и
эти вещества имеют одинаковые молекулярные
формулы, но разное строение.
Сформулируйте определение изомерам. (Изомеры –
вещества, которые имеют одинаковый качественный
и количественный состав, но разное строение).
Составьте к веществу с молекулярной формулой C 4 H 8 O 2
изомеры. (Работа у доски)
.
Можно составить и другие изомеры. Остановимся
на этом.
Сделайте вывод, какие виды изомерии характерны
для карбоновых кислот. (Изомерия углеродного
скелета (1 и 2) и межклассовая изомерия (например, 1
и 4)).
С каким классом органических соединений
изомерны карбоновые кислоты? (Со сложными
эфирами).
А теперь назовём 1 и 2 соединения по
систематической номенклатуре. (Работа у доски).
Зная систематическое название, можно составить
структурную формулу. Составьте формулу
2-гидроксипропановой кислоты. (Работа у
доски).
Эта
кислота имеет тривиальное название – молочная
– принимает активное участие в жизненных
процессах.
Ещё в прошлом веке И.И. Мечников
заметил, что питание молочнокислой продукцией
окисляет кишечник от гнилостной микрофлоры и
способствует долголетию .
Напомню, свойства вещества зависят от их
строения. Обратимся к строению.
 В
молекуле карбоновой кислоты р
-электроны
атома О
–гидроксильной группы
взаимодействуют с электронами π
-связи
карбонильной группы, в результате чего возникает
полярность связи О-Н, упрочняется π
-связь в
карбонильной группе, уменьшается δ+
заряд на атоме С
и увеличивается частичный δ+
на атоме Н
. Это способствует образованию
прочных водородных связей между молекулами
карбоновых кислот.
В
молекуле карбоновой кислоты р
-электроны
атома О
–гидроксильной группы
взаимодействуют с электронами π
-связи
карбонильной группы, в результате чего возникает
полярность связи О-Н, упрочняется π
-связь в
карбонильной группе, уменьшается δ+
заряд на атоме С
и увеличивается частичный δ+
на атоме Н
. Это способствует образованию
прочных водородных связей между молекулами
карбоновых кислот.
В гомологическом ряду карбоновых кислот их сила
падает с увеличением углеводородного радикала,
поэтому наиболее сильной из них является
муравьиная кислота. Это объясняется увеличением
положительного индукционного эффекта
алкильного заместителя в ряду –H > –CH 3
> –C 2 H 5 . Дальнейшее удлинение
углеродной цепи не оказывает заметного влияния
на величину +I
-эффекта и, следовательно, силу
кислоты:
Физические свойства карбоновых кислот опишем,
выполнив № 4 ЛФР. Выясним, как изменяются
физические свойства карбоновых кислот в
гомологическом ряду. Посмотрим видеоопыт –
растворимость карбоновых кислот в воде.
Вспомним свойства неорганических кислот. (Ответы
учащихся).
Кислотные свойства карбоновых кислот аналогичны
свойствам слабых неорганических кислот.
Неорганические кислоты диссоциируют
(растворимые в воде), изменяют окраску индикатора
(растворимые в воде), взаимодействуют с
металлами, стоящими в электрохимическом ряду
напряжения металлов до Н 2 , с амфотерными и
основными оксидами, с основаниями, с солями более
слабых кислот.
Обладают ли карбоновые кислоты этими свойствами?
Проверим.
Повторим правила техники безопасности при
работе с кислотами.
При попадании на кожу растворов кислот или
щелочей стряхивают видимые капли и затем смывают
широкой струёй прохладной воды; запрещается
обрабатывать поражённый участок увлажнённым
тампоном. Почему?
Выберите правильный ответ.
При ожоге кислотой кожу необходимо обработать
раствором:
Нейтрализацию катионов водорода проводить едкой щёлочью нельзя, так как можно получить химические и термические ожоги. Для этой цели используют раствор соды, имеющий щелочную среду. Ответ: 2.
Проведём опыты. (Работа по группам с написанием соответствующих уравнений реакций на доске).
Посмотрим на ребус. . С какой кислотой мы будем работать?

Одна из групп будет исследовать особые свойства муравьиной кислоты , выполнив № 7 ЛФР.
Ход практической работы и предполагаемые ответы учащихся – Приложение 5 .
Взаимодействие уксусной кислоты с металлами – видеоопыт.
А будут ли спирты взаимодействовать с карбоновыми кислотами? (Да).
Такие реакции называют реакциями этерификации .
Реакция этерификации – реакция образования
сложных эфиров при взаимодействии кислот и
спиртов в присутствии водоотнимающего средства.
В соответствии с механизмом протекания реакции
этерификации при образовании сложного эфира от
молекулы кислоты отщепляется гидроксильная
группа, от молекулы спирта – атом водорода
гидроксила:
Применение карбоновых кислот (слайды) .
– Подведем итоги:
– Что нового мы узнали на уроке? Чему научились?
Что знаем?
(Краткие ответы учеников).
– Сформулируйте вывод о свойствах карбоновых
кислот. (Карбоновые кислоты обладают свойствами
неорганических кислот, проявляют специфические
свойства).
Растворимые кислоты диссоциируют изменяют
окраску индикатора, карбоновые кислоты
взаимодействуют с активными металлами с
выделением водорода, реагируют с основными и
амфотерными оксидами, основаниями, солями более
слабых кислот.
– Мы сегодня прошли путь от состава и строения веществ к предсказанию их свойств.
- Сформулируйте определение понятию «карбоновые кислоты»?
- В чем заключаются особенности классификации кислот?
- Какие виды изомерии для них характерны?
- В чем особенности номенклатуры карбоновых кислот?
- С какими вещества взаимодействуют карбоновые кислоты?
- Где находят применение карбоновые кислоты?
- В пищевой промышленности уксусная кислота используется в качестве консерванта и регулятора кислотности под кодом Е-260. Напишите структурную формулу предыдущего гомолога этой кислоты, имеющего код Е-236. Назовите вещество по систематической и тривиальной номенклатуре.
- Составьте уравнение реакции взаимодействия уксусной кислоты с бромом на свету; гидрирование акриловой кислоты; пропионовой кислоты с метиловым спиртом.
Домашнее задание: §30, ЛФР № 13, 14, 15.
Список литературы
- Габриелян О.С. Химия / О.С. Габриелян, И.Г. Остроумова, С.А. Сладков. – М.: / Дрофа, 2011.
- Карцова А.А. Химия без формул. – 3-е изд., перераб. – СПб.: Авалон, Азбука-классика, 2005.
- Мартыненко Б.В. Химия: кислоты и основания: Пособие для учащихся 8-11 кл. общеобразоват. учреждений. – М.: просвещение, 2000.
- Химия в школе, 2008, № 5-80.
- Химия в школе, 2010, № 3-80.
1 слайд

2 слайд
Строение Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоксильная группа – группа атомов Состав этих кислот будет отражаться общей формулой CnH2nO2, или CnH2n+1COOH, или RCOOH.

3 слайд
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными. Общая формула этих кислот RCOOH. Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относится, например, щавелевая кислота: Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. щавелевая кислота

4 слайд
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические. Предельные (или насыщенные) карбоновые кислоты не содержат π-связей в углеводородном радикале. Например, пропановая кислота: CH3 – CH2 – C В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом. Например, акриловая кислота: CH2 = CH – COOH Ароматические кислоты содержат в молекуле ароматическое (бензольное) кольцо. Например, бензойная кислота: O OH - C O OH

5 слайд
Номенклатура и изомерия Название карбоновой кислоты образуется от названия соответствующего алкана с добавлением суффикса –ов, окончания –ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например: H – C Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-: C – C Многие кислоты имеют исторически сложившиеся, или тривиальные, названия. H OH метановая (муравьиная) кислота O O OH HO этандионовая (щавелевая) кислота

6 слайд
Физические свойства предельных одноосновных карбоновых кислот Низшие кислоты, содержащие в молекуле до 4 атомов углерода – жидкости с характерным резким запахом. Кислоты, содержащие от 4 до 9 атомов углерода – вязкие маслянистые жидкости с неприятным запахом; содержащие более 9 атомов углерода в молекуле – твердые вещества, которые не растворяются в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и с ростом относительной молекулярной массы.

7 слайд
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов – карбоксил и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи. С увеличением числа атомов в углеводородном радикале растворимость в воде карбоновых кислот снижается.

8 слайд
Химические свойства Диссоциация с образованием катионов водорода и анионов кислотного остатка: CH3 – COOH CH3 – COO- + H+ Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода. Так, железо восстанавливает водород из уксусной кислоты: 2CH3 – COOH + Fe (CH3COO)2Fe + H2 Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации): 2R – COOH + Ca(OH)2 (R - COO)2Ca + 2H2O Взаимодействие с солями слабых кислот с образованием последних: CH3COOH + C17H35COONa CH3COONa + C17H35COOH

9 слайд
Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров – реакция этерификации: CH3 – C – OH + C2H5 – OH CH3 – C – OC2H5 + H2O Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода. Реакция этерификации обратима. Реакции присоединения по кратной связи – в них вступают непредельные карбоновые кислоты. Для кислоты, содержащей в радикале одну π-связь, можно записать уравнение в общем виде: CnH2n-1COOH + H2 CnH2n+1COOH O O катализатор

10 слайд
Взаимодействие с основными оксидами: 2RCOOH + СаО = (RCOO)2Ca + Н2О Окисление муравьиной кислоты (эта реакция свойственна только данной кислоте): 2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + +5CO2 + 8H2O Реакции замещения (с галогенами) – в нее способны вступать предельные карбоновые кислоты. Например, взаимодействие уксусной кислоты с хлором: CH3 – COOH + Cl2 CH2Cl – COOH + HCl P (красный) хлоруксусная кислота

11 слайд
Способы получения Карбоновые кислоты могут быть получены окислением первичных спиртов и альдегидов: R – CH2 – OH R – C Ароматические карбоновые кислоты образуются при окислении гомологов бензола: - CH3 - COOH Гидролиз различных производных карбоновых кисло также приводит к получению кислот: CH3 – C – O – C2H5 + H2O CH3 – COOH + C2H5OH [O] O OH Бензойная кислота [O] H+ O
Cлайд 1
БИООРГАНИЧЕСКАЯ ХИМИЯ Лекция 4 Карбоновые кислоты План 1. Классификация. 2. Химические свойства. 3. Салициловая кислота, фарм. препараты на её основе. Лектор: доктор биологических наук, профессор, зав. кафедрой химии Ирина Петровна Степанова ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ХИМИИ http://prezentacija.biz/Cлайд 2
 Карбоновые кислоты Карбоновые кислоты – это органические вещества, содержащие в своем составе карбоксильную группу (- COOH).
Карбоновые кислоты Карбоновые кислоты – это органические вещества, содержащие в своем составе карбоксильную группу (- COOH).
Cлайд 3
 Классификация карбоновых кислот I. По числу карбоксильных групп различают: монокарбоновые – содержат одну карбоксильную группу. Пример: гомологический ряд предельных одноосновных кислот CnH2n + 1COOH, n = 0, 1, 2, 3, 4 … HCOOH муравьиная (метановая) кислота (соли – формиаты)
Классификация карбоновых кислот I. По числу карбоксильных групп различают: монокарбоновые – содержат одну карбоксильную группу. Пример: гомологический ряд предельных одноосновных кислот CnH2n + 1COOH, n = 0, 1, 2, 3, 4 … HCOOH муравьиная (метановая) кислота (соли – формиаты)
Cлайд 4
 Классификация карбоновых кислот H3C – COOH уксусная (этановая) кислота (соли – ацетаты) H3C – CH2 – COOH пропионовая (пропановая) кислота (соли – пропионаты)
Классификация карбоновых кислот H3C – COOH уксусная (этановая) кислота (соли – ацетаты) H3C – CH2 – COOH пропионовая (пропановая) кислота (соли – пропионаты)
Cлайд 5
 Классификация карбоновых кислот H3C – CH2 – CH2 – COOH масляная (бутановая) кислота (соли – бутираты) H3C – CH2 – CH2 – CH2 – COOH валериановая (пентановая кислота) кислота (соли – валераты)
Классификация карбоновых кислот H3C – CH2 – CH2 – COOH масляная (бутановая) кислота (соли – бутираты) H3C – CH2 – CH2 – CH2 – COOH валериановая (пентановая кислота) кислота (соли – валераты)
Cлайд 6
 Классификация карбоновых кислот H3C – CH2 – CH2 – CH2 – CH2 – COOH капроновая (гексановая) кислота (соли – гексаноаты)
Классификация карбоновых кислот H3C – CH2 – CH2 – CH2 – CH2 – COOH капроновая (гексановая) кислота (соли – гексаноаты)
Cлайд 7
 Классификация карбоновых кислот b) поликарбоновые – содержат в своем составе две и более карбоксильные группы. Пример: гомологический ряд предельных дикарбоновых кислот HOOC – CnH2n – COOH, n = 0, 1, 2, 3, 4 … HOOC – COOH щавелевая (этандиовая) кислота (соли – оксалаты), HOOC – CH2 – COOH малоновая (пропандиовая) кислота (соли – малонаты), HOOC – CH2 – CH2 – COOH янтарная (бутандиовая) кислота (соли – сукцинаты), HOOC – CH2 – CH2 – CH2 – COOH глутаровая (пентандиовая) кислота (соли – глутараты).
Классификация карбоновых кислот b) поликарбоновые – содержат в своем составе две и более карбоксильные группы. Пример: гомологический ряд предельных дикарбоновых кислот HOOC – CnH2n – COOH, n = 0, 1, 2, 3, 4 … HOOC – COOH щавелевая (этандиовая) кислота (соли – оксалаты), HOOC – CH2 – COOH малоновая (пропандиовая) кислота (соли – малонаты), HOOC – CH2 – CH2 – COOH янтарная (бутандиовая) кислота (соли – сукцинаты), HOOC – CH2 – CH2 – CH2 – COOH глутаровая (пентандиовая) кислота (соли – глутараты).
Cлайд 8
 малеиновая кислота (цис-бутендиовая кислота) Токсична, в природе не встречается. фумаровая кислота (транс-бутендиовая кислота) Продукт обмена углеводов в анаэробных условиях. Пример: непредельная дикарбоновая кислота бутендиовая кислота НООС-СН=СН-СООН Классификация карбоновых кислот
малеиновая кислота (цис-бутендиовая кислота) Токсична, в природе не встречается. фумаровая кислота (транс-бутендиовая кислота) Продукт обмена углеводов в анаэробных условиях. Пример: непредельная дикарбоновая кислота бутендиовая кислота НООС-СН=СН-СООН Классификация карбоновых кислот
Cлайд 9
 Классификация карбоновых кислот II. В зависимости от наличия младших функциональных групп различают: a) гидроксикислоты COOH HO – C – H CH3 L (+) - молочная (2 – гидроксипропановая) кислота (соли – лактаты) Пример: L – молочная кислота D – молочная кислота
Классификация карбоновых кислот II. В зависимости от наличия младших функциональных групп различают: a) гидроксикислоты COOH HO – C – H CH3 L (+) - молочная (2 – гидроксипропановая) кислота (соли – лактаты) Пример: L – молочная кислота D – молочная кислота
Cлайд 10
 Классификация карбоновых кислот COOH HO – C – H CH2 COOH L (-) –яблочная кислота (2- гидроксибутандиовая) кислота (соли – малаты)
Классификация карбоновых кислот COOH HO – C – H CH2 COOH L (-) –яблочная кислота (2- гидроксибутандиовая) кислота (соли – малаты)
Cлайд 11
 Классификация карбоновых кислот COOH CH2 H – C – OH CH3 D(+) – β-гидроксимасляная (2-гидроксибутановая) кислота, соли – β-гидроксибутираты COOH HO – C – CH2 – COOH СH2 – COOH лимонная (2-гидроксипропан- 1,2,3-трикарбоновая) кислота, соли – цитраты
Классификация карбоновых кислот COOH CH2 H – C – OH CH3 D(+) – β-гидроксимасляная (2-гидроксибутановая) кислота, соли – β-гидроксибутираты COOH HO – C – CH2 – COOH СH2 – COOH лимонная (2-гидроксипропан- 1,2,3-трикарбоновая) кислота, соли – цитраты
Cлайд 12
 Классификация карбоновых кислот Гидроксикислоты являются, как правило, твёрдыми телами. Рацемическая молочная кислота может быть жидкой (т. пл. 18оС). Запахом гидроксикислоты почти не обладают. Гидроксикислоты имеют очень большое значение в биологической химии; их можно встретить во многих очень важных метаболических путях – цикле Кребса, гликолизе, пентозофосфатном цикле, b-окислении жирных кислот, биосинтезе жирных кислот и т.д.
Классификация карбоновых кислот Гидроксикислоты являются, как правило, твёрдыми телами. Рацемическая молочная кислота может быть жидкой (т. пл. 18оС). Запахом гидроксикислоты почти не обладают. Гидроксикислоты имеют очень большое значение в биологической химии; их можно встретить во многих очень важных метаболических путях – цикле Кребса, гликолизе, пентозофосфатном цикле, b-окислении жирных кислот, биосинтезе жирных кислот и т.д.
Cлайд 13
 Классификация карбоновых кислот b) оксо- (кетоно-) кислоты – содержат в своем составе карбонильную группу. Пример: COOH C = O CH3 пировиноградная (2-оксопропановая) кислота (ПВК), соли – пируваты COOH C=O CH2 COOH щавелевоуксусная (2-оксобутандиовая) кислота (ЩУК), соли – соли щавелевоуксусной кислоты
Классификация карбоновых кислот b) оксо- (кетоно-) кислоты – содержат в своем составе карбонильную группу. Пример: COOH C = O CH3 пировиноградная (2-оксопропановая) кислота (ПВК), соли – пируваты COOH C=O CH2 COOH щавелевоуксусная (2-оксобутандиовая) кислота (ЩУК), соли – соли щавелевоуксусной кислоты
Cлайд 14
 Классификация карбоновых кислот COOH CH2 C = O CH3 ацетоуксусная (3-оксобутановая) кислота, cоли – соли ацетоуксусной кислоты
Классификация карбоновых кислот COOH CH2 C = O CH3 ацетоуксусная (3-оксобутановая) кислота, cоли – соли ацетоуксусной кислоты
Cлайд 15
 Классификация карбоновых кислот III. Особую группу составляют высшие (жирные) карбоновые кислоты (ВЖК); входят в состав липидов. Различают ВЖК: предельные. Пример: C15H31COOH – пальмитиновая кислота, C17H35COOH – стеариновая кислота, C23H47COOH – лигноцириновая кислота, C23H46 (OH)COOH – цереброновая кислота;
Классификация карбоновых кислот III. Особую группу составляют высшие (жирные) карбоновые кислоты (ВЖК); входят в состав липидов. Различают ВЖК: предельные. Пример: C15H31COOH – пальмитиновая кислота, C17H35COOH – стеариновая кислота, C23H47COOH – лигноцириновая кислота, C23H46 (OH)COOH – цереброновая кислота;
Cлайд 16
 b) непредельные. Пример: C17H33COOH – олеиновая кислота (одна двойная связь), C17H31COOH – линолевая кислота (две двойных связи), C17H29COOH – линоленовая кислота (три двойных связи), C23H45COOH – нервоновая кислота (одна двойная связь). Классификация карбоновых кислот
b) непредельные. Пример: C17H33COOH – олеиновая кислота (одна двойная связь), C17H31COOH – линолевая кислота (две двойных связи), C17H29COOH – линоленовая кислота (три двойных связи), C23H45COOH – нервоновая кислота (одна двойная связь). Классификация карбоновых кислот
Cлайд 17

Cлайд 18

Cлайд 19
 Физические свойства Низшие жирные кислоты представляют собой легкоподвижные жидкости, средние члены – масла, высшие – твёрдые кристаллические вещества. Рис. 1. Температуры плавления карбоновых кислот.
Физические свойства Низшие жирные кислоты представляют собой легкоподвижные жидкости, средние члены – масла, высшие – твёрдые кристаллические вещества. Рис. 1. Температуры плавления карбоновых кислот.
Cлайд 20
 Физические свойства Рис. 2. Температуры кипения в гомологическом ряду карбоновых кислот, альдегидов и спиртов.
Физические свойства Рис. 2. Температуры кипения в гомологическом ряду карбоновых кислот, альдегидов и спиртов.
Cлайд 21
 Физические свойства Первые члены гомологического ряда карбоновых кислот обладают резким запахом, средние – прогорклым, неприятным, например, масляная кислота пахнет потом, высшие карбоновые кислоты вследствие нелетучести лишены запаха. Карбоновые кислоты, как правило, не ядовиты, однако приём внутрь концентрированных растворов (например, уксусной эссенции) вызывает тяжёлые ожоги. Нежелательно попадание этих растворов на кожу и тем более внутрь.
Физические свойства Первые члены гомологического ряда карбоновых кислот обладают резким запахом, средние – прогорклым, неприятным, например, масляная кислота пахнет потом, высшие карбоновые кислоты вследствие нелетучести лишены запаха. Карбоновые кислоты, как правило, не ядовиты, однако приём внутрь концентрированных растворов (например, уксусной эссенции) вызывает тяжёлые ожоги. Нежелательно попадание этих растворов на кожу и тем более внутрь.
Cлайд 22
 Строение карбоксильной группы Оδ- Сδ+ Оδ- Нδ+ .. Карбоксильная группа представляет собой плоскую p-π –сопряженную систему за счет взаимодействия pz–АО кислорода гидрокси-группы с π-связью карбонильной группы. Это приводит к повышению кислотных свойств карбоновых кислот по сравнению со спиртами.
Строение карбоксильной группы Оδ- Сδ+ Оδ- Нδ+ .. Карбоксильная группа представляет собой плоскую p-π –сопряженную систему за счет взаимодействия pz–АО кислорода гидрокси-группы с π-связью карбонильной группы. Это приводит к повышению кислотных свойств карбоновых кислот по сравнению со спиртами.
Cлайд 23
 В карбоновых кислотах частичный положительный заряд на атоме углерода меньше, чем в альдегидах и кетонах, поэтому для карбоновых кислот менее характерны реакции нуклеофильного присоединения (AN) по сравнению с альдегидами и кетонами. Строение карбоксильной группы
В карбоновых кислотах частичный положительный заряд на атоме углерода меньше, чем в альдегидах и кетонах, поэтому для карбоновых кислот менее характерны реакции нуклеофильного присоединения (AN) по сравнению с альдегидами и кетонами. Строение карбоксильной группы
Cлайд 24
 Строение карбоксильной группы В карбоновых кислотах выделяют следующие реакционные центры: Oδ- 1 R CH Cδ+ H OH 4 2 3 1 – основный, нуклеофильный центр, 2 – электрофильный центр, 3 – «OH» - кислотный центр, 4 – «CH» - кислотный центр. α
Строение карбоксильной группы В карбоновых кислотах выделяют следующие реакционные центры: Oδ- 1 R CH Cδ+ H OH 4 2 3 1 – основный, нуклеофильный центр, 2 – электрофильный центр, 3 – «OH» - кислотный центр, 4 – «CH» - кислотный центр. α
Cлайд 25
 Кислотные свойства Взаимодействие с нуклеофильными реагентами по карбонильному углероду Восстановление до CH2 Декарбоксилирование α-H реакции Химические свойства
Кислотные свойства Взаимодействие с нуклеофильными реагентами по карбонильному углероду Восстановление до CH2 Декарбоксилирование α-H реакции Химические свойства
Cлайд 26
 I. Реакции диссоциации (в «OH»-кислотном центре): За счет p-π –сопряжения отрицательный заряд в ацилат-ионе делокализован между двумя атомами кислорода: Химические свойства
I. Реакции диссоциации (в «OH»-кислотном центре): За счет p-π –сопряжения отрицательный заряд в ацилат-ионе делокализован между двумя атомами кислорода: Химические свойства
Cлайд 27

Cлайд 28
 Химические свойства II. Образование солей: а) С активными металлами: 2 CH3COOH + Mg → (CH3COO)2Mg + H2 б) С основными оксидами: 2 CH3COOH + CaO → (CH3COO)2Ca + H2O в) Со щелочами (реакция нейтрализации): CH3COOH + NaOH → CH3COONa + H2O г) С солями более слабых кислот: CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O 2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 + H2O Эти реакции используются как качественные на карбоксильную группу (по выделению пузырьков CO2).
Химические свойства II. Образование солей: а) С активными металлами: 2 CH3COOH + Mg → (CH3COO)2Mg + H2 б) С основными оксидами: 2 CH3COOH + CaO → (CH3COO)2Ca + H2O в) Со щелочами (реакция нейтрализации): CH3COOH + NaOH → CH3COONa + H2O г) С солями более слабых кислот: CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O 2 CH3COOH + Na2CO3 → 2 CH3COONa + CO2 + H2O Эти реакции используются как качественные на карбоксильную группу (по выделению пузырьков CO2).
Cлайд 29
 Образование солей дикарбоновыми кислотами: гидрооксалат натрия оксалат натрия (кислая соль) (средняя соль) оксалат кальция Химические свойства
Образование солей дикарбоновыми кислотами: гидрооксалат натрия оксалат натрия (кислая соль) (средняя соль) оксалат кальция Химические свойства
Cлайд 30

Cлайд 31
 Химические свойства молочная кислота лактат кальция Образование солей гидроксикислотами: Лактат кальция используется в медицине как кальциевый препарат.
Химические свойства молочная кислота лактат кальция Образование солей гидроксикислотами: Лактат кальция используется в медицине как кальциевый препарат.
Cлайд 32
 Химические свойства III. Реакции галогенирования (в СН - кислотном центре): CH3 CH2 COOH + Br2 CH3 CH COOH + HBr Br пропионовая кислота α- бромпропионовая кислота
Химические свойства III. Реакции галогенирования (в СН - кислотном центре): CH3 CH2 COOH + Br2 CH3 CH COOH + HBr Br пропионовая кислота α- бромпропионовая кислота
Cлайд 33
 Химические свойства IV. Реакции декарбоксилирования In vitro реакции протекают при нагревании, in vivo с участием ферментов декарбоксилаз. а) in vitro: HOOC COOH HCOOH + CO2 to янтарная кислота ангидрид янтарной кислоты
Химические свойства IV. Реакции декарбоксилирования In vitro реакции протекают при нагревании, in vivo с участием ферментов декарбоксилаз. а) in vitro: HOOC COOH HCOOH + CO2 to янтарная кислота ангидрид янтарной кислоты
Cлайд 34
 Химические свойства COOH COOH CH2 CH2 CH2 CH2 CH2 CH3 COOH глутаровая кислота масляная кислота F -CO2 б) in vivo:
Химические свойства COOH COOH CH2 CH2 CH2 CH2 CH2 CH3 COOH глутаровая кислота масляная кислота F -CO2 б) in vivo:
Cлайд 35
 Химические свойства c) Реакции окислительного декарбоксилирования Пример: Превращение ПВК в митохондриях с участием декарбоксилазы (F), дегидрогеназы (НАД+) и кофермента А (HS – KoA). O H3C C COOH H3C C O H O H3C C + НАД·H - -H+ S KoA F -CO2 HS – KoA, НАД+ Ацетил -KoA Ацетилкофермент A вовлекается в цикл трикарбоновых кислот или цикл Кребса.
Химические свойства c) Реакции окислительного декарбоксилирования Пример: Превращение ПВК в митохондриях с участием декарбоксилазы (F), дегидрогеназы (НАД+) и кофермента А (HS – KoA). O H3C C COOH H3C C O H O H3C C + НАД·H - -H+ S KoA F -CO2 HS – KoA, НАД+ Ацетил -KoA Ацетилкофермент A вовлекается в цикл трикарбоновых кислот или цикл Кребса.
Cлайд 36

Cлайд 37
 Химические свойства V. Реакции этерификации или нуклеофильного замещения (SN)у sp2-гибридизованного атома углерода Пример: уксусная кислота этиловый спирт этилацетат вода
Химические свойства V. Реакции этерификации или нуклеофильного замещения (SN)у sp2-гибридизованного атома углерода Пример: уксусная кислота этиловый спирт этилацетат вода
Cлайд 38
 Химические свойства VI. Межмолекулярная дегидратация с образованием ангидридов (при пропускании паров кислот над водоотнимающими средствами P2O5, H2SO4конц: “Ангидрид” (an – отрицающая частица, греч. udor – вода) означает “лишённый воды”.
Химические свойства VI. Межмолекулярная дегидратация с образованием ангидридов (при пропускании паров кислот над водоотнимающими средствами P2O5, H2SO4конц: “Ангидрид” (an – отрицающая частица, греч. udor – вода) означает “лишённый воды”.
Cлайд 39
 Химические свойства VII. Окисление карбоновых кислот В организме карбоновые кислоты окисляются в основном за счёт т.н. b-окисления. Кроме того in vivo встречается также α- и w-окисление. In vitro некоторые аналогичные реакции b-окисления можно осуществить с помощью 3% перекиси водорода.
Химические свойства VII. Окисление карбоновых кислот В организме карбоновые кислоты окисляются в основном за счёт т.н. b-окисления. Кроме того in vivo встречается также α- и w-окисление. In vitro некоторые аналогичные реакции b-окисления можно осуществить с помощью 3% перекиси водорода.
Cлайд 40
 Химические свойства Процесс α-окисления идёт в пероксисомах. При нарушении этого процесса развивается синдром Рефсума, характеризующийся накоплением фитановой кислоты в мозге. a-Окисление:
Химические свойства Процесс α-окисления идёт в пероксисомах. При нарушении этого процесса развивается синдром Рефсума, характеризующийся накоплением фитановой кислоты в мозге. a-Окисление:
Cлайд 41
 Химические свойства Окисление дикарбоновых кислот in vivo: янтарная кислота фумаровая кислота
Химические свойства Окисление дикарбоновых кислот in vivo: янтарная кислота фумаровая кислота
Cлайд 42
 Химические свойства VII. Реакции окисления гидроксикислот a) Окисление молочной кислоты COOH COOH HO C H C O CH3 CH3 молочная кислота + НАД+ - НАД · H, - H+ пировиноградная кислота
Химические свойства VII. Реакции окисления гидроксикислот a) Окисление молочной кислоты COOH COOH HO C H C O CH3 CH3 молочная кислота + НАД+ - НАД · H, - H+ пировиноградная кислота