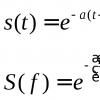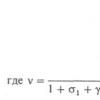Методы определения микотоксинов. Методы определения микотоксинов и контроль за загрязнением пищевых продуктов
Для определения содержания микотоксинов в составе пищевых продуктов проводят пробоподготовку методом твердофазной экстракции на концентрирующих патронах «Диапак» (п. 3.2.3). Разделение, иден-тификацию и количественное определение микотоксинов в подготовленных пробах осущест-вляют методом высокоэффекти-вной жидкостной хроматографии на микроколоночном хроматог-рафе серии «Милихром–5» в модульном исполнении (рис. 12).
Рис. 12. Микроколоночный хроматограф
В работе рассматривается обращенно-фазовый вариант ВЭЖХ для определения патулина. Детектирование проводят на длине волны 276 нм. Для точной идентификации патулина использу-ют также многоволновое детектирование, позволяющее применить в качестве дополнительного параметра идентификации спектральные отно-шения. Разделение осуществляют в режиме градиентного элюирования, что позволяет повысить разрешающую способность и чувствительность анализа.
Рис. 13. Жидкостный хроматограф:
1 – насос; 2 – узел ввода проб; 3 – хроматографическая колонка; 4 – детектор;
5 – слив для элюата или коллектор для фракций; 6 – регистратор (самописец,
интегратор или персональный компьютер)
6
4
Анализ пробы с помощью жидкостного хроматографа (рис. 13) осуществляется следующим образом. Определенный объем раствора анализируемой пробы с помощью узла ввода проб (2) вводится в верхнюю часть хроматографической колонки (3). С помощью насоса (1) анализируемая смесь прокачивается элюентом через хроматогра-фическую колонку (3), в которой происходит разделение анализируемой смеси на отдельные фракции (компоненты). Вытекающий из колонки элюат, содержащий разделенные компоненты, анализируется детектором (4), показания которого фиксируются регистратором (6).
Методические основы ВЭЖХ
Элюотропные ряды. Элюирующей силой элюента называется способность элюента (растворителя или смеси растворителей) вытеснять адсорбат с поверхности адсорбента. При этом чем сильнее молекулы элюента адсорбируются на активных центрах сорбента, тем выше его элюирующая сила. Расположенные в ряд по возрастанию элюирующей силы растворители образуют элюотропный ряд .
В качестве элюентов для обращенно-фазовой хроматографии используются смеси растворителей, содержащие воду и органические соединения, модифицирующие элюирующую силу – н-спирты, ацетонитрил, тетрагидрофуран и другие, образующие с водой истинные растворы. В нормально-фазовой хроматографии в качестве элюентов используют полярные модификаторы – линейные и циклические углеводороды (гексан, циклогексан, гептан и др.).
Детекторы для жидкостных хроматографов. В настоящее время разработано более 20 детекторов для ВЭЖХ. Наибольшее распространение получили пять, три из которых являются оптическими, а два – электрохимическими. Эти пять детекторов позволяют анализировать все классы органических и неорганических веществ.
К оптическим детекторам относят спектрофотометрический детектор (ультрафиолетовый (УФ), работающий в волновом диапазоне
200–360 нм и видимый с волновым диапазоном 360–780 нм), флуориметрический и рефрактометрический детекторы; к электро-химическим – вольтамперометрический и кондуктометрический детекторы. Особое значение имеет масс-спектрометрический детектор, обладающий уникальной информативностью, так как позволяет проводить идентификацию хроматографически разделенных компо-нентов, используя базы данных масс-спектров веществ.
Спектрофотометрический детектор является наиболее распространенным детектором для ВЭЖХ. Принцип его действия основан на известном законе светопоглощения Бугера-Ламберта-Бера . Спектро-фотометрический детектор регистрирует спектры избира-тельного абсорбционного поглощения излучения веществом. Спектры поглощения зависят от строения исследуемого вещества. Это позволяет идентифицировать вещество по его спектру, располагая библиотекой спектров или стандартами. Согласно закону Бугера-Ламберта-Бера интенсивность полос спектров зависит от концентрации вещества, что является основой количественного анализа, т. е. определения концентра-ции вещества.
Пусть монохроматический свет от источника интенсивностью I 0 попадает на кювету длиной l (оптический путь). Кювета заполнена раствором вещества с концентрацией С . Вещество способно поглощать монохроматическое излучение. Мерой способности поглощения данного монохроматического излучения служит величина ε – коэффициент молярного поглощения, или коэффициент экстинкции. Из кюветы выходит ослабленный световой пучок интенсивностью I . Согласно закону светопоглощения при длине волны λ= const
I = I 0 ∙10 -ε Cl , (7)
где I
– интенсивность светового потока после прохождения кюветы;
I
0 – интенсивность падающего светового потока; ε
– коэффициент экстин-кции; С
– молярная концентрация вещества в кювете; l
– длина кюветы.
Отношение I к I 0 , выраженное в процентах, называется пропусканием Т , а величина А=lg(I 0 / I ) – оптической плотностью.
A=lg(I 0 /I)= ε С∙ l . (8)
Оптическая плотность вещества прямо пропорциональна концентрации анализируемого вещества. В спектрофотометрических детекторах аналитической величиной является оптическая плотность А . Формула (8) служит основой количественного анализа при использовании спектрофотометрического детектора, так как оптическая плотность А вещества прямо пропорциональна высоте или площади хроматографического пика.
Зависимость оптической плотности А от длины волны падающего на кювету с веществом света в диапазоне длин волн от 190 до 360 нм называется ультрафиолетовым спектром поглощения (рис. 14).
200 230 260 290 320 350 λ , нм
А
, е.о.п.
Рис. 14. Ультрафиолетовый спектр поглощения водного раствора
вещества х
3.2.3. Пробоподготовка образцов
Любое вещество имеет длину волны максимального поглощения(λ , нм). При использовании данной длины волны детектор имеет наименьший порог обнаружения вещества.
С помощью спектрофотометрического детектора (СФД) детектируется большое количество веществ различных классов, поглоща-ющих ультрафиолетовый свет.
Использование спектрофотометрического детектора в хроматогра-фии значительно облегчает идентификацию. Многоволновый детектор в сочетании с программным обеспечением позволяет получить хроматограмму на нескольких длинах волн одновременно и рассчитать дополнительный параметр для идентификации компонентов – спектральное отношение (Q ) – отношение высот хроматографического пика на разных длинах волн
где А 1 и А 2 – коэффициенты оптической плотности на длинах волн 1 и 2. Величина Q для каждого вещества является постоянной характеристикой и не зависит от его концентрации. Точность спектральных отношений зависит от значений оптической плотности вещества и конструкции детектора.
Пробоподготовка образцов при помощи метода твердофазной экстракции на концентрирующих патронах обеспечивает экономию временных и трудовых затрат. Твердофазная экстракция позволяет сконцентрировать пробу и очистить ее от сопутствующих примесей. Комплексная схема твердофазной экстракции предусматривает последовательное использование двух патронов:
– универсального концентрирующего патрона «ДИАПАК П-З» – патрона многоразового применения (до 50 проб) с набором верхних и нижних фильтров (10 шт.);
– универсального патрона для тонкой очистки «ДИАПАК С» – патрон одноразового применения.
Для подготовки концентрирующих патронов необходимо выполнить следующие операции.
Для подготовки концентрирующего патрона «ДИАПАК П-З» :
– прокачать через патрон 10 мл смеси вода-ацетонитрил (58:42);
– непосредственно перед проведением пробоподготовки прокачать через патрон 10 мл дистиллированной воды.
Для подготовки концентрирующего патрона «ДИАПАК С» :
– прокачать через патрон 5 мл бензола и заглушить патрон с обоих концов.
Подготовка пищевого продукта к концентрированию
Навеску пробы массой 10,0 г поместить в стеклянный стакан, смешать с небольшим количеством дистиллированной воды и коли-чественно перенести в мерную колбу вместимостью 50 мл. В колбу внести по 6,0 мл раствора Карреза I и раствора Карреза II. Содержание колбы довести дистиллированной водой до метки, тщательно перемешать и отфильтровать в мерный цилиндр через бумажный складчатый фильтр. Измерить объем прозрачного фильтрата П.
При подготовке осветленных соков и напитков отфильтровать пробу через плотный бумажный фильтр до получения 20 мл прозрачного фильтрата П.
Концентрирование пробы на патроне «ДИАПАК П-З»
Весь объем фильтрата П нанести на предварительно подготовленный патрон со скоростью 1–2 капли в секунду.
Промыть патрон 5 мл бидистиллированной воды, отбрасывая все смывы.
Элюировать патулин с патрона 10 мл этилацетата в колбу или мерную пробирку с пришлифованной пробкой, содержащую 5 мл
1,5%-ного водного раствора карбоната натрия, закрыть пробкой, интенсивно перемешать и дать расслоиться.
Собрать осушительную колонку, заполнив корпус с фильтром примерно 2 г безводного сульфата натрия, уплотнить осушитель постукиванием по стенке колонки и зафиксировать ватным тампоном.
Декантировать верхний этилацетатный слой при помощи пипетки, профильтровать через осушительную колонку, собирая фильтрат в отгонную сердцевидную колбу на 50 мл; дополнительно проэкстрагировать водный раствор карбоната натрия сначала 10 мл, а затем 5 мл этилацетата и, после расслоения, последовательно профильтровать декантированные объемы этилацетата через осушительную колонку в ту же колбу.
Упарить этилацетат в вакууме при температуре не выше 40°С до объема около 0,5 мл (не упаривать досуха!), добавить 2,5 мл бензола (соблюдать соотношение объемов 1:5).
Очистка пробы на патроне «ДИАПАК С»
Снять заглушки с подготовленного патрона и пропустить бензол-этилацетатный раствор пробы со скоростью 1–2 капли в секунду. Обмыть колбу еще 0,5–1,0 мл смеси бензол-этилацетат (85:15) и нанести на патрон, отбросив смывы.
Элюировать патулин с патрона 6 мл смеси бензол:этилацетат (7:3), собирая элюат в сердцевинную отгонную колбу.
Упарить элюат досуха на суховоздушной бане при температуре не более 40°С.
Немедленно! После упаривания перерастворить пробу в 0,2–0,25 мл элюента А (п. 3.2.4.2), охлажденного до 5–8°С.
3.2.4. Порядок выполнения работы
Цель работы – определение содержания микотоксина патулина в составе пищевых продуктов методом высокоэффективной жидкостной хроматографии на микроколоночном хроматографе серии «Милихром–5».3.2.4.1. Методика измерений
Проведение измерений включает следующие основные этапы:– градуировку хроматографа по растворам с известной массовой концентрацией патулина;
– подготовку пищевой пробы методом твердофазной экстракции по пп. 3.2.3;
– анализ экстракта методом ВЭЖХ с регистрацией сигнала УФ детектором;
– идентификацию патулина по параметрам удерживания и спектральным отношениям;
– вычисление массовой концентрации патулина в пробе на основе зарегистрированного аналитического сигнала (высоты пика) и градуировочного графика;
– вычисление массовой доли патулина в составе пищевого продукта.
Приборы, реактивы и материалы, необходимые для выполнения работы:
– хроматограф серии «Милихром–5» или любой другой хроматограф для ВЭЖХ с программным обеспечением WinXrom или Мультихром;
– хроматографическая колонка для ВЭЖХ: Диасфер–110–С10СN (5 мкм, 2×80 мм, ТУ 4215–001–05451931–94);
– дозатор переменного объема на 1–100 мкл;
– дозатор переменного объема на 100–1000 мкл;
– коническая колба с плотно притертым шлифом емкостью до 10 мл;
– мембранные фильтры;
– набор стандартных растворов патулина с концентрацией – 1, 2, 5 и 10 мг/л;
– фосфорная кислота 85%-ная;
– ацетонитрил для жидкостной хроматографии (о.с.ч. ТУ 6–09–3513–86, УФ поглощение до 200 нм);
– гексан, химически чистый (ректифицированный);
– трифторуксусная кислота;
– раствор Карреза I – 15,0 г гексацианоферата II калия растворить в 100 мл воды.
– раствор Карреза II – 30,0 г ацетата цинка растворить в 100 мл воды;
– элюенты А, Б и С.
Приготовление элюентов
Элюент А. В мерную колбу с плотно притертым стеклянным шлифом емкостью 100 мл вносят 20 мл ацетонитрила и 0,5 мл 10%-ного раствора трифторуксусной кислоты. Раствор тщательно перемешивают и доводят до метки дистиллированной водой, предварительно отфильтрованной через мембранный капроновый фильтр (0,2 мкм). Затем проводят дегазацию элюента вакуумированием в течение 1 минуты при разрежении 1кг∙с/см 2 .
Элюенты Б и С готовят также как элюент А, только на 100 мл раствора берут 10 и 0 мл ацетонитрила, соответственно.
3.2.4.2. Установка хроматографических режимов разделения
и регистрации результатов
Для проведения измерений необходимо установить рабочие режимы хроматографа.Режимы дозатора:
– регенерация – 300 мкл;
– объем пробы – 5 мкл;
– расход элюента – 150 мкл/мин;
– режимы градиентного элюирования: 800 мкл – элюента А,
500 мкл – элюента Б, 300 мкл – элюента С;
– температура термостата – 35 0 С.
Режимы детектирования:
– число длин волн – 3;
– длины волн – 250, 276, 290 нм;
– время измерения – 0,04 с.
Кондиционирование хроматографической системы осуществляют за 30 минут до проведения измерений путем выполнения «холостого» анализа, в котором стандартную смесь, содержащую патулин, заменяют 5–10 мкл элюента, а затем проводят разделение стандартной смеси микотоксинов.
Задание 1. Изучить методику пробоподготовки пищевых продуктов для определения содержания патулина. Приготовить пробы в соответствии с п. 3.2.3.
Задание 2. Провести градуировку хроматографа. Градуировку хроматографа осуществляют последовательным вводом стандартных растворов патулина с концентрациями 1, 2, 5 и 10 мг/л.
Под руководством преподавателя предлагается с клавиатуры ПК в программу (WinXrom) ввести параметры проведения хроматографического разделения (пп. 3.2.4.3) и запустить в автоматическом режиме 2–4 хроматографических анализа. Результаты оформить в виде табл. 6.
Т а б л и ц а 6
На основе полученных хроматографических профилей построить калибровочный график (по оси ординат откладывается концентрация – мг/л, по оси абсцисс оптическая плотность микотоксина А – е.о.п.).
Задание 3. Идентифицировать в исследуемом образце пищевого продукта патулин и определить его концентрацию.
Под руководством преподавателя запустить измерение подготовленной пробы пищевого продукта в автоматическом режиме
(с параметрами хроматографического разделения, выбранными в задании 2). По окончании измерения провести идентификацию микотоксина патулина по файлу стандарта («СтандартДД–ММ–ГГ.001»), полученному в задании 2. Используя калибровочный график, построенный в задании 2, определить концентрацию патулина в пробе пищевого продукта.
Результаты занести в табл. 7.
Т а б л и ц а 7
Массовую концентрацию патулина в пробе пищевого продукта вычисляют по формуле
где С – массовая концентрация патулина в пробе, мг/л (вычисляется по градуировочной зависимости, исходя из значения высоты аналитического пика); V p – объем пробы, мл; R – степень извлечения микотоксина на стадии пробоподготовки (равна 60%); М пр – масса пробы пищевого продукта, использованной для очистки и последующего хроматографического определения, г.
Результат измерения массовой доли микотоксина в определяемом объекте представляют в следующем виде: Х ± мг/кг; при Р =0,95 и заносят в протокол (прил. 1), где X i , – массовая концентрация патулина в пробе, мг/кг; Р – вероятность; – граница абсолютной погрешности, вычисляемая по формуле
После получения результата необходимо оценить значения нормативов оперативного контроля сходимости, которые приведены в соответствующих ГОСТах на методы контроля (анализа).
Сделать заключение о соответствии (или несоответствии) содержания патулина в исследованном пищевом продукте допустимым уровням, установленным СанПиН 2.3.2.1078–01.
Вопросы для самоконтроля
1. Какие принципы лежат в основе классификации хроматографических методов анализа?
2. В чем сущность хроматографического разделения? Как проводят качественную идентификацию и количественный анализ?
3. В каких пищевых продуктах нормируется содержание микотоксинов? Какие микотоксины определяют в составе пищевых продуктов в соответствии с требованиями СанПиН?
4. Какой хроматографический метод используют для определения содержания микотоксинов в составе пищевых продуктов?
5. На чем основано спектрофотометрическое детектирование? Что такое спектральные отношения и для чего их используют?
6. Как проводят пробоподготовку пищевых продуктов для определения содержания патулина методом ВЭЖХ?
7. Проведение каких операций включает методика определения патулина методом ВЭЖХ?
8. Что такое элюент и градиентное элюирование? Какие элюенты используют при определении патулина методом ВЭЖХ?
9. Как проводят идентификацию патулина и его количественное определение?
10. Как обеспечивается точность определения патулина методом ВЭЖХ?
Методы определения микотоксинов
Современные методы обнаружения и определения содержания микотоксинов в пищевых продуктах и кормах включают скрининг-методы, количественные аналитические и биологические методы.
Скрининг-методы отличаются быстротой и удобны для проведения серийных анализов, позволяют быстро и надежно разделять загрязненные и незагрязненные образцы. К числу скрининг-методов относятся методы тонкослойной хроматографии (ТСХ-методы), флуоресцентный метод определения зерна, загрязненного афлатоксинами.
Количественные аналитические методы определения микотоксинов представлены химическими, радиоиммунологическими и иммуноферментными методами. Сегодня наиболее распространенными являются химические методы, включающие две стадии: стадию выделения и стадию количественного определения микотоксинов. Стадия выделения включает экстракцию (отделение микотоксина от субстрата) и очистку (отделение микотоксина от соединений с близкими физико-химическими характеристиками). Окончательное разделение и количественное определение микотоксинов проводится с помощью различных хроматографических методов. Универсальным методом определения всех видов микотоксинов является тонкослойная хроматография (ТСХ).
При отборе проб из партии продукта основной задачей является получение среднего образца или средней пробы, по концентрации микотоксинов являющейся представительной для всей партии (отобранные образцы должны характеризовать качество всей партии). Выполнение этой задачи зависит от природы и распределения микотоксинов, характеристики продукта (сырой, обработанный, сыпучий, жидкий, пастообразный и т. д.), способа подготовки образца. К примеру, загрязнение арахиса афлатоксинами имеет выраженный гетерогенный характер: в отдельных зернах арахиса их содержание может колебаться от тысячных долей миллиграмма до десятков и более миллиграммов на 1 кг, т. е. различаться на 5-6 порядков. По этой причине вклад ошибки при отборе пробы в общую ошибку анализа при определении афлатоксинов в арахисе является основным и в ряде случаев может составлять более 90 %.
С точки зрения однородности загрязнения микотоксинами все продукты можно разделить на две группы: 1) продукты с высокой степенью неоднородности (очищенный и неочищенный арахис, масличные семена, целые или грубомолотые зерна, орехи); 2) продукты с однородным характером загрязнения (жидкости: молоко, растительные масла, соки, пюре; мука, размолотые шроты).
Для получения представительного среднего образца продуктов l-й группы размер исходного образца должен быть максимально возможным (не менее 2 кг), при этом средний лабораторный образец следует выделять из перемолотого (гомогенизированного) среднего образца.
Для однородных продуктов 2-й группы (джем, повидло, фруктовые соки в мелкой жестяной таре, сгущенное молоко, сухие молочные продукты и др.) пробы следует отбирать в количестве единиц упаковки, соответствующих величине среднего образца (100-200 г), при условии, что продукт происходит из одной партии.
Химические методы обнаружения и идентификации отдельных афлатоксинов основаны на их специфической флуоресценции в УФ-свете (около 365 нм), на различиях в подвижности при тонкослойной хроматографии, на специфичности их спектров поглощения и флуоресценции.
В отличие от афлатоксинов трихотецены не обладают поглощением или, флуоресценцией в видимой части спектра, что затрудняет их обнаружение при тонкослойной хроматографии. При этом выявить трихотецены с помощью ТСХ возможно при использовании методов, основанных на обработке ТСХ-пластин специальными реагентами, которые образуют с трихотеценами окрашенные или флуоресцирующие производные. К примеру, Т -2 токсин при обработке пластин; концентрированной серной кислотой образует пятна с голубой флуоресценцией;) в УФ-свете.
Арбитражными методами количественного определения микотоксинов являются следующие:
‣‣‣ газожидкостная хроматография (для Т-2 токсина);
‣‣‣ высокоэффективная жидкостная хроматография (ВЭЖХ) с использованием УФ-фотометрического детектора (для дезоксиниваленола и патулина);
‣‣‣ ВЭЖХ с использованием флуоресцентного детектора (для афлатоксинов; и зеараленона).
На рис. 2 представлено устройство современного жидкостного хроматографа в простейшем исполнении.
Подвижная фаза из емкости 1 через входной фильтр 9 подается насосом высокого давления 2 в систему ввода образца 3 - ручной инжектор или автосамплер, туда же вводится проба. Далее через фильтр 8 образец с током подвижной фазы поступает через предколонку в разделительную колонку 4. Далее поток подвижной фазы, выходящий из колонки и содержащий компоненты разделяемой смеси (элюат), поступает в детектор 5 и удаляется в сливную емкость 7. При протекании элюата через измерительный контур детектора происходит регистрация хроматограммы и передача данных на регистратор 6 или в компьютер.

Устройство жидкостного хроматографа (изократическая система):
1 - емкость; 2 - система высокого давления; 3 - ручной инжектор или автосамплер; 4 - разделительная колонка; 5 - детектор; б - регистратор или компьютер; 7 - сливная емкость; 8 - фильтр; 9 - входной фильтр
Система, приведенная на рис. 2, является изократической: в процессе хроматографирования состав подвижной фазы не изменяется. В случае если в ходе хроматогфического анализа крайне важно изменять концентрацию одного или нескольких компонентов подвижной фазы, то применяют так называемые градиентные системы, состоящие обычно из двух или более насосов. В случае градиентного элюирования каждый растворитель подается из отдельного сосуда в специальную смесительную камеру с магнитной мешалкой, где по определенной программе происходит их смешивание с заданным соотношением объёмов.
Для анализа микотоксинов чаще применяются градиентные системы, где в качестве подвижной фазы используются растворы ацетонитрила в воде с линейно изменяющейся во времени концентрацией.
Хроматографическая колонка представляет собой металлическую трубку ой от 150 до 250 мм с внутренним диаметром 4,6 мм, заполненную специальным сорбентом на базе силикагеля с привитыми углеводородными радикалами. Предколонка служит для защиты хроматографической колонки от загрязнений.
УФ-фотометрический детектор является наиболее распространенным видом детекторов для ВЭЖХ. Принцип действия детектора аналогичен принципу действия обычного спектрофотометра: он регистрирует оптическую плотность раствора. Различие состоит в том, что УФ-детектор является проточным, вместо кюветы с раствором в нем используется фотометрическая ячейка. Поток элюента протекает через рабочую ячейку, а через сравнительную ячейку направляется поток чистой подвижной фазы. Источником света служит ртутная лампа, дающая интенсивное УФ-излучение. Свет с нужной длиной волны выделяется с помощью подходящих оптических фильтров, проходит через ячейки, частично поглощается молекулами подвижной фазы и разделяемых компонентов и улавливается фотоприемником. Светопоглощение (оптическую плотность) элюата непрерывно регистрирует самописец или компьютер, записывая хроматограмму. Разделяемые компоненты смеси (к примеру, микотоксины) представлены на хроматограмме в виде пиков. Положение пика на хроматограмме используют для идентификации вещества, а площадь пика - для количественного определения.
Более сложное устройство представляет собой флуоресцентный (флуориметрический) детектор.
Размещено на реф.рф
Такой детектор использует способность органических соединений, в частности афлатоксинов и зеараленона, флуоресцировать под действием УФ- или видимого излучения. Флуоресцентный детектор имеет проточную ячейку с двумя взаимно перпендикулярными оптическими каналами. Один из них служит для подвода возбуждающего излучения, другой позволяет измерять интенсивность флуоресценции. В случае анализа афлатоксинов B 1 и М 1 длина волны возбуждающего излучения составляет 360 нм, а длина волны испускаемого излучения - 420 нм.
Следует отметить, что для анализа афлатоксинов можно применять также УФ-детектор, однако его чувствительность на порядок ниже, чем у флуориметрического детектора, в связи с этим при анализе низких концентраций афлатоксинов (на уровне ПДК и ниже) предпочтительным является флуоресцентное детектирование.
Методы определения микотоксинов - понятие и виды. Классификация и особенности категории "Методы определения микотоксинов" 2017, 2018.
Методы определения микотоксинов. Современные методы обнаружения и определения содержания микотоксинов в пищевых продуктах и кормах включают скрининг-методы, количественные аналитические и биологические методы.
Скрининг-методы отличаются быстротой и удобны для проведения серийных анализов, позволяют быстро и надежно разделять загрязненные и незагрязненные образцы. К ним относятся такие широко распространенные методы, как миниколоночный метод определения афлатоксинов, охратоксина А и зеараленона; методы тонкослойной хроматографии (ТСХ-методы) для одновременного определения до 30 различных микотоксинов, флуоресцентный метод определения зерна, загрязненного афлатоксинами, и некоторые другие.
Количественные аналитические методы определения микотоксинов представлены химическими, радиоиммунологическими и иммуноферментными методами. Химические методы являются в настоящее время наиболее распространенными и состоят из двух стадий: стадии выделения и стадии количественного определения микотоксинов. Стадия выделения включает экстракцию (отделение микотоксина от субстрата) и очистку (отделение микотоксина от соединений с близкими физико-химическими характеристиками). Окончательное разделение микотоксинов проводится с помощью различных хроматографических методов, таких как газовая (ГХ) и газожидкостная хроматография (ГЖХ), тонкослойная хроматография (ТСХ), высокоэффективная жидкостная хроматография (ВЭЖХ) и масс-спектрометрия. Количественную оценку содержания микотоксинов проводят путем сравнения интенсивности флуоресценции при ТСХ в ультрафиолетовой области спектра со стандартами. Для подтверждения достоверности полученных результатов применяют различные тесты, основанные на получении производных микотоксинов с иными хроматографическими, колориметрическими или флюорометрическими характеристиками.
Высокочувствительные и высокоспецифичные радиоиммуно-химические и иммуноферментные методы обнаружения, идентификации и количественного определения микотоксинов находят все более широкое применение и пользуются повышенным вниманием со стороны исследователей. Эти методы основаны на получении антисывороток к конъюгатам микотоксинов с бычьим сывороточным альбумином. Основным преимуществом этих методов является их исключительная чувствительность.
Биологические методы обычно не отличаются высокой специфичностью и чувствительностью и применяются, главным образом, в тех
случаях, когда отсутствуют химические методы выявления микотоксинов или в дополнение к ним в качестве подтверждающих тестов. В качестве тест-объектов используют различные микроорганизмы, куриные эмбрионы, различные лабораторные животные, культуры клеток и тканей.
Контроль за загрязнением микотоксинами. В настоящее время вопросы контроля за загрязнением продовольственного сырья, пищевых продуктов и кормов микотоксинами решаются не только в рамках отдельных государств, но и на международном уровне, под эгидой ВОЗ и ФАО.
В системе организации контроля за загрязнением продовольственного сырья и пищевых продуктов можно выделить два уровня: инспектирование и мониторинг, которые включают регулярные количественные анализы продовольственного сырья и пищевых продуктов.
Мониторинг позволяет установить уровень загрязнения, оценить степень реальной нагрузки и опасности, выявить пищевые продукты, являющиеся наиболее благоприятным субстратом для микроскопических грибов - продуцентов микотоксинов, а также подтвердить эффективность проводимых мероприятий по снижению загрязнения микотоксинами. Особое значение имеет контроль за загрязнением микотоксинами при характеристике качества сырья и продуктов, импортируемых из других стран.
С целью профилактики алиментарных токсикозов основное внимание следует уделять зерновым культурам. В связи с этим необходимо соблюдать следующие меры по предупреждению загрязнения зерновых культур и зернопродуктов.
1. Своевременная уборка урожая с полей, его правильная агротехническая обработка и хранение.
2. Санитарно-гигиеническая обработка помещений и емкостей для хранения.
3. Закладка на хранение только кондиционного сырья.
4. Определение степени загрязнения сырья и готовых продуктов.
5. Выбор способа технологической обработки в зависимости от вида и степени загрязнения сырья.
Основные пути загрязнения продовольственного сырья и пищевых продуктов токсичными штаммами микромицетов приведены на рис. 11.7.
536:: 537:: Содержание
537:: 538:: 539:: 540:: 541:: 542:: 543:: 544:: 545:: 546:: 547:: 548:: 549:: 550:: Содержание
Методы определения микотоксинов
При рассмотрении различных групп микотоксинов уже упоминались возможные методы их определения. Обобщая информацию о современных методах обнаружения и определения содержания микотоксинов в продуктах питания и кормах, можно резюмировать, что в настоящее время используются скрининг-методы, количественные аналитические и биологические методы.
Скрининг-методы отличаются быстротой и удобны для проведения серийных анализов, позволяют быстро и надежно разделять загрязненные и незагрязненные образцы. К ним относятся такие широко распространенные методы, как миниколоночный метод определения афлатоксинов, охратоксина А и зеараленона; методы ТСХ для одновременного определения до 30 различных микотоксинов, флуоресцентный метод определения зерна, загрязненного афлатоксинами.
В качестве количественных аналитических методов определения микотоксинов используются химические, радиоиммунологические и иммуноферментные методы. Химические методы являются в настоящее время наиболее распространенными и включают стадии выделения и количественного определения микотоксинов. Стадия выделения включает экстракцию и очистку микотоксинов от соединений с близкими физико-химическими характеристиками. Окончательное разделение микотоксинов проводится с помощью различных методов хроматографии: ГХ, ГЖХ, ТСХ, ВЭЖХ и масс-спектрометрия. Количественная оценка содержания микотоксинов осуществляется либо путем сравнения интенсивности флуоресценции в УФ области образца и стандарта (ТСХ), либо по площадям (высотам) пиков (ВЭЖХ, ГЖХ), но и в этом случае обязательным условием является наличие стандартных образцов определяемых веществ.
Высокочувствительные и высокоспецифичные радиоиммуно-химические и иммуноферментные методы обнаружения, идентификации и количественного определения микотоксинов находят все более широкое применение. Эти методы основаны на получении антисывороток к конъюгатам микотоксинов с бычьим сывороточным альбумином. Основным преимуществом этих методов является их исключительная чувствительность.
Биологические методы обычно не отличаются высокой специфичностью и чувствительностью и применяются, в основном, в тех случаях, когда отсутствуют химические методы выявления микотоксинов или в дополнение к ним в качестве подтверждающих тестов. В качестве тест-объектов, как упоминалось выше, используют различные микроорганизмы, куриные эмбрионы, различных лабораторных животных, культуры клеток и тканей.
Действие и возможности предупреждения микотоксикозов
Сельскохозяйственные продукты и корма, пораженные грибками, изменяют свой внешний вид, что помогает установить их недоброкачественность. Такие продукты и корма могут стать причиной тяжелых заболеваний людей и животных вследствие накопления в них микотоксинов. Особое внимание следует обращать на обнаружение микотоксинов в продуктах животного происхождения (мясо, молоко, молочные продукты, яйца), которые могут попасть в них вследствие скармливания сельскохозяственным животным и птице кормов, зараженных микотоксинами. Последние частично накапливаются в тканях и органах животных, у яйценесущих птиц – также в яйцах. Из организма лактирующих животных микотоксины, метаболизируясь, выделяются с молоком. Такие продукты представляют наибольшую опасность для здоровья человека, т.к. микотоксины могут присутствовать в них без видимого роста плесени. Микотоксины обладают канцерогенным, мутагенным действием, подавляют иммунитет организма, поражают почки, печень, нервную и кровеносную системы, желудочно-кишечный тракт, вызывают заболевания крови, септическую ангину, дерматиты, судороги, острые боли, состояние тяжелого опьянения, нарушают гормональное равновесие и функции воспроизводства.
Микотоксины устойчивы к действию физических и химических факторов. Поэтому разрушение их в пищевых продуктах представляет собой трудную задачу. Общепринятые способы технологической и кулинарной обработки лишь частично уменьшают содержание микотоксинов в продукте. Высокая температура (свыше 200 градусов), замораживание, высушивание, воздействие ионизирующего и ультрафиолетового излучения оказались также малоэффективными. Микотоксины почти не разрушаются при нагревании, поэтому нельзя использовать для приготовления пищи подпорченные продукты: крупы, муку, хлеб, макаронные изделия, овощи, фрукты, орехи и т.д.
Отравление может проявляться не сразу: понемногу накапливаясь в организме, микотоксины через десятилетия могут вызвать тяжелые заболевания, в том числе онкологические. Выявлено более 100 токсических соединений, вырабатываемых плесенью. Важно знать, что микотоксины находятся не только там, где плесень и гниль, но и во всем продукте. Нельзя использовать орехи, особенно очищенные, арахис, если они имеют истекший срок хранения, имеют запах плесени или заплесневели. Следует избегать употребления любых заплесневевших продуктов, в том числе заплесневевшего творога и колбасы. Вредно использовать заплесневевший хлеб: обрезание корок ничего не дает - токсинами заражен весь батон. Не следует есть или использовать для приготовления пищи (варенья, компотов) наполовину испорченные фрукты, особенно яблоки: здоровая на вид часть плода может быть сильно заражена микотоксином. То же относится и к другим овощам и фруктам – если свекла, морковь или кабачок наполовину загнили, то их нельзя использовать в пищу. Если плоды испорчены незначительно, то их следует сильно обрезать, а не просто вычистить подгнившее, заплесневевшее место. Летом, во время затянувшихся дождей, в саду быстро портятся и плесневеют ягоды малины и ежевики, особенно перезрелые. Даже частично подплесневевшие или размягченные ягоды нельзя использовать в пищу или для варки компотов или варенья – микотоксины находятся не только там, где плесень и гниль, а во всей ягоде. Отсутствие микотоксинов в пищевых продуктах является одним из показателей их безопасности.
Классифицируются микотоксикозы по преимущественному поражению тех или иных органов или систем. Так, к нейротоксикозам относят эрготизм (Claviceps puгрurea ), микотоксикозы, сопровождающиеся тремором (Aspergillus fumigatus и др.), сердечную форму бери-бери связывают с действием цитреовиридина (Penicillium citrеo-viride ). Гепатоксикозы включают преимущественно довольно редкие случаи острых афлатоксикозов (Asp.flavus , Asp.parasiticus ), синдром Рейя, циррозы печени, которые, как считают, вызываются циклохлоротином (P.islandicum ). К нефротоксикозам относят Балканскую нефропатию, в этиологии которой прослеживается связь с охратоксином А (Asp.ochraceus ). К токсикозам с преимущественным поражением желудочно-кишечного тракта и кроветворных органов относят алиментарную токсическую алейкию (АТА), причинным агентом которой являются главным образом токсины Fusarium sporotrichiella . Самостоятельный тип составляют дерматоксикозы и респираторные микотоксикозы (Stachybotrys chartarum , Dendrodochium toxicum , Myrothecium verrucaria и др.). Предполагают, что зеараленон (F-2 токсин), обладающий эстрогенным эффектом, может быть причиной наблюдавшихся случаев раннего полового созревания и изменения вторичных половых признаков (F.graminearum ).
Некоторые формы рака (первичный рак печени, легких, пищевода) также могут быть связаны с наличием микотоксинов в пищевых продуктах.
Существующие классификации микотоксинов основаны преимущественно на их химической природе. Среди микотоксинов встречаются не только вещества белковой природы, а и глюкозиды, стероиды, поликетиды, сесквитерпеноиды, различные гетероциклы, полисахариды, органические кислоты, макролидные структуры и т. п. Многообразие химических структур микотоксинов затрудняет оценку путей их биогенеза. Однако при более детальном рассмотрении оказывается, что они синтезируются из довольно ограниченного числа продуктов основного метаболизма, таких как ацетат, мевалонат, некоторые аминокислоты путем конденсации, окисления, восстановления, алкилирования, циклизации. В настоящее время хорошо изучено 5 основных путей биосинтеза микотоксинов:
Поликетидный, характерный для афлатоксинов, стеригматоцистина, патулина и др.;
Терпеноидный, характерный для обширной группы трихотеценовых микотоксинов;
Через цикл трикарбоновых кислот, характерный для рубратоксинов;
Аминокислотный, характерный для эргоалкалоидов, споридесмина и др.
Смешанный
путь, характерный для производных циклопиазоновой кислоты.
Характерной особенностью
продуцентов микотоксинов является их способность синтезировать семейства
микотоксинов. Эта особенность хотя и не является для них уникальной, поскольку
широко распространена среди микроорганизмов, образующих антибиотики, до
настоящего времени не нашла убедительного объяснения. Образование семейств
микотоксинов, незначительно различающихся по строению и физико-химическим
свойствам, определяет исключительную сложность выделения многих их них.
Для здоровья человека один из наиболее опасных токсинов – афлатоксин. Потребление пищевых продуктов, содержащих 1,7 мг/кг афлатоксина, за короткий период времени может привести к необратимым повреждениям в печени, а 75 мг/кг – к смерти.
Пораженная афлатоксином пища ассоциируется с синдромом Рейа или оспой, которая поражает детей. Симптомы: рвота, конвульсии и кома. Смертность может достигать 80%. Некоторые исследователи связывают гепатит B с афлатоксином, предположительно изменяющим генетическую структуру ДНК, в результате чего вирус гепатита поражает клетку.
Болезнь Кашин-Бека и алиментарная токсическая алеукия – прямое следствие потребления пищи, содержащей фузариотоксины. Первая была впервые описана в восточной части России более 150 лет назад. Причина этой болезни – грибки, растущие на пшенице. Симптомы включают хрупкость костей и двухсторонний деформирующий остеоартроз.
Основные источники опасных для человека микотоксинов – зерновые культуры (кукуруза, пшеница, рис), арахис и другие культуры. Однако микотоксины могут также переходить в продукты животного происхождения.
Для предупреждения контаминации пищевых продуктов микотоксинами необходимо соблюдать правила агротехники. Важным является возделывание устойчивых и аклиматизированных сортов, обработка семян и посевов фунгицидами, севооборот, своевременная уборка зерна и семян при полном созревании, немедленная сушка зерна до степени, безопасной для хранения, и дальнейшее поддержание этой влажности. В случае невозможности быстрого просушивания зерна рекомендуется охлаждение его с помощью активного вентилирования в кратчайшие сроки, удаление из массы недозрелых, дробленных семян, сорняков. Важное значение имеет постоянный контроль влажности и температуры при хранении, широкое использование инсектицидов для подготовки помещений, предупреждения загрязнения насекомыми и борьба с ними при хранении. Хранение продуктов рекомендуется в сухом, охлажденном состоянии без доступа воздуха.
Микотоксины и методы их определения
Микотоксины (от греч. mykes - гриб и toxikon - яд) - это вторичные метаболиты микроскопических плесневых грибов, обладающие выраженными токсическими свойствами. Высокая опасность микотоксинов выражается в том, что они обладают токсическим эффектом в чрезвычайно малых количествах и способны весьма интенсивно диффундировать в глубь продукта.
Афлатоксины являются представителями наиболее опасной группы микотоксинов, обладающих сильными гепатотоксилескими и канцерогенными свойствами. Продуцентами афлатоксинов являются различные штаммы только двух видов аспергилл (Aspergillus flavus и Aspergillus parasiticus), которые широко распространены во всем мире. Следует отметить, что токсигенные грибы могут поражать растительные субстраты не только во время хранения, но и в процессе их роста, сбора урожая, транспортирования и переработки.
Семейство афлатоксинов включает четыре основных представителя (афлатоксины В 1 , В 2 , G 1 , G 2), а также более 10 соединений, являющихся производными или метаболитами основной группы (М 1 , М 2 , В 2а, G 2а, GM 1 , Р 1 , Q 1 и др.).
В природных условиях чаще и в наибольших количествах афлатоксины обнаруживаются в арахисе, кукурузе, семенах хлопчатника. Кроме того, в значительных количествах они могут накапливаться в различных орехах, семенах масличных культур, пшенице, ячмене, зернах какао и кофе, а также в кормах для сельскохозяйственных животных.
Следует отметить возможность появления афлатоксинов в продуктах животного происхождения: в молоке, тканях и органах животных, получавших корм, загрязненный афлатоксинами в высоких концентрациях.
Доказано, что коровы экскретируют с молоком от 0,35 до 2-3 % полученного с кормом афлатоксина В 1 в виде высокотоксичного метаболита - афлатоксина М 1 При этом пастеризация молока и процесс высушивания не оказывают существенного влияния на содержание в нем афлатоксина М 1 . Афлатоксин М 1 был обнаружен как в цельном, так и в сухом молоке и даже в молочных продуктах, подвергшихся технологической обработке (пастеризация, стерилизация, приготовление творога, йогурта, сыров и т. п.). Так, в процессе получения сыра из контаминированного молока 50 % афлатоксина М 1 определяется в творожной массе. При получении масла 10 % афлатоксина М 1 переходит в сливки, 75 % остается в снятом молоке.
Афлатоксины слабо растворимы в воде, нерастворимы в неполярных растворителях, но легко растворимы в растворителях средней полярности, таких как хлороформ, метанол и диметилсульфоксид. Они достаточно нестабильны в химически чистом виде и чувствительны к воздействию воздуха и света.
Афлатоксины практически не разрушаются при ооычнои кулинарной оораоотке кон-таминированных пищевых продуктов.
Трихотеценовые микотоксины являются вторичными метаболитами микроскопических грибов рода Fusarium, которые поражают корма и пищевые продукты, вследствие чего у животных и человека возникает алиментарный токсикоз. Чаще всего они обнаруживаются в зерне кукурузы, пшеницы и ячменя. Микотоксины этой группы отличаются повсеместным распространением, особенно в странах с умеренным континентальным климатом. Нередко в одном и том же продукте обнаруживают два или более микотоксинов. При проведении обязательной сертификации предусмотрен контроль за содержанием двух представителей этой грутпты, а именно нормируются дезоксиниваленол и Т-2 токсин.
Дезоксиниваленол (ДОН) - один из распространенных фузариотоксинов - подавляет синтез белка, снижает концентрацию итгуногаобулинов в сыворотке крови, может подавлять ре1фодуктивную систему. Особенно опасным является загрязнение кормов для сельскохозяйственных животных. Так, ДОН вызывает у животных рвоту, снижает потребление корма у поросят. Т-2 токсин распространен менее широко, но более токсичен, чем ДОН. Т-2 токсин вызывает раздражение, кровоизлияния и некроз в пищеварительном тракте. Острая интоксикация трихотеценами сопровождается поражением органов кроветворения и иммуно-компетентных органов. Характерны развитие геморрагического синдрома, отказ от корма, рвота.
Зеараленон и его производные также продуцируются микроскопическими грибами рода Fusarium. Основным природным субстратом, в котором наиболее часто обнаруживается зеараленон, является кукуруза. Грибы рода Fusariurn gra-minearum часто поражают кукурузу в поле на корню и являются причиной гнили початков и стеблей. Контаминация кукурузы зеараленоном может происходить и при хранении. Высока частота обнаружения зеараленона в комбикормах, а также в пшенице, ячмене и овсе. Среди пищевых продуктов этот токсин был обнаружен в кукурузной муке, хлопьях и кукурузном пиве.
Зеараленон обладает выраженным эстрогенным и тератогенным действием и представляет серьезную проблему для животноводства во многих странах, а способность этого микотоксина накапливаться в тканях сельскохозяйственных животных делает его потенциально опасным для здоровья человека. Загрязнение кормов зеараленоном вызывает снижение плодовитости, аборты, бесплодие и воспалительные заболевания у свиней, коров, домашней птицы и кроликов. Несмотря на это, некоторые производные зеараленона до последнего времени использовались в качестве стимуляторов роста животных и достаточно широко производились промышленностью.

Патулин - особо опасный микотоксин, обладающий канцерогенными и мутагенными свойствами. Основными продуцентами патулина являются микроскопические грибы Penicillium patulum и Penicillium expansum. Продуценты патулина поражают в основном фрукты и некоторые овощи, вызывая их гниение. Патулин обнаружен в яблоках, грушах, абрикосах, персиках, вишне, винограде, бананах, клубнике, голубике, бруснике, облепихе, айве, томатах. Наиболее часто патулином поражаются яблоки, где содержание токсина может доходить до 17,5 мг/кг. Следует отметить, что патулин обнаруживают не только в подгнившей части фруктов и овощей, но и в нормальной. Например, в томатах патулин распределяется равномерно по всей ткани.
Патулин в высоких концентрациях обнаруживается и в продуктах переработки фруктов и овощей: соках, компотах, mope и джемах. Особенно часто его находят в яблочном соке (0,02-0,4 мг/л). Содержание патулина в других видах соков: грушевом, айвовом, виноградном, сливовом, манго - колеблется от 0,005 до 4,5 мг/л.
Контроль за содержанием микотоксинов является обязательным при проведении сертификации продовольственного сырья и пищевых продуктов. В России приняты санитарно-гигиенические нормативы по содержанию микотоксинов в продуктах питания, приведенные в табл. 12.
Система мер профилактики микотоксикозов включает санитарно-микологический анализ пищевых продуктов (рис. 13).
Таблица 12. Допустимые уровни содержания микотоксинов в отдельных группах пищевых продуктов

Кроме того, большое внимание уделяется изысканию способов деконтаминации и детоксикации сырья и пищевых продуктов, загрязнешгых микотоксинами. С этой целью используют механические, физические и химические методы:
1) механические - отделение загрязненного материала вручную или с помощью электронно-калориметрических сортировщиков;
2) физические термическая обработка, облучение ультрафиолетовой радиацией;
3) химические - обработка растворами окислителей, сильных кислот и оснований.
Однако применение механических и физических методов очистки не дает высокого эффекта, химические методы приводят к разрушению не только микотоксинов, но и полезных нутриентов, а также к нарушению их всасывания.

Рис. 12.Санитарно-микробиологический анализ пищевых продуктов
14.8.1 Методы определения микотоксинов
Современные методы обнаружения и определения содержания микотоксинов в пищевых продуктах и кормах включают скрининг-методы, количественные аналитические и биологические методы.
Скрипипг-методы отличаются быстротой и удобны для проведения серийных анализов, позволяют быстро и надежно разделять загрязненные и незагрязненные образцы. К числу скрининг-методов относятся методы тонкослойной хроматографии (ТСХ-методы), флуоресцентный метод определения зерна, загрязненного афлатоксинами.
Количественные аналитические методы определения микотоксинов представлены химическими, радиоиммунологическими и имлгуноферментны-ми методами. В настоящее время наиболее распространенными являются химические методы, включающие две стадии: стадию выделения и стадию количественного определения микотоксинов. Стадия выделения включает экстракцию (отделение микотоксина от субстрата) и очистку (отделение микотоксина от соединении с близкими физико-химическими характеристиками). Окончательное разделение и количественное определение микотоксинов проводится с помощью различных хроматографических методов. Универсалыгым методом определения всех видов микотоксинов является тонкослойная хроматография (ТСХ).
При отборе проб из партии продукта основной задачей является получение среднего образца или средней пробы, по концентрации микотоксинов являющейся представительной для всей партии (отобранные образцы должны характеризовать качество всей партии). Выполнение этой задачи зависит от природы и распределения микотоксинов, характеристики продукта (сырой, обработанный, сыпучий, жидкий, пастообразный и т. д.), способа подготовки образца. Например, загрязнение арахиса афлатоксинами имеет выраженный гетерогенный характер:
в отдельных зернах арахиса их содержание может колебаться от тысячных долей миллиграмма до десятков и более миллиграммов на 1 кг, т. е. различаться на 5-6 порядков. По этой причине вклад ошибки при отборе пробы в общую ошибку анализа при определении афлатоксинов в арахисе является основным и в ряде случаев может составлять более 90 %.
С точки зрения однородности загрязнения микотоксинами вес продукты можно разделить на две группы: 1) продукты с высокой степенью неоднородности (очищенный и неочищенный арахис, масличные семена, целые или грубомолотыс зерна, орехи); 2) продукты с однородным характером загрязнения (жидкости: молоко, растительные масла, соки, шоре; мука, размолотые шроты).
Для получения представительного среднего образца продуктов 1-й группы размер исходного образца должен быть максимально возможным (не менее 2 кг), при этом средний лабораторный образец следует выделять из перемолотого (гомогенизированного) среднего образца.
Для однородных продуктов 2-й группы (джем, повидло, фруктовые соки в мелкой жестяной таре, сгущенное молоко, сухие молочные продукты и др.) пробы следует отбирать в количестве единиц упаковки, соответствующих величине среднего образца (100 200 г), при условии, что продукт происходит из одной партии.
Химические методы обнаружения и идентификации отдельных афлатоксинов основаны на их специфической флуоресценции в УФ-свете (около 365 нм), на различиях в подвижности при тонкослойной хроматографии, на специфичности их спектров поглощения и флуоресценции.
В отличие от афлатоксинов трихотецены не обладают поглощением или флуоресценцией в видимой части спектра, что затрудняет их обнаружение при тонкослойной хроматографии. Однако выявить трихотецены с помощью ТСХ возможно при использовании методов, основанных на обработке ТСХ-пластин специальными реагентами, которые образуют с трихотеценами окрашенные или флуоресцирующие производные. Например, Т-2 токсин при обработке пластин концентрированной серной кислотой образует пятна с голубой флуоресценцией в УФ-свете.
Арбитражными методами количественного определения микотоксинов являются следующие:
Газожидкостная хроматография (для Т-2 токсина);
Высокоэффективная жидкостная хроматография (ВЭЖХ) с использованием УФ-фотомстрического детектора (для дезоксиниваленола и патулина);
ВЭЖХ с использованием флуоресцентного детектора (для афлатоксипов и зеараленона).
Для анализа микотоксинов чаще применяются градиентные системы ВЭЖХ, где в качестве подвижной фазы используются растворы ацетонитрила в воде с линейно изменяющейся во времени концентрацией.
Хроматографическая колонка представляет собой металлическую трубку длиной от 150 до 250 мм с внутренним диаметром 4,6 мм, заполненную специальным сорбентом на основе силикагеля с привитыми углеводородными радикалами. Предколонка служит для защиты хроматографической колонки от загрязнений.
УФ-фотомеорический детектор является наиболее распространенным видом детекторов для ВЭЖХ. Принцип действия детектора аналогичен принципу действия обычного спектлзофотометра: он регистрирует оптическую плотность раствора. Различие состоит в том, что УФ-детектор является проточным, вместо кюветы с раствором в нем используется фотометрическая ячейка. Поток элюен-та протекает через рабочую ячейку, а через сравнительную ячейку направляется поток чистой подвижной фазы. Источником света служит ртутная лампа, дающая интенсивное УФ-излучение. Свет с нужной длиной волны выделяется с помощью подходящих оптических фильтров, проходит через ячейки, частично поглощается молекулами подвижной фазы и разделяемых компонентов и улавливается фотоприемником. Светопоглощение (оптическую плотность) элюата непрерывно регистрирует самописец или компьютер, записывая хроматограмму. Разделяемые компоненты смеси (например, микотоксины) представлены на хроматограмме в виде пиков. Положение пика на хроматограмме используют для идентификации вещества, а площадь пика - для количественного определения.
Более сложное устройство представляет собой флуоресцентный (флуориметрический) детектор. Такой детектор использует способность органических соединений, в частности афлатоксинов и зеараленона, флуоресцировать под действием УФ- или видимого излучения. Флуоресцентный детектор имеет проточную ячейку с двумя взаимно перпендикулярными оптическими каналами. Один из них служит для подвода возбуждающего излучения, другой позволяет измерять интенсивность флуоресценции. В случае анализа афлатоксинов В 1 и М 1 длина волны возбуждающего излучения составляет 360 нм, а длина волны испускаемого излучения - 420 нм.
Следует отметить, что для анализа афлатоксинов можно применять также УФ-детектор, однако его чувствительность на порядок ниже, чем у флуоримет-рического детектора, поэтому при анализе низких концентраций афлатоксинов (на уровне ПДК и ниже) предпочтительным является флуоресцентное детектирование.
Читайте также...
- Курсовая работа: Колебательные химические реакции Исследования концентрационных колебаний до открытия реакции Белоусовым
- Английские слова для изучения на каждый день: полезная лексика и советы для запоминания
- Публичное выступление: интересные примеры
- Сетевая викторина «Когда Россия молодая мужала с гением Петра