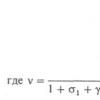Сложные неорганические вещества можно классифицировать по четырем. Основные классы неорганических соединений. основные
амфотерные
кислотные
Философская истина: все в нашем мире относительно, – справедлива и для классификации веществ и их свойств. Великое многообразие веществ во Вселеннойи на нашей планете состоит всего лишь из 90 химических элементов. В природе встречаются вещества, построенные элементами с порядковыми номерами с 1 по 91 включительно. Элемент 43 – технеций, в настоящее время на Земле в природе не обнаружен, т.к. этот элемент не имеет стабильных изотопов. Он был получен искусственно в результате ядерной реакции. Отсюда и название элемента – от греч. téhnos – искусственный.
Все земные природные химические вещества, построенные из 90 элементов, можно разделить на два больших типа – неорганические и органические.
Органическими веществами называют соединения углерода за исключением простейших: оксидов углерода, карбидов металлов, угольной кислоты и ее солей. Все остальные вещества относятся к неорганическим.
Органических веществ насчитывается более 27 млн – гораздо больше, чем неорганических, число которых по самым оптимистическим подсчетам не превышает 400 тыс. О причинах многообразия органических соединений мы поговорим чуть позже, а пока отметим, что резкой границы между двумя этими группами веществ не существует. Например, соль изоцианат аммония NH4NCO считается неорганическим соединением, а мочевина (NH2)2CO, имеющая точно такой же элементный состав N2H4CO, – вещество органическое.
Вещества, имеющие одинаковую молекулярную формулу, но разное химическое строение, называются изомерами.
Неорганические вещества принято делить на два подтипа – простые и сложные (схема 1). Как вы уже знаете, простыми называют вещества, состоящие из атомов одного химического элемента, а сложные – из двух и более химических элементов.
Схема 1
Классификация неорганических веществ
Казалось бы, число простых веществ должно совпадать с числом химических элементов. Однако это не так. Дело в том, что атомы одного и того же химического элемента могут образовывать не одно, а несколько различных простых веществ. Такое явление, как вы знаете, называют аллотропией. Причинами аллотропии может быть разное число атомов в молекуле (например, аллотропные модификации элемента кислорода – кислород О2 и озон О3), а также различное строение кристаллической решетки твердого вещества (например, уже знакомые вам аллотропные видоизменения углерода – алмаз и графит).
В подтипе простых веществ выделяют металлы, неметаллы и благородные газы, причем последние часто относят к неметаллам. В основе такой классификации лежат свойства простых веществ, обусловленные строением атомов химических элементов, из которых эти вещества образованы, и типом кристаллической решетки. Всем известно, что металлы проводят электрический ток, теплопроводны, пластичны, обладают металлическим блеском. Неметаллы, как правило, такими свойствами не обладают. Наша оговорка «как правило» не случайна, и она еще раз подчеркивает относительность классификации простых веществ. Некоторые металлы по свойствам напоминают неметаллы (например, аллотропная модификация олова – серое олово – порошок серого цвета, не проводит электрический ток, лишено блеска и пластичности, тогда как белое олово, другая аллотропная модификация, – типичный металл). Напротив, неметалл графит, аллотропная модификация углерода, весьма электропроводен и обладает характерным металлическим блеском.
Самая общая классификация сложных неорганических веществ хорошо вам знакома из курса химии основной школы. Здесь выделяют четыре класса соединений: оксиды, основания, кислоты и соли.
Деление неорганических веществ на классы проводят на основании их состава, который, в свою очередь, отражается на свойствах соединений. Напомним определения представителей каждого класса.
Оксиды
– сложные вещества, состоящие из двух элементов, один из которых – кислород в степени окисления –2 (например, Н2О, СО2, CuO).
Основания
– это сложные вещества, состоящие из атома металла и одной или нескольких гидроксигрупп (например, NaOH, Ca(OH)2).
Кислоты
– это сложные вещества, состоящие из атомов водорода и кислотного остатка (например, HCl, HNO3, H2SO4, H3PO4).
Соли
– это сложные вещества, состоящие из атомов металла и кислотных остатков (например, NaNO3, K2SO4, AlCl3).
Подобная классификация и определения также весьма относительны. Во-первых, роль металла в основаниях и солях могут выполнять сложные частицы наподобие знакомоговам катиона аммония NH4+, состоящего только из элементов неметаллов. Во-вторых, существует достаточно многочисленная группа веществ, которые пформальным признакам (по составу) являются основаниями, а по свойствам относятся к амфотерным гидроксидам, т.е. сочетают свойства оснований и кислот. Например, гидроксид алюминия Al(OH)3 при взаимодействии с кислотой ведет себя как основание:
Al(OH)3 + 3HCl = AlCl3 + 3H2O,
а при сплавлении со щелочами проявляет свойства кислоты:
H3AlO3 + NaOH = NaAlO2 + H2O.
В-третьих, в приведенную выше классификацию сложных неорганических веществ не попадает большое число соединений, которые нельзя отнести ни к одному из перечисленных классов. Это, например, соединения, образованные двумя или более элементами-неметаллами (хлорид фосфора(V) PCl5, сульфид углерода CS2, фосген COCl2).
? 1. Какие вещества называются неорганическими, а какие – органическими? Приведите примеры. Докажите относительность такой классификации веществ.
2. Какие вещества называются простыми, а какие – сложными? Почему число простых веществ превышает число химических элементов?
3. Какова классификация простых веществ? Приведите примеры веществ каждого типа. Благородные газы являются веществами атомного или молекулярного строения? Приведите аргументы в пользу той и другой точек зрения.
4. Какие неорганические вещества называются оксидами, основаниями, кислотами, солями? Приведите примеры веществ каждого класса, проиллюстрируйте их свойства двумя-тремя уравнениями химических реакций.
5. С помощью уравнений химических реакций докажите, что амфотерные гидроксиды проявляют свойства как кислот, так и оснований.
6. Карбонат кальция (мел, мрамор, известняк) вдохновлял скульпторов, художников, поэтов. Например:
Классификация веществ
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, сложные – из двух и более элементов. Простые вещества разделяются на металлы и неметаллы.
Металлы имеют характерный «металлический» блеск, обладают ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
Сложные вещества делят на органические и неорганические (минеральные). Органическими принято называть соединения углерода, за исключением простейших соединений углерода (CO, CO 2 , H 2 CO 3 , HCN и их солей и др.); все остальные вещества называются неорганическими.
Сложные неорганические соединения классифицируются как по составу, так и по химическим свойствам (функциональным признакам). По составу они, прежде всего, подразделяются на двухэлементные, или бинарные, соединения (оксиды, сульфиды, галогениды, нитриды, карбиды, гидриды) и многоэлементные соединения; кислородсодержащие, азотсодержащие и т. п.
По химическим свойствам неорганические соединения подразделяются на четыре основных класса: оксиды, кислоты, основания, соли.
Оксиды
Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород (Cr 2 O 3 , K 2 O, CO 2 и т. д.). Кислород в оксидах всегда двухвалентен и имеет степень окисления, равную -2.
По химическим свойствам оксиды подразделяются на солеобразующие и несолеобразующие (безразличные: CO, NO, N 2 O). Солеобразующие оксиды подразделяются на основные, кислотные и амфотерные.
Основными называются оксиды, взаимодействующие с кислотами или кислотными оксидами, с образованием солей:
CuO + 2HCl=CuCl 2 + H 2 O,
MgO + CO 2 = MgCO 3 .
Образование основных оксидов характерно для металлов с невысокой степенью окисления (+1, +2).
Оксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных металлов (Ca, Sr, Ba, Ra) взаимодействуют с водой, образуя основания. Например:
Na 2 O + H 2 O = 2NaOH,
CaO + H 2 O = Ca(OH) 2 .
Большая часть основных оксидов с водой не взаимодействует. Основания таких оксидов получают косвенным путем:
a) CuO + 2HCl=CuCl 2 + H 2 O;
б) CuCl 2 + 2KOH = Cu(OH) 2 +2KCl.
Кислотными называются оксиды, взаимодействующие с основаниями или с основными оксидами с образованием солей. Например:
SO 3 + 2KOH = K 2 SO 4 + H 2 O,
CaO + CO 2 = CaCO 3 .
К кислотным оксидам относятся оксиды типичных неметаллов -SO 2 , N 2 O 5 , SiO 2 , CO 2 и др., а также оксиды металлов с высокой степенью окисления (+5,+6,+7, +8) -V 2 O 5 , CrO 3 , Mn 2 O 7 и др.
Ряд кислотных оксидов (SO 3 , SO 2 , N 2 O 3 , N 2 O 5 , CO 2 и др.) при взаимодействии с водой образуют кислоты:
SO 3 + H 2 O = H 2 SO 4 ,
N 2 O 5 + H 2 O = 2HNO 3 .
Соответствующие кислоты других кислотных оксидов (SiO 2 , TeO 2 , TeO 3 , MoO 3 , WO 3 , и др.) получают косвенным путем. Например:
а) SiO 2 + 2NaOH = Na 2 SiO 3 + H 2 O
б) Na 2 SiO 3 +2HCl= H 2 SiO 3 + 2NaCl
Один из способов получения кислотных оксидов – отнятие воды от соответствующих кислот. Поэтому кислотные оксиды иногда называют ангидридами кислот.
Амфотерными называют оксиды, образующие соли при взаимодействии, как с кислотами, так и с основаниями, т. е. обладающие двойственными свойствами – свойствами основных и кислотных оксидов. Например:
SnO + H 2 SO 4 = SnSO 4 + H 2 O,
SnO + 2KOH + H 2 O = K 2 ,
ZnO + 2KOH = K 2 ZnO 2 + H 2 O.
К числу амфотерных оксидов относятся: ZnO, BeO, SnO, PbO, Al 2 O 3 , Cr 2 O 3 , Fe 2 O 3 , Sb 2 O 3 , MnO 2 и др.
Следует отметить, что в соответствии с изменением химической природы элементов в периодической системе элементов (от металлов к неметаллам) закономерно изменяются и химические свойства соединений, в частности, кислотно-основная активность их оксидов. Так, в случае высших оксидов элементов 3 периода в ряду: Na 2 O, MgO, Al 2 O 3 , SiO 2 , P 2 O 5 , SO 3 , Cl 2 O 7 - по мере уменьшения степени полярности связи Э-О (уменьшается DЭО; уменьшается отрицательный эффективный заряд атома кислорода) ослабляются основные и нарастают кислотные свойства оксидов: Na 2 O, MgO - основные оксиды; Al 2 O 3 – амфотерный; SiO 2 , P 2 O 5 , SO 3 , Cl 2 O 7 - кислотные оксиды (слева направо кислотный характер оксидов усиливается).
Способы получения оксидов:
1. Взаимодействие простых веществ с кислородом (окисление):
4Fe + 3O 2 = 2Fe 2 O 3 ,
S + O 2 = SO 2 .
2. Горение сложных веществ:
CH 4 + 2O 2 = CO 2 + 2H 2 O,
2SO 2 + O 2 = 2SO 3 .
3. Термическое разложение солей, оснований, кислот:
CaCO 3 ® CaO + CO 2 ,
Cd(OH) 2 ® CdO + H 2 O,
H 2 SO 4 ® SO 3 + H 2 O.
Номенклатура оксидов. Названия оксидов строятся из слова “оксид” и названия элемента в родительном падеже, который соединен с атомами кислорода. Если элемент образует несколько оксидов, то в скобках римскими цифрами указывается его степень окисления (с.о.), при этом знак с. о. не указывается. Например, MnO 2 – оксид марганца (IV), MnO – оксид марганца (II). Если элемент образует один оксид, то его с. о. не приводится: Na 2 O – оксид натрия.
Иногда в названиях оксидов встречаются приставки ди-, три-, тетра- и т.д. Они обозначают, что в молекуле этого оксида на один атом элемента приходится 2,3,4 и т.д. атома кислорода, например, CO 2 – диоксид углерода и т.д.
Гидроксиды
Среди многоэлементных соединений важную группу составляют гидроксиды – сложные вещества, содержащие гидроксогруппы OH. Некоторые из них (основные гидроксиды) проявляют свойства оснований - NaOH, Ba(OH) 2 и т.п.; другие (кислотные гидроксиды) проявляют свойства кислот – HNO 3 , H 3 PO 4 , и др.; существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как основные, так и кислотные свойства - Zn(OH) 2 , Al(OH) 3 и др.
Свойства и характер гидроксидов также находятся в зависимости от заряда ядра центрального атома (условное обозначение Э) и его радиуса, т.е. от прочности и полярности связей Э – О и О – Н.
Если энергия связи E O - H << E Э - О, то диссоциация гидроксида протекает по кислотному типу, т. е. разрушается связь О – Н.
ЭОН Û ЭО - + H +
Если E O-H >> E Э – O , то диссоциация гидроксида протекает по основному типу, т. е. разрушается связь Э - O
ЭOH Û Э + + OH -
Если энергии связей O – H и Э – О близки или равны, то диссоциация гидроксида может протекать одновременно по обоим направлениям. В этом случае речь идет об амфотерных гидроксидах:
Э n+ + nOH - Û Э(OH) n = H n ЭO n Û nH + + ЭО n n-
В соответствии с изменением химической природы элементов в периодической системе элементов закономерно изменяется кислотно-основная активность их гидроксидов: от основных гидроксидов через амфотерные к кислотным. Например, для высших гидроксидов элементов 3 периода:
NaOH, Mg(OH) 2 – основания (слева направо основные свойства ослабевают);
Al(OH) 3 – амфотерный гидроксид;
H 2 SiO 3 , H 3 PO 4 , H 2 SO 4 , HСlO 4 – кислоты (слева направо сила кислот увеличивается).
Гидроксиды металлов относятся к основаниям. Чем ярче выражены металлические свойства элемента, тем сильнее выражены основные свойства соответствующего гидроксида металла в высшей с.о. Гидроксиды неметаллов проявляют кислотные свойства. Чем ярче выражены неметаллические свойства элемента, тем сильнее кислотные свойства соответствующего гидроксида.
Кислоты
Кислоты – это вещества, диссоциирующие в растворах с образованием катионов водорода и анионов кислотного остатка (с позиций теории электролитической диссоциации).
Кислоты классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по основности (по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли – на одноосновные, двухосновные, трехосновные), по наличию или отсутствию кислорода в составе кислоты (на кислородсодержащие и бескислородные). Например, азотная кислота HNO 3 – сильная, одноосновная, кислородсодержащая кислота; сероводородная кислота H 2 S – слабая, двухосновная, бескислородная кислота.
Химические свойства кислот:
1. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H 2 SO 4 + Cu (OH) 2 = CuSO 4 + 2H 2 O.
2. Взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
2HNO 3 + MgO = Mg(NO 3) 2 + H 2 O,
H 2 SO 4 + ZnO = ZnSO 4 + H 2 O.
3. Взаимодействие с металлами. Металлы, стоящие в “Ряду напряжений” до водорода, вытесняют водород из растворов кислот (кроме азотной и концентрированной серной кислот); при этом образуется соль:
Zn + 2HCl =ZnCl 2 + H 2 .
Металлы, находящиеся в “Ряду напряжений” после водорода, водород из растворов кислот не вытесняют
Взаимодействие металлов с азотной и концентрированной серной кислотами см. в разделе 11.
4. Некоторые кислоты при нагревании разлагаются:
H 2 SiO 3 H 2 O + SiO 2 .
5. Менее летучие кислоты вытесняют более летучие кислоты из их солей:
H 2 SO 4 конц + NaCl тв = NaHSO 4 + HCl.
6. Более сильные кислоты вытесняют менее сильные кислоты из растворов их солей:
2HCl + Na 2 CO 3 = 2NaCl + H 2 O + CO 2
Номенклатура кислот. Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например, CN – циан, CNS – родан) суффикс -о- , окончание водородная и слово “кислота”. Например, HCl – хлороводородная кислота, H 2 S – сероводородная кислота, HCN – циановодородная кислота.
Названия кислородосодержащих кислот также образуются от русского названия кислотообразующего элемента с добавлением соответствующих суффиксов, окончаний и слова “кислота”. При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на -ная или -овая ; например, H 2 SO 4 – серная кислота, HClO 4 – хлорная кислота, H 3 AsO 4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: -оватая (HClO 3 - хлорноватая кислота), истая (HClO 2 - хлористая кислота), -оватистая (HClO - хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающее более низкой степени окисления элемента, имеет окончание истая (HNO 3 – азотная кислота, HNO 2 – азотистая кислота).
В некоторых случаях к одной молекуле оксида может присоединиться различное количество молекул воды (т.е. элемент в одной и той же степени окисления образует несколько кислот, содержащих по одному атому данного элемента). Тогда кислоту с большим содержанием воды обозначают приставкой орто - , а кислоту с меньшим числом молекул воды обозначают приставкой мета - . Например:
P 2 O 5 + H 2 O = 2HPO 3 - метафосфорная кислота;
P 2 O 5 + 3H 2 O = 2H 3 PO 4 - ортофосфорная кислота.
Основания
Основаниями с позиций теории электролитической диссоциации являются вещества, диссоциирующие в растворах с образованием гидроксид - ионов OH ‾ и ионов металлов (исключение NH 4 OH).
Основания классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по кислотности (по количеству гидроксогрупп в молекуле, способных замещаться на кислотные остатки – на однокислотные, двукислотные и т. д.), по растворимости (на растворимые основания – щелочи и нерастворимые). Например: NaOH – сильное, однокислотное основание, растворимое (щелочь); Cu(OH) 2 – слабое, двукислотное, нерастворимое основание. К растворимым основаниям (щелочам) относятся гидроксиды щелочных и щелочноземельных металлов. К сильным основаниям относятся все щелочи.
Химические свойства оснований:
1. Взаимодействие с кислотами:
Ca(OH) 2 + H 2 SO 4 = CaSO 4 ¯ + H 2 O.
2. Взаимодействие с кислотными оксидами:
3. Взаимодействие с амфотерными оксидами:
2KOH + Al 2 O 3 = 2KAlO 2 + H 2 O 1,
2KOH + SnO + H 2 O = K 2 [ Sn(OH) 4 ].
4. Взаимодействие с амфотерными основаниями:
2NaOH + Zn(OH) 2 = Na 2 ZnO 2 +2H 2 O2,
2NaOH + Zn(OH) 2 = Na 2 [ Zn(OH) 4 ]3.
5. Термическое разложение оснований с образованием оксидов и воды:
Ca(OH) 2 = CaO + H 2 O.
Гидроксиды щелочных металлов при нагревании не распадаются.
6. Взаимодействие с амфотерными металлами (Zn, Al, Pb, Sn, Be):
Zn + 2NaOH + 2H 2 O = Na 2 + H 2
Амфотерные гидроксиды. Амфотерные гидроксиды (гидраты амфотерных оксидов) способны диссоциировать в водных растворах как по типу кислот, так и по типу оснований. Например:
ZnO 2 2- + 2H + Û Zn(OH) 2 Û Zn 2+ + 2OH .
Поэтому они обладают амфотерными свойствами, т.е. могут взаимодействовать как с кислотами, так и с основаниями:
Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O,
Sn(OH) 2 + 2NaOH = Na 2 [ Sn(OH) 4 ].
Номенклатура оснований. Названия оснований строятся из слова “гидроксид ” и названия металла в родительном падеже с указанием в скобках римскими цифрами его степени окисления, если это величина переменная. Иногда к слову гидроксид добавляют префикс из греческого числительного, указывающий на число гидроксогрупп в молекуле основания. Например: KOH - гидроксид калия; Al(OH) 3 - гидроксид алюминия (тригидроксид алюминия); Cr(OH) 2 – гидроксид хрома (II) (дигидроксид хрома).
Соли
С точки зрения теории электролитической диссоциации соли - это вещества, диссоциирующие в растворах или в расплавах с образованием положительно заряженных ионов, отличных от ионов водорода, и отрицательно заряженных ионов, отличных от гидроксид – ионов.
Соли рассматривают обычно как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками. При полном замещении получаются средние (или нормальные) соли, диссоциирующие в растворах или в расплавах с образованием катионов металлов и анионов кислотных остатков (исключение – соли аммония). При неполном замещении водорода кислоты получаются кислые соли, при неполном замещении гидроксогрупп основания – основные соли. Диссоциация кислых и основных солей рассматривается в разделе 8. Кислые соли могут быть образованы только многоосновными кислотами (H 2 SO 4 , H 2 SO 3 , H 2 S,H 3 PO 4 и т. д.), а основные соли – многокислотными основаниями (Mg (OH) 2 ,Ca (OH) 2 , Al (OH) 3 и т. д.).
Примеры образования солей:
Ca (OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O,
CaSO 4 (сульфат кальция) – нормальная (средняя) соль;
H 2 SO 4 + NaOH = NaHSO 4 + H 2 O,
NaHSO 4 (гидросульфат натрия) – кислая соль, полученная в результате недостатка взятого основания;
Cu (OH) 2 + HCl = CuOHCl + H 2 O,
CuOHCl (хлорид гидроксомеди (II)) – основная соль, полученная в результате недостатка взятой кислоты.
Химические свойства солей:
I. Соли вступают в реакции ионного обмена, если при этом образуется осадок, слабый электролит или выделяется газ:
с щелочами реагируют соли, катионам металлов которых соответствуют нерастворимые основания:
CuSO 4 + 2NaOH = Na 2 SO 4 + Cu (OH) 2 ↓;
с кислотами взаимодействуют соли:
а) катионы которых образуют с анионом новой кислоты нерастворимую соль:
BaCl 2 + H 2 SO 4 = BaSO 4 ↓ + 2HCl;
б) анионы которой отвечают неустойчивой угольной или какой-либо летучей кислоте (в последнем случае реакция проводится между твердой солью и концентрированной кислотой):
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ,
NaCl тв + H 2 SO 4конц = NaHSO 4 + HCl;
в) анионы которой отвечают малорастворимой кислоте:
Na 2 SiO 3 + 2HCl = H 2 SiO 3 ↓ + 2NaCl;
г) анионы которой отвечают слабой кислоте:
2CH 3 COONa + H 2 SO 4 = Na 2 SO 4 + 2CH 3 COOH;
cоли взаимодействуют между собой, если одна из образующихся новых солей нерастворима или разлагается (полностью гидролизуется) с выделением газа или осадка:
AgNO 3 + NaCl = NaNO 3 + AgCl↓,
2AlCl 3 + 3Na 2 CO 3 + 3H 2 O = 2Al (OH) 3 ↓ + 6NaCl + 3CO 2 .
II. Соли могут вступать во взаимодействие с металлами, если металл, которому соответствует катион соли, находится в“Ряду напряжений “правее реагирующего свободного металла (более активный металл вытесняет менее активный металл из раствора его соли):
Zn + CuSO 4 = ZnSO 4 + Cu.
III. Некоторые соли разлагаются при нагревании:
CaCO 3 = CaO + CO 2 .
IV. Некоторые соли способны реагировать с водой и образовывать кристаллогидраты:
CuSO 4 + 5H 2 O = CuSO 4 ٭ 5H 2 O ΔH<0
белого цвета сине-голубого цвета
Выделение теплоты и изменение цвета – признаки химических реакций.
V. Соли подвергаются гидролизу. Подробно этот процесс будет описан в разделе 8.10.
VI. Химические свойства кислых и основных солей отличаются от свойств средних солей тем, что кислые соли вступают также во все реакции, характерные для кислот, а основные соли вступают во все реакции, характерные для оснований. Например:
NaHSO 4 + NaOH= Na 2 SO 4 + H 2 O,
MgOHCl + HCl = MgCl 2 + H 2 O.
Получение солей:
1. Взаимодействие основного оксида с кислотой:
CuO + H 2 SO 4 = CuSO 4 + H 2 O.
2. Взаимодействие металла с солью другого металла:
Mg + ZnCl 2 = MgCl 2 + Zn.
3. Взаимодействие металла с кислотой:
Mg + 2HCl = MgCl 2 + H 2 .
4. Взаимодействие основания с кислотным оксидом:
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O.
5. Взаимодействие основания с кислотой:
Fe(OH) 3 + 3HCl= FeCl 3 + 3H 2 O.
6. Взаимодействие соли с основанием:
FeCl 2 + 2KOH = Fe(OH) 2 ¯ + 2KCl.
7. Взаимодействие двух солей:
Ba(NO 3) 2 + K 2 SO 4 = BaSO 4 ¯ + 2KNO 3 .
8. Взаимодействие металла с неметаллом:
9. Взаимодействие кислоты с солью:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 .
10. Взаимодействие кислотного и основного оксидов:
CaO + CO 2 = CaCO 3 .
Номенклатура солей. Согласно международным номенклатурным правилам, названия средних солей образуются из названия кислотного остатка в именительном падеже и названия металла в родительном падеже с указанием в скобках римскими цифрами его степени окисления (если это величина переменная). Название кислотного остатка состоит из корня латинского наименования кислотообразующего элемента, соответствующего окончанияи в некоторых случаях приставки.
Кислотные остатки бескислородных кислот получают окончание ид . Например: SnS – сульфид олова (II), Na 2 Se – селенид натрия. Окончания названий кислотных остатков кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента. Для высшей его степени окисления (“-ная “ или “-овая “ кислота) применяется окончание -ат . Например, соли азотной кислоты HNO 3 называются нитратами, серной кислоты H 2 SO 4 - сульфатами, хромовой кислоты H 2 CrO 4 – хроматами. Для более низкой степени окисления кислотообразующего элемента (“...истая кислота “) применяется окончание ит. Так, соли азотистой кислоты HNO 2 называются нитритами, сернистой кислоты H 2 SO 3 – сульфитами. Если существует кислота с еще более низкой степенью окисления кислотообразующего элемента (“-оватистая кислота “), ее анион получает приставку гипо- и окончание -ит . Например, соли хлорноватистой кислоты HClО называют гипохлоритами.
Соли некоторых кислот в соответствии с исторически сложившейся традицией сохранили названия, отличающиеся от систематических. Так, соли марганцовой кислоты HMnO 4 называют перманганатами, хлорной кислоты HClO 4 – перхлоратами, йодной кислоты HIO 4 – периодатами. Соли марганцовистой кислоты H 2 MnO 4 , хлорноватой HClO 3 и йодноватой HIO 3 кислот называют соответственно манганатами, хлоратами и йодатами.
Названия кислых и основных солей образуются по тем же общим правилам, что и названия средних солей. При этом название аниона кислой соли снабжают приставкой гидро-, указывающей на наличие незамещенных атомов водорода; количество незамещенных атомов водорода указывают греческими числительными приставками. Например, Na 2 HPO 4 – гидроортофосфат натрия, NaH 2 PO 4 – дигидроортофосфат натрия.
Аналогично катион основной соли получает приставку гидроксо- , указывающую на наличие незамещенных гидроксогрупп. Число гидроксильных групп указывают греческим числительным. Например, Cr(OH) 2 NO 3 – нитрат дигидроксохрома (III).
Названия важнейших кислот и их кислотных остатков приведены табл. 4.1.
Таблица 4.1
Названия и формулы кислот и их кислотных остатков
Продолжение табл. 4.1
В настоящее время известно более 118 химических элементов: по различным источникам, в природе встречаются от 88 до 94. Химические элементы образуют огромное количество неорганических соединений. Хотя каждому соединению присущи свои особенности, свои специфические свойства, имеется целый ряд веществ с некоторыми сходными, общими свойствами. Исходя из общности свойств, соединения объединяют в группы, классы, то есть классифицируют их, что облегчает изучение многообразия веществ.
Вспомним, что, исходя их состава молекул, вещества делятся на простые и сложные.
Простые вещества – вещества, молекулы которых состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения) – вещества, молекулы которых состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Простые вещества разбиваются на две большие группы: металлы и неметаллы.
Металлы – группа элементов, обладающая характернымиметаллическими свойствами: твёрдые вещества (исключение составляет ртуть) имеют металлический блеск, являются хорошими проводниками теплоты и электричества, ковкие (железо (Fe), медь (Cu), алюминий (Al), ртуть (Hg), золото (Au), серебро (Ag) и др.).
Неметаллы – группа элементов: твёрдые, жидкие (бром) и газообразные веществ, которые не обладают металлическим блеском, являются изоляторы, хрупкие.
 А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
А сложные вещества в свою очередь подразделятся на четыре группы, или класса: оксиды, основания, кислоты и соли.
Оксиды – это сложные вещества, в состав молекул которых входят атомы кислорода и какого – нибудь другого вещества.
Основания – это сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами.
С точки зрения теории электролитической диссоциации, основания – сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH 4 +) и гидроксид – анионы OH - .
Кислоты – это сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла.
Соли – это сложные вещества, молекулы которых состоят из атомов металлов и кислотных остатков. Соль представляет собой продукт частичного или полного замещения атомов водорода кислоты металлом.
Остались вопросы? Хотите знать больше о классификации неорганических соединений?
Чтобы получить помощь репетитора – зарегистрируйтесь .
Первый урок – бесплатно!
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Классификация неорганических веществ с примерами соединений
Теперь проанализируем представленную выше классификационную схему более детально.
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные :
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H 2 , кислород O 2 , железо Fe, углерод С и т.д.
Среди простых веществ различают металлы , неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O 2 и O 3 . Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O 3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Сложные вещества
Сложными веществами называют вещества, образованные атомами двух или более химических элементов.
Так, например, сложными веществами являются аммиак NH 3 , серная кислота H 2 SO 4 , гашеная известь Ca(OH) 2 и бесчисленное множество других.
Среди сложных неорганических веществ выделяют 5 основных классов, а именно оксиды, основания, амфотерные гидроксиды, кислоты и соли:
Оксиды — сложные вещества, образованные двумя химическими элементами, один из которых кислород в степени окисления -2.
Общая формула оксидов может быть записана как Э x O y , где Э — символ какого-либо химического элемента.
Номенклатура оксидов
Название оксида химического элемента строится по принципу:
Например:
Fe 2 O 3 — оксид железа (III); CuO — оксид меди (II); N 2 O 5 — оксид азота (V)
Нередко можно встретить информацию о том, что в скобках указывается валентность элемента, однако же это не так. Так, например, степень окисления азота N 2 O 5 равна +5, а валентность, как это ни странно, равна четырем.
В случае, если химический элемент имеет единственную положительную степень окисления в соединениях, в таком случае степень окисления не указывается. Например:
Na 2 O — оксид натрия; H 2 O — оксид водорода; ZnO — оксид цинка.
Классификация оксидов
Оксиды по их способности образовывать соли при взаимодействии с кислотами или основаниями подразделяют соответственно на солеобразующие и несолеобразующие .
Несолеобразующих оксидов немного, все они образованы неметаллами в степени окисления +1 и +2. Список несолеобразующих оксидов следует запомнить: CO, SiO, N 2 O, NO.
Солеобразующие оксиды в свою очередь подразделяются на основные , кислотные и амфотерные .
Основными оксидами называют такие оксиды, которые при взаимодействии с кислотами (или кислотными оксидами) образуют соли. К основным оксидам относят оксиды металлов в степени окисления +1 и +2, за исключением оксидов BeO, ZnO, SnO, PbO.
Кислотными оксидами называют такие оксиды, которые при взаимодействии с основаниями (или основными оксидами) образуют соли. Кислотными оксидами являются практически все оксиды неметаллов за исключением несолеобразующих CO, NO, N 2 O, SiO, а также все оксиды металлов в высоких степенях окисления (+5, +6 и +7).
Амфотерными оксидами называют оксиды, которые могут реагировать как с кислотами, так и основаниями, и в результате этих реакций образуют соли. Такие оксиды проявляют двойственную кислотно-основную природу, то есть могут проявлять свойства как кислотных, так и основных оксидов. К амфотерным оксидам относятся оксиды металлов в степенях окисления +3, +4, а также в качестве исключений оксиды BeO, ZnO, SnO, PbO.
Некоторые металлы могут образовывать все три вида солеобразующих оксидов. Например, хром образует основный оксид CrO, амфотерный оксид Cr 2 O 3 и кислотный оксид CrO 3 .
Как можно видеть, кислотно-основные свойства оксидов металлов напрямую зависят от степени окисления металла в оксиде: чем больше степень окисления, тем сильнее выражены кислотные свойства.
Основания
Основания — соединения с формулой вида Me(OH) x , где x чаще всего равен 1 или 2.
Исключения: Be(OH) 2 , Zn(OH) 2 , Sn(OH) 2 и Pb(OH) 2 не относятся к основаниям, несмотря на степень окисления металла +2. Данные соединения являются амфотерными гидроксидами, которые еще будут рассмотрены в этой главе более подробно.
Классификация оснований
Основания классифицируют по количеству гидроксогрупп в одной структурной единице.
Основания с одной гидроксогруппой, т.е. вида MeOH, называют однокислотными основаниями, с двумя гидроксогруппами, т.е. вида Me(OH) 2 , соответственно, двухкислотными и т.д.
Также основания подразделяют на растворимые (щелочи) и нерастворимые.
К щелочам относятся исключительно гидроксиды щелочных и щелочно-земельных металлов, а также гидроксид таллия TlOH.
Номенклатура оснований
Название основания строится по нижеследующему принципу:
Например:
Fe(OH) 2 — гидроксид железа (II),
Cu(OH) 2 — гидроксид меди (II).
В тех случаях, когда металл в сложных веществах имеет постоянную степень окисления, указывать её не требуется. Например:
NaOH — гидроксид натрия,
Ca(OH) 2 — гидроксид кальция и т.д.
Кислоты
Кислоты — сложные вещества, молекулы которых содержат атомы водорода, способные замещаться на металл.
Общая формула кислот может быть записана как H x A, где H — атомы водорода, способные замещаться на металл, а A — кислотный остаток.
Например, к кислотам относятся такие соединения, как H 2 SO 4 , HCl, HNO 3 , HNO 2 и т.д.
Классификация кислот
По количеству атомов водорода, способных замещаться на металл, кислоты делятся на:
— одноосновные кислоты : HF, HCl, HBr, HI, HNO 3 ;
— двухосновные кислоты : H 2 SO 4 , H 2 SO 3 , H 2 CO 3 ;
— трехосновные кислоты : H 3 PO 4 , H 3 BO 3 .
Следует отметить, что количество атомов водорода в случае органических кислот чаще всего не отражает их основность. Например, уксусная кислота с формулой CH 3 COOH, несмотря на наличие 4-х атомов водорода в молекуле, является не четырех-, а одноосновной. Основность органических кислот определяется количеством карбоксильных групп (-COOH) в молекуле.
Также по наличию кислорода в молекулах кислоты подразделяют на бескислородные (HF, HCl, HBr и т.д.) и кислородсодержащие (H 2 SO 4 , HNO 3 , H 3 PO 4 и т.д.). Кислородсодержащие кислоты называют также оксокислотами .
Более детально про классификацию кислот можно почитать .
Номенклатура кислот и кислотных остатков
Нижеследующий список названий и формул кислот и кислотных остатков обязательно следует выучить.
В некоторых случаях облегчить запоминание может ряд следующих правил.
Как можно видеть из таблицы выше, построение систематических названий бескислородных кислот выглядит следующим образом:
Например:
HF — фтороводородная кислота;
HCl — хлороводородная кислота;
H 2 S — сероводородная кислота.
Названия кислотных остатков бескислородных кислот строятся по принципу:
Например, Cl — — хлорид, Br — — бромид.
Названия кислородсодержащих кислот получают добавлением к названию кислотообразующего элемента различных суффиксов и окончаний. Например, если кислотообразующий элемент в кислородсодержащей кислоте имеет высшую степень окисления, то название такой кислоты строится следующим образом:
Например, серная кислота H 2 S +6 O 4 , хромовая кислота H 2 Cr +6 O 4 .
Все кислородсодержащие кислоты могут быть также классифицированы как кислотные гидроксиды, поскольку в их молекулах обнаруживаются гидроксогруппы (OH). Например, это видно из нижеследующих графических формул некоторых кислородсодержащих кислот:
Таким образом, серная кислота иначе может быть названа как гидроксид серы (VI), азотная кислота — гидроксид азота (V), фосфорная кислота — гидроксид фосфора (V) и т.д. При этом число в скобках характеризует степень окисления кислотообразующего элемента. Такой вариант названий кислородсодержащих кислот многим может показаться крайне непривычным, однако же изредка такие названия можно встретить в реальных КИМах ЕГЭ по химии в заданиях на классификацию неорганических веществ.
Амфотерные гидроксиды
Амфотерные гидроксиды — гидроксиды металлов, проявляющие двойственную природу, т.е. способные проявлять как свойства кислот, так и свойства оснований.
Амфотерными являются гидроксиды металлов в степенях окисления +3 и +4 (как и оксиды).
Также в качестве исключений к амфотерным гидроксидам относят соединения Be(OH) 2 , Zn(OH) 2 , Sn(OH) 2 и Pb(OH) 2 , несмотря на степень окисления металла в них +2.
Для амфотерных гидроксидов трех- и четырехвалентных металлов возможно существование орто- и мета-форм, отличающихся друг от друга на одну молекулу воды. Например, гидроксид алюминия (III) может существовать в орто-форме Al(OH) 3 или мета-форме AlO(OH) (метагидроксид).
Поскольку, как уже было сказано, амфотерные гидроксиды проявляют как свойства кислот, так и свойства оснований, их формула и название также могут быть записаны по-разному: либо как у основания, либо как у кислоты. Например:
Соли
Соли — это сложные вещества, в состав которых входят катионы металлов и анионы кислотных остатков.
Так, например, к солям относятся такие соединения как KCl, Ca(NO 3) 2 , NaHCO 3 и т.д.
Представленное выше определение описывает состав большинства солей, однако же существуют соли, не попадающие под него. Например, вместо катионов металлов в состав соли могут входить катионы аммония или его органические производные. Т.е. к солям относятся такие соединения, как, например, (NH 4) 2 SO 4 (сульфат аммония), + Cl — (хлорид метиламмония) и т.д.
Также противоречат определению солей выше класс так называемых комплексных солей, которые будут рассмотрены в конце данной темы.
Классификация солей
С другой стороны, соли можно рассматривать как продукты замещения катионов водорода H + в кислоте на другие катионы или же как продукты замещения гидроксид-ионов в основаниях (или амфотерных гидроксидах) на другие анионы.
При полном замещении образуются так называемые средние или нормальные соли. Например, при полном замещении катионов водорода в серной кислоте на катионы натрия образуется средняя (нормальная) соль Na 2 SO 4 , а при полном замещении гидроксид-ионов в основании Ca(OH) 2 на кислотные остатки нитрат-ионы образуется средняя (нормальная) соль Ca(NO 3) 2 .
Соли, получаемые неполным замещением катионов водорода в двухосновной (или более) кислоте на катионы металла, называют кислыми. Так, при неполном замещении катионов водорода в серной кислоте на катионы натрия образуется кислая соль NaHSO 4 .
Соли, которые образуются при неполном замещении гидроксид-ионов в двухкислотных (или более) основаниях, называют осно вными солями. Например, при неполном замещении гидроксид-ионов в основании Ca(OH) 2 на нитрат-ионы образуется осно вная соль Ca(OH)NO 3 .
Соли, состоящие из катионов двух разных металлов и анионов кислотных остатков только одной кислоты, называют двойными солями . Так, например, двойными солями являются KNaCO 3 , KMgCl 3 и т.д.
Если соль образована одним типом катионов и двумя типами кислотных остатков, такие соли называют смешанными. Например, смешанными солями являются соединения Ca(OCl)Cl, CuBrCl и т.д.
Существуют соли, которые не попадают под определение солей как продуктов замещения катионов водорода в кислотах на катионы металлов или продуктов замещения гидроксид-ионов в основаниях на анионы кислотных остатков. Это — комплексные соли. Так, например, комплексными солями являются тетрагидроксоцинкат- и тетрагидроксоалюминат натрия с формулами Na 2 и Na соответственно. Распознать комплексные соли среди прочих чаще всего можно по наличию квадратных скобок в формуле. Однако нужно понимать, что, чтобы вещество можно было отнести к классу солей, в его состав должны входить какие-либо катионы, кроме (или вместо) H + , а из анионов должны быть какие-либо анионы помимо (или вместо) OH — . Так, например, соединение H 2 не относится к классу комплексных солей, поскольку при его диссоциации из катионов в растворе присутствуют только катионы водорода H + . По типу диссоциации данное вещество следует скорее классифицировать как бескислородную комплексную кислоту. Аналогично, к солям не относится соединение OH, т.к. данное соединение состоит из катионов + и гидроксид-ионов OH — , т.е. его следует считать комплексным основанием.
Номенклатура солей
Номенклатура средних и кислых солей
Название средних и кислых солей строится по принципу:
Если степень окисления металла в сложных веществах постоянная, то ее не указывают.
Названия кислотных остатков были даны выше при рассмотрении номенклатуры кислот.
Например,
Na 2 SO 4 — сульфат натрия;
NaHSO 4 — гидросульфат натрия;
CaCO 3 — карбонат кальция;
Ca(HCO 3) 2 — гидрокарбонат кальция и т.д.
Номенклатура основных солей
Названия основных солей строятся по принципу:
Например:
(CuOH) 2 CO 3 — гидроксокарбонат меди (II);
Fe(OH) 2 NO 3 — дигидроксонитрат железа (III).
Номенклатура комплексных солей
Номенклатура комплексных соединений значительно сложнее, и для сдачи ЕГЭ многого знать из номенклатуры комплексных солей не нужно.
Следует уметь называть комплексные соли, получаемые взаимодействием растворов щелочей с амфотерными гидроксидами. Например:
*Одинаковыми цветами в формуле и названии обозначены соответствующие друг другу элементы формулы и названия.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na 3 | криолит |
| SiO 2 | кварц, кремнезем |
| FeS 2 | пирит, железный колчедан |
| CaSO 4 ∙2H 2 O | гипс |
| CaC2 | карбид кальция |
| Al 4 C 3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H 2 O 2 | перекись водорода |
| CuSO 4 ∙5H 2 O | медный купорос |
| NH 4 Cl | нашатырь |
| CaCO 3 | мел, мрамор, известняк |
| N 2 O | веселящий газ |
| NO 2 | бурый газ |
| NaHCO 3 | пищевая (питьевая) сода |
| Fe 3 O 4 | железная окалина |
| NH 3 ∙H 2 O (NH 4 OH) | нашатырный спирт |
| CO | угарный газ |
| CO 2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH 3 | фосфин |
| NH 3 | аммиак |
| KClO 3 | бертолетова соль (хлорат калия) |
| (CuOH) 2 CO 3 | малахит |
| CaO | негашеная известь |
| Ca(OH) 2 | гашеная известь |
| прозрачный водный раствор Ca(OH) 2 | известковая вода |
| взвесь твердого Ca(OH) 2 в его водном растворе | известковое молоко |
| K 2 CO 3 | поташ |
| Na 2 CO 3 | кальцинированная сода |
| Na 2 CO 3 ∙10H 2 O | кристаллическая сода |
| MgO | жженая магнезия |
Простые вещества и химические соединения. Оксиды: основные, кислотные и амфотерные. Номенклатура оксидов. Зависимость кислотно-основного характера оксидов от положения в периодической системе и степени окисления элемента. Химическое взаимодействие между оксидами с образованием солей. Гидроксиды основные и амфотерные, кислоты. Их номенклатура и получение. Соли: нормальные, кислые и основные. Номенклатура солей. Получение и свойства солей.
Номенклатура и свойства комплексных соединений.
Неорганические соединения различают по составу (бинарные и многоэлементные) и функциональным признакам. К бинарным соединениям относят соединения элементов с кислородом (оксиды ), галогенами (галогениды – фториды, хлориды, бромиды, иодиды), халькогенами (халькогениды – сульфиды, селениды, теллуриды), азотом (нитриды), фосфором (фосфиды), углеродом (карбиды), кремнием (силициды ), а также соединения металлов друг с другом (интерметаллиды ) и водородом (гидриды ). Среди многоэлементных соединений выделяют гидроксиды (вещества, содержащие гидроксидные группы - ОН), производные гидроксидов – соли , а также комплексные соединения , гидраты и кристаллогидраты.
В соответствии с правилами ИЮПАК наименование любого вещества должно однозначно указывать на его состав. Поэтому в основу систематических.е. нование любого вещества должно однозначно указывать на его состав, поэтому в основу системаи соединений, нные соотношения названий неорганических веществ положены названия элементов, входящих в их состав.
Название бинарного соединения образуется из латинского корня наименования более электроотрицательного элемента с окончанием –ид и русского наименования менее электроотрицательного элемента в родительном падеже. При написании формулы вещества менее электроотрицательный элемент стоит левее. Например, Al 2 O 3 – оксид алюминия, AgI – иодид серебра, OF 2 – фторид кислорода. Для некоторых элементов корни их русских названий совпадают с корнями латинских, за исключением элементов, представленных ниже в таблице 1:
Таблица 1
Названия химических элементов
| Символьная запись | Русское название | Латинское название |
| Ag | Серебро | Аргент- |
| As | Мышьяк | Арс-, арсен- |
| Au | Золото | Аур- |
| C | Углерод | Карб-, карбон- |
| Cu | Медь | Купр- |
| Fe | Железо | Ферр- |
| H | Водород | Гидр-, гидроген- |
| N | Азот | Нитр- |
| Ni | Никель | Никкол- |
| O | Кислород | Окс-, оксиген- |
| Pb | Свинец | Плюмб- |
| S | Сера | Сульф-, тио- |
| Sb | Сурьма | Стиб- |
| Si | Кремний | Сил-, силиц-, силик- |
| Hg | Ртуть | Меркур- |
| Mn | Марганец | Манган- |
| Sn | Олово | Станн- |
Для обозначения количественного состава используют греческие числительные в качестве приставки, например, Hg 2 Cl 2 – дихлорид диртути, СО – монооксид углерода, СО 2 - диоксид углерода.
Числительные приставки имеют следующие названия:
1 - Моно- 5 - Пента- 9 - Нона-
2 - Ди- 6 - Гекса- 10 - Дека-
3 - Три- 7- Гепта- 11 - Ундека-
4 - Тетра- 8 - Окта- 12- Додека- .
Название многоэлементного соединения отражает его функциональные признаки, такие как принадлежность к гидроксидам или кислотам. Гидрооксиды – это соединения оксидов с водой. Их подразделяют на основные, проявляющие в химических реакциях свойства оснований, кислотные – проявляющие свойства кислот, амфотерные – способные проявлять как кислотные, так и основные свойства.
К классу оснований , согласно теории электролитической диссоциации, относят вещества, способные в водном растворе диссоциировать с образованием гидроксид-ионов ОН - : Наименование основного гидроксида (или основания) образовано из слова «гидроксид» и названия элемента в родительном падеже, после которого при необходимости указывают степень окисления элемента. Например, NaOH – гидроксид натрия, Fe(OH) 2 – гидроксид железа (II) или дигидроксид железа. Общую формулу основания можно записать как М(ОН) m , где М – металл, m- число гидроксильных групп, или кислотность основания .
Вещества, способные диссоциировать в растворе с образованием ионов водорода Н + , в соответствии с теорией электролитической диссоциацией относят к классу кислот .
Кислоты в зависимости от наличия в их составе кислорода подразделяются на кислородсодержащие и на безкислородные . В общем случае формулу кислоты можно записать как Н n А, где А – кислотный остаток, n – число атомов водорода в молекуле, или основность кислоты .
Систематическое название кислоты включает в себя наименование двух частей: электроположительной (атомы водорода) и электроотрицательной (кислотный остаток, анион). В названии аниона вначале указывают атомы кислорода (-оксо-), затем кислотообразующего элемента с добавлением суффикса -ат, далее в скобках абсолютную величину степени окисления этого элемента. Например, H 2 CO 3 – триоксокарбонат (IY) водорода, Н 2 SO 4 – тетраоксосульфат (VI) водорода. При наличии в анионе других атомов название аниона составляют из латинских корней названий соответствующих элементов и соединительной гласной -о- в порядке их размещения в формуле справа налево. Например, H 2 SO 3 (O 2) – пероксотриоксосульфат (VI) водорода, Н 2 SO 3 S – тиотриоксосульфат (VI) водорода. Систематические наименования наиболее употребительных кислот представлены в таблице 3.
Традиционное название состоит из двух слов – прилагательного, производного от корня названия кислотообразующего элемента, и слова «кислота», например, Н 2 SO 4 – серная кислота, НNO 3 – азотная кислота.
Амфотерные гидрооксиды способны диссоциировать в водных растворах как по типу оснований, так и по типу кислот, например,
При взаимодействии с кислотами они проявляют свойства оснований, а при взаимодействии с основаниями – свойства кислот. Их названия составляют по схеме, соответствующей основным гидроксидам.
Таблица 2
Названия важнейших кислот и их солей
| Формула кислоты | Названия | |
| Кислоты | Соли | |
| HAlO 2 | Метаалюминиевая | Метаалюминат |
| HAsO 3 | Метамышьяковая | Метаарсенат |
| H 3 AsO 4 | Ортомышьяковая | Ортоарсенат |
| HAsO 2 | Метамышьяковистая | Метаарсенит |
| H 3 AsO 3 | Ортмышьяковистая | Ортоарсенит |
| HBO 2 | Метаборная | Метаборат |
| H 3 BO 3 | Ортоборная | Ортоборат |
| H 2 B 4 O 7 | Четырёхборная | Тетраборат |
| HBr | Бромводород | Бромид |
| HOBr | Бромноватистая | Гипобромит |
| HBrO 3 | Бромноватая | Бромат |
| HCOOH | Муравьиная | Формиат |
| CH 3 COOH | Уксусная | Ацетат |
| HCN | Циановодород | Цианид |
| H 2 CO 3 | Угольная | Карбонат |
| H 2 C 2 O 4 | Щавелевая | Оксалат |
| HCl | Хлороводород | Хлорид |
| HOCl | Хлорноватистая | Гипохлорит |
| HClO 2 | Хлористая | Хлорит |
| HClO 3 | Хлорноватая | Хлорат |
| HClO 4 | Хлорная | Перхлорат |
| HCrO 2 | Метахромистая | Метахромит |
| H 2 CrO 4 | Хромовая | Хромат |
| H 2 Cr 2 O 7 | Двухромовая | Дихромат |
| HI | Йодоводород | Йодид |
| HOI | Йодноватистая | Гипойодит |
| HIO 3 | Йодноватая | Йодат |
| HIO 4 | Йодная | Перйодат |
| HMnO 4 | Марганцовая | Перманганат |
| H 2 MnO 4 | Марганцовистая | Манганат |
| H 2 MoO 4 | Молибденовая | Молибдат |
| HN 3 | Азидоводород (азотистоводородная) | Азид |
| HNO 2 | Азотистая | Нитрит |
| HNO 3 | Азотная | Нитрат |
| HPO 3 | Метафосфорная | Метафосфат |
| H 3 PO 4 | Ортофосфорная | Ортофосфат |
| H 4 P 2 O 7 | Двуфосфорная (пирофосфорная) | Дифосфат (пирофосфат) |
| H 3 PO 3 | Фосфористая | Фосфит |
| H 3 PO 2 | Фоснофорноватистая | Гипофосфит |
| H 2 S | Сероводород | Сульфид |
| HSCN | Родановодород | Роданид |
| H 2 SO 3 | Сернистая | Сульфит |
| H 2 SO 4 | Серная | Сульфат |
| H 2 S 2 O 3 | Тиосерная | Тиосульфат |
| H 2 S 2 O 7 | Двусерная (пиросерная) | Дисульфат (пиросульфат) |
| H 2 S 2 O 8 | Пероксодвусерная (надсерная) | Пероксидосульфат (персульфат) |
| H 2 Se | Селеноводород | Селенид |
| H 2 SeO 3 | Селенистая | Селенит |
| H 2 SeO 4 | Селеновая | Селенат |
| H 2 SiO 3 | Кремниевая | Силикат |
| HVO 3 | Ванадиевая | Ванадат |
| H 2 WO 4 | Вольфрамовая | Вольфрамат |
Соли представляют собой продукты замещения ионов водорода кислоты на металл или гидроксильных групп основания на кислотный остаток. В зависимости от полноты замещения атомов водорода или гидроксильных групп соли подразделяют на средние (или нормальные ), например К 2 SO 4 , кислые (или гидросоли ) например NaHCO 3 , и основные (или гидроксосоли ) например FeOHCl. Различают также двойные соли , образованные двумя металлами и одним кислотным остатком (КАl(SO 4) 2), и смешанные соли, образованные одним металлом и двумя кислотными остатками (СаСlОСl). Названия солей обусловлены систематическими названиями соответствующих кислот, например, К 2 SO 4 – тетраоксосульфат (VI) калия, NaHCO 3 – триоксокарбонат (IY) водорода-натрия, FeOHCl или, точнее, FeClOH – гидрокси-хлорид железа (II).
При наличии числовых приставок (1, 2, . . .) в названии вещества для верного понимания формулы применяют умножение приставки (например, КАl 3 (SO 4) 2 (OH) 6 – гексагидроксид-бис(сульфат) триалюминия-калия). Названия приставок следующие:
1 Монокис- 5 Пентакис- 9 Нонакис-
3 Трис- 7 Гептакис- 11 Ундекасис-
Традиционные наименования солей также содержат названия анионов в именительном падеже и названия катионов в родительном падеже (см. табл. 2), например, К 2 SO 4 – сульфат калия, NaHCO 3 – гидрокарбонат натрия, FeOHCl – гидроксохлорид железа (II).
Оксиды в зависимости от характерных функций, выполняемых в химических реакциях, подразделяют на солеобразующие (среди них выделяют основные, кислотные и амфотерные) и несолеобразующие .
Основные оксиды образуют соли при взаимодействии с кислотами или кислотными оксидами. Им соответствуют основания, так как они их образуют при взаимодействии с водой, например СаО – Са(ОН) 2 .
Кислотные оксиды образуют соли при взаимодействии с основаниями или основными оксидами. Они могут быть получены путем отделения воды от соответствующей кислоты. Поэтому их называют также ангидридами кислот, например SO 3 – ангидрид Н 2 SO 4 .
Амфотерные оксиды образуют соли как при взаимодействии с кислотами, так и при взаимодействии с основаниями, например, ZnO, Al 2 O 3 .
Гидраты и кристаллогидраты – соединения, содержащие в своем составе воду, например, NH 3 ∙ Н 2 О ∙ Fe 2 O 3 , n H 2 O, СuSO 4 ∙ 5Н 2 О. Как систематические, так и традиционные названия таких соединений начинаются со слова «гидрат» с соответствующей приставкой: NH 3 ∙ Н 2 О – гидрат аммиака, Fe 2 O 3 ∙ n H 2 O – полигидрат оксида железа (III), СuSO 4 ∙ 5Н 2 О – пентагидрад тетраоксосульфата меди (II), или пентагидрад сульфата меди (II).
Лекция 5. Химическая термодинамика
Химическая термодинамика. Термодинамические системы. Термодинамические параметры. Термодинамический процесс. Внутренняя энергия, теплота, работа. Первый закон термодинамики. Энтальпия. Закон Гесса и следствия из него. Энтропия. Второе начало термодинамики. Свободная энергия Гиббса и свободная энергия Гельгмольца.
Химическая термодинамика.
Термодинамика изучает взаимное превращение теплоты, работы и различных видов энергии. Слово термодинамика происходит от греческих слов термос (тепло) и динамос (сила, мощь). Термин термодинамика был введён Томсоном в 1854 году, который употребил его как синоним понятий теплота и работа.
Термодинамика основывается на трёх фундаментальных принципах, которые называются началами термодинамики. Они являются обобщением многочисленных экспериментальных фактов.
Применение методов термодинамики к химическим реакциям и процессам обусловили появление химической термодинамики. Предметом изучения химической термодинамики является превращение энергии при химических взаимодействиях, которые происходят при протекании химических процессов.
Термодинамические системы. Термодинамические параметры. Термодинамический процесс.
Термодинамика использует ряд понятий и модельных представлений, таких как термодинамическая система, параметры состояния, энергия, теплота, работа. Перейдем к их рассмотрению.
Понятие система означает ту часть материального мира, которую мы исследуем. Например, химический стакан с водой, реактор на химическом предприятии. Остальная часть материального мира, за пределами условно выделенной системы – называется окружением.
Термодинамической системой – называется совокупность тел, которая фактически или мысленно может быть выделена из окружающей среды. Система отделена от окружения границей, через которую совершается материальный обмен - массообмен или (и) теплообмен. В зависимости от степени изолированности различают открытые, закрытые, изолированные системы.
Открытые системы – это системы, которые обмениваются с внешней средой веществом, механической работой, теплотой и излучением. Например, в пробирке смешивается карбонат натрия (сода) с раствором хлорводородной кислоты. В результате протекает реакция
Na 2 CO 3 + HCl = NaCl + CO 2 + H 2 O.
В рассматриваемом химическом процессе масса системы уменьшается, так как улетучивается диоксид углерода, и выделяется тепло, часть которого идёт на нагрев окружающего воздуха.
Закрытые системы – системы, которые не обмениваются с внешней средой веществом, но взаимодействуют с ней посредством механической работы, теплообмена и излучения. Примером закрытой системы является пробирка, в которой происходит смешение соды с хлорводородной кислотой, закрытая пробкой.
Изолированные системы – системы невзаимодействующие с внешней средой. Между изолированной системой и окружением не происходит никакого обмена ни веществом, ни энергией. На практике понятие абсолютно изолированных систем не существует, оно является абстрактным, мысленным построением. Примером приближенно изолированной системы является термос или сосуд Дьюара.
Система может находиться в том или ином состоянии. Состоянием системы называется совокупность физических и химических свойств, характеризующих систему.
Состояние термодинамической системы характеризуют параметры состояния : давление, объём, температура, концентрация.
Давление (Р) характеризует подвижность молекул и определяется силой, с которой газообразные частицы действуют на стенки сосуда. Давление измеряют в Па (Паскаль), атм (атмосфера), мм рт. ст. (миллиметры ртутного столба): 1 атм = 760 мм рт. ст. = 101325 Па.
Объём (V) характеризует часть пространства, занимаемого веществом. Измеряют объём в м 3 (кубический метр), см 3 (кубический сантиметр), л (литр), мл (миллилитр): 1 м 3 = 1000 л; 1л = 1000 мл.
Температура (Т, t) характеризует степень нагретости системы и измеряется в К (шкала Кельвина) и 0 С (шкала Цельсия). Для перевода температур, выраженных в разных шкалах, используют выражение
Т = t + 273 (1).
Концентрация вещества (с) определяет количественный состав раствора, смеси, расплава. Например, молярная концентрация – количество молей вещества в 1 л раствора или смеси, обозначается через моль/л.
Таким образом, набор параметров (р, V, Т) называется состоянием системы, так как считается, что он полностью определяет состояние. Термодинамические параметры являются макроскопическими величинами, измеряемыми в опыте. Они являются функциями состояния, то есть их изменение определяется только начальным и конечным состояниями и не зависит от пути процесса, в результате которого произошло это изменение
∆ Т = Т кон – Т нач = Т 2 – Т 1 (2).
Для бесконечно малых изменений можно записать
∆ Т = dT (3).
Если величина не является функцией состояния, а зависит от пути процесса, то она является функцией перехода. В этом случае бесконечно малое изменение величины А записывают в виде
∆А = δА (4).
Таким образом, знак ∆ - обозначает изменение величины, являющейся функцией состояния, знак δ – обозначает изменение величины, являющейся функцией перехода.
Термодинамические параметры не являются независимыми, а связаны уравнением состояния. Примером такого уравнения является уравнение состояния идеального газа, которое называется уравнением Менделеева-Клайперона
где n – число молей газа; R – газовая постоянная.
Состояние термодинамической системы может изменяться с течением времени. Обычно такое изменение фиксируется при измерении одного из термодинамических параметров. Поэтому в термодинамике используется понятие термодинамического процесса.
Термодинамическим процессом называется всякое изменение в системе, связанное с изменением хотя бы одного параметра. Таким образом, термодинамический процесс – это изменение состояния системы. Различают следующие процессы: изохорный (V = const), изобарный (p = const), изотермический (T = const), адиабатный (теплота Q = 0).
Термодинамические процессы бывают:
-обратимые , когда переход из одного состояния в другое и обратно может происходить по одному и тому же пути, и после возвращения в исходное состояние в окружающей среде не остаётся макроскопических изменений; примером обратимого процесса является сжатие и растяжение пружины;
-необратимые или неравновесные , когда параметры изменяются с конечной скоростью и переход из одного состояния в другое и обратно не может происходить по одному и тому же пути, в результате в окружающей среде остаются макроскопические изменения; примером необратимого процесса является пластическая деформация металлической проволоки.
Внутренняя энергия, теплота, работа.
Кроме термодинамических параметров немаловажную роль играют и другие термодинамические величины, такие как работа и теплота. Они являются количественной мерой термодинамических процессов и характеризуют участие системы в термодинамических процессах. Работа и теплота являются энергетическими характеристиками. Поэтому рассмотрим понятие энергии.
Энергия происходит от греческого слова «действие» - есть мера способности совершать работу. Энергия измеряется в Дж (Джоуль). Многочисленные наблюдения и опытные факты говорят о следующих свойствах энергии.
Энергия не исчезает и не возникает из ничего.
Энергия может существовать в разнообразных формах.
В изолированной системе энергия может переходить из одной формы в другую, но её количество остаётся постоянным.
Если система не изолирована, то её энергия может изменяться, но при одновременном изменении энергии внешней среды на точно такую же величину.
Любая система обладает определённым запасом энергии, то есть энергия неотъемлемое свойство системы.
Для рассмотрения химических процессов важны следующие формы энергии: солнечная, механическая, химическая, ядерная, электрическая.
Различают следующие виды энергии: кинетическую (энергия движения), потенциальную (энергия положения и взаимодействия) и внутреннюю энергию (энергию состояния).