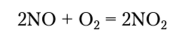Azot oksidləri. O.valvedinskaya Daha yüksək nitrat oksidin kimyəvi xüsusiyyətləri
Adi temperaturda, N 2 O, zəif bir xoş qoxu və şirin bir dadı olan rəngsiz bir qazdır; narkotik təsirə malikdir, əvvəlcə konvulsiv gülüş, sonra - huşunu itirmə.
İstehsal üsulları
1. Ammonium nitratın yüngül istiləşmə ilə parçalanması:
NH 4 NO 3 \u003d N 2 O + 2H 2 O
2. HNO 3-nin aktiv metallara təsiri
10HNO 3 (uyğunlaşma) + 4Ca \u003d N 2 O + 4Ca (NO 3) 2 + 5H 2 O
Kimyəvi xassələr
N 2 O, asidik və ya əsas xüsusiyyətlər göstərmir, yəni əsaslarla, turşularla, su ilə (duz olmayan oksid) qarşılıqlı təsir bağışlamır.
T\u003e 500 "C sadə maddələrə parçalanır. N 2 O çox güclü bir oksidləşdirici maddədir. Məsələn, kükürd dioksidi sulu bir məhlulda kükürd turşusuna oksid etməyə qadirdir:
N 2 O + SO 2 + H 2 O \u003d N 2 + H 2 SO 4
YOX - azot oksidi (II), azot oksidi.
Adi temperaturda NO rəngsiz, qoxusuz bir qazdır, suda az həll olunur və çox zəhərlidir (yüksək konsentrasiyada hemoglobinin quruluşunu dəyişdirir).
İstehsal üsulları
1. Sadə maddələrdən birbaşa sintez yalnız çox yüksək bir T səviyyəsində həyata keçirilə bilər:
N 2 + O 2 \u003d 2NO - Q
2. Sənayedə istehsal (HNO 3 istehsalının 1-ci mərhələsi).
4NH 3 + 5O 2 \u003d 4NO + 6H 2 O
3. Laboratoriya metodu - fəaliyyət parsları. Ağır metallar üçün HNO 3:
8HNO 3 + 3Cu \u003d 2NO + 3Cu (NO 3) 2 + 4H 2 O
Kimyəvi xassələr
NO, duz olmayan bir oksiddir (N 2 O kimi). Redoks ikitərəfli xüsusiyyətə malikdir.
I. YOX - oksidləşdirici maddə
2NO + SO 2 + H 2 O \u003d N 2 O + H 2 SO 4
2NO + 2H 2 \u003d N 2 + 2H 2 O (partlayışla)
II. YOX - azaldır
2NO + O 2 \u003d 2NO 2
10NO + 6KMnO 4 + 9H 2 SO 4 \u003d 10HNO 3 + 3K 2 SO 4 + 6MnSO 4 + 4H 2 O
NO 2 - azot oksidi (IV), azot dioksidi
Normal temperaturda NO 2, kəskin bir qoxu olan qırmızı rəngli qəhvəyi bir zəhərli qazdır. Bu NO 2 və onun nisbi N 2 O 4 nisbətində -1: 4 nisbətindədir. Azot dioksidi suda çox həll olunur.
İstehsal üsulları
I. Sənaye - NO: 2NO + O 2 \u003d 2NO 2-in oksidləşməsi
II. Laboratoriya:
fəaliyyət conc. Ağır metallar üçün HNO 3: 4HNO 3 + Сu \u003d 2NO 2 + Cu (NO 3) 2 + 2N 2 О
nitritlərin parçalanması: 2Pb (NO 3) 2 \u003d 4NO 2 + O 2 + 2PbO
Kimyəvi xassələr
NO 2 - turşu oksidi, 2 turşunun qarışıq bir anhidridi
NO 2 su, əsas oksidlər və qələvilərlə qarşılıqlı təsir göstərir. Ancaq reaksiyalar adi oksidlərdə olduğu kimi davam etmir - onlar da həmişə redoks olurlar. Bu, C.O ilə turşunun olmaması ilə izah olunur. (N) \u003d +4, buna görə də 2-də turşuların - azot və nitratın meydana gəlməsi ilə nisbi nisbətdə suda həll edildikdə NO 2:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2
Çıxartma O 2-nin iştirakı ilə baş verərsə, onda bir turşu əmələ gəlir - azot:
4NO 2 + 2H 2 O + O 2 \u003d 4HNO 3
Eynilə, NO 2-nin qələvi ilə qarşılıqlı təsiri baş verir:
o 2 olmadıqda: 2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O
o 2 varlığında: 4NO 2 + 4NaOH + O 2 \u003d 4NaNO 3 + 2H 2 O
NO 2 - çox güclü bir oksidləşdirici maddədir
Oksidləşmə qabiliyyəti baxımından NO 2 azot turşusundan üstündür. Atmosferində C, S, P, metallar və bəzi üzvi maddələr yanır. Bu vəziyyətdə NO 2 pulsuz azota endirilir:
10NO 2 + 8P \u003d 5N 2 + 4P 2 O 5
2NO 2 + 8HI \u003d N 2 + 4I 2 + 4H 2 O (bənövşəyi alov meydana gəlir)
Pt və ya Ni olduqda, azot dioksidi hidrogen ilə ammiaka qədər azalır:
2NO 2 + 7H 2 \u003d 2NH 3 + 4H 2 O
Bir oksidləşdirici maddə olaraq NO 2 raket yanacağında istifadə olunur. Hidrazin və onun törəmələri ilə qarşılıqlı təsir etdikdə çox miqdarda enerji buraxılır:
2NO 2 + 2N 2 H 4 \u003d 3N 2 + 4H 2 O + Q
N 2 O 3 və N 2 O 5 - qeyri-sabit maddələr
Hər iki oksid açıq bir turşu xarakterinə malikdir, müvafiq olaraq azot və nitrat turşularının anhidridləridir.
Fərdi maddə kimi N 2 O 3 yalnız T planın altındakı bərk vəziyyətdə olur. (-10 0 C).
Artan temperatur pozulduqda: N 2 O 3 → NO + NO 2
N 2 O 5 otaq temperaturunda və xüsusən işıqda o qədər güclü bir şəkildə parçalanır ki, bəzən öz-özünə partlayır.
Azot oksigen ilə bir sıra oksid meydana gətirir; hamısını azot turşusundan və ya onun duzlarından əldə etmək olar.
Azot oksidi (I), və ya azot oksidi N 2 O, ammonium nitratın istiləşməsi ilə əldə edilir:
Azot oksidi (1) zəif qoxu və şirin bir dadı olan rəngsiz bir qazdır. Suda bir qədər həll olunur: 20 ° C-də bir həcm su 0,63 həcmdə N 2 O həll edir.
Azot oksidi (I) termodinamik olaraq qeyri-sabit bir birləşmədir. Gibbs meydana gəlməsinin standart enerjisi müsbətdir (DS ° b p \u003d)
104 kJ / mol). Bununla birlikdə, N 2 O molekulundakı bağların möhkəmliyi səbəbindən bu maddənin iştirakı ilə başlayan reaksiyaların aktivləşmə enerjiləri yüksəkdir. Xüsusilə, N 2 O çürüməsinin aktivləşmə enerjisi yüksəkdir, buna görə azot oksidi (I) otaq temperaturunda sabitdir. Bununla birlikdə, yüksək temperaturda azot və oksigenə çevrilir; parçalanma daha sürətli olur, temperatur daha yüksəkdir.
Azot oksidi (1) su ilə, turşularla və ya qələvi ilə reaksiya vermir.
N 2 O molekulunun elektron quruluşu § 41-də nəzərdən keçirilir.
Az miqdarda azot oksidinin (I) inhalyasiyası ağrı həssaslığının daralmasına səbəb olur, bunun nəticəsində bu qaz bəzən anesteziya üçün oksigen ilə qarışıqda istifadə olunur. Böyük miqdarda azot oksidi (I) sinir sisteminə həyəcan verərək hərəkət edir; buna görə əvvəllər "gülən qaz" deyilirdi.
Azot oksidi (İi) və ya azot oksidi NO rəngsiz, qazı çətinləşdirir. Maye azot oksidi (II) -151.7 ° C-də qaynayır və -163.7 ° C-də qatılaşır. Suda zəif həll olunur: 1 həcm su 0 ° C-də cəmi 0,07 həcmdə NO həll edir.
Kimyəvi xassələrinə görə azot oksidi (II) laqeyd oksidlər arasındadır, çünki o, heç bir turşu əmələ gətirmir.
N 2 O kimi, azot oksidi (II) termodinamik olaraq qeyri-sabitdir - formalaşmasının standart Gibbs enerjisi müsbətdir (AGo 6p \u003d 86,6 kJ / mol). Yenə də, N 2 O kimi, NO otaq temperaturunda parçalanmaz, çünki onun molekulları kifayət qədər güclüdür. Yalnız 1000 0 C-dən yuxarı olan temperaturda onun azot və oksigenə parçalanması nəzərəçarpacaq dərəcədə davam etməyə başlayır. Çox yüksək temperaturda, § 65-də müzakirə olunan səbəblərə görə NO çürümə sona çatmır - NO-N 2 -O 2 sistemində tarazlıq qurulur. Buna görə azot oksidi (II) elektrik qövs temperaturunda (3000-4000 ° C) sadə maddələrdən əldə edilə bilər.
Laboratoriyada azot oksidi (II) adətən 30-35% azot turşusunu mis ilə reaksiya verərək əldə edilir:
Sənayedə, azot turşusu istehsalında bir aralıqdır (bax § 143).
Azot oksidi (II) redoks ikili ilə xarakterizə olunur. Güclü oksidləşdirici maddələrin təsiri altında oksidləşir və güclü azaldıcı maddələrin iştirakı ilə bərpa olunur. Məsələn, atmosfer oksigeni ilə azot dioksidinə asanlıqla oksidləşir: ![]()
Eyni zamanda, bərabər miqdarda NO və H 2 qarışığı qızdırıldıqda partlayır:
NO molekulunun elektron quruluşu ən yaxşı şəkildə MO metodu ilə təsvir edilmişdir. Əncirdə Şəkil 116, NO molekulundakı MO doldurma nümunəsini göstərir (N 2 və CO molekullarına bənzər nümunələri ilə - bax Şek. 51 və 53). NO molekulunda N 2 və CO molekullarından daha çox bir elektron var: bu elektron gevşetici orbital l bit 2-dədir r Beləliklə, buradakı bağlayıcı elektronların sayı boşalma sayını beşdən çoxdur. Bu 2.5 (5: 2 \u003d 2.5) bir bağlama nisbətinə uyğundur. Həqiqətən, NO molekulunun atomlara yayılması enerjisi (632 kJ / mol) əlaqənin çarpışmasının iki olduğu və N 2 molekulunun (945 kJ / mol) olduğu O 2 molekulu (498 kJ / mol) üçün müvafiq dəyərlərlə müqayisədə aralıqdır. əlaqə üçlü olduğu yerdə. Eyni zamanda, dissosiasiya enerjisi baxımından NO molekulu molekulyar oksigen ionu O 2-yə yaxındır (644 kJ / mol), bu bağın çoxluğu da 2,5-dir.
Bir elektron NO molekulundan ayrıldıqda, boşalan elektronları olmayan bir NO + ion meydana gəlir; atomlar arasındakı bağın çoxluğu bu vəziyyətdə üçə (altı bağlayıcı elektron) qədər artır. Buna görə NO + ionunun (1050 kJ / mol) dissosiasiya enerjisi NO molekulunun dissosiasiya enerjisindən daha yüksəkdir və bağ çarpışmasının üç olduğu CO molekulunun (1076 kJ / mol) uyğun dəyərinə yaxındır.

Şek. 116.
Dioksid (və ya azot dioksidi NO 2 xarakterik bir qoxu olan qəhvəyi bir zəhərli qazdır. Asanlıqla soyuduqdan sonra parlayan və -11.2 ° C-də dondurulmuş, rəngsiz bir kristal kütləsi meydana gətirən qırmızı bir maye halına gəlir. Qazlı azot dioksidini qızdırdıqda, əksinə, rəngi güclənir və 140 ° C-də demək olar ki, qara olur. Artan temperaturla birlikdə azot dioksidinin rəngindəki bir dəyişiklik molekulyar çəkisinin dəyişməsi ilə müşayiət olunur. Aşağı temperaturda buxar sıxlığı, təxminən N 2 O 4 ikiqat formula uyğundur. Artan temperaturla buxar sıxlığı azalır və 140 ° C-də NO 2 düsturuna uyğundur. -11.2 ° C və aşağıda mövcud olan rəngsiz kristallar N 2 O 4 molekullarından ibarətdir. İstiləşdikdə N 2 O 4 molekulları tünd qəhvəyi azot dioksid molekulları meydana gətirmək üçün parçalanır; tam dağılma 140 0 C-də baş verir. Beləliklə, -11.2-dən 140 ° C-yə qədər olan temperaturda NO 2 və N 2 O 4 molekulları bir-birləri ilə tarazlıqdadır:
140 ° C-dən yuxarı, NO 2-nin NO və oksigenə bölünməsi başlayır.
Azot dioksidi çox enerjili bir oksidləşdirici maddədir. Bir çox maddə oksigen alaraq NO 2 atmosferində yandıra bilər. Kükürd dioksidi, oksid turşusu istehsalının azot üsuluna söykənən trioksidə oksidləşir (bax § 131).
NO 2 buxar zəhərlidir. Onları inhalyasiya etmək tənəffüs yollarının şiddətli qıcıqlanmasına səbəb olur və ciddi zəhərlənməyə səbəb ola bilər.
Suda həll edildikdə NO 2 su ilə reaksiya verir və azot və nitrat turşularını əmələ gətirir:
Lakin azot turşusu çox qeyri-sabitdir və tez parçalanır:
Buna görə azot dioksidinin su ilə, xüsusən isti ilə qarşılıqlı təsiri tənliyə əsasən davam edir
əvvəlki iki bərabərliyi əlavə etməklə əldə edilə bilər, əgər onlardan birincisi üçə çarpılarsa.
Hava varlığında yaranan azot oksidi dərhal azot dioksidinə oksidləşir ki, bu halda NO 2 nəticədə azot turşusuna keçir:
Bu reaksiya nitrat turşusu istehsalında müasir üsullarda istifadə olunur.
Azot dioksidini qələvilərdə həll etsəniz, azot və azot turşularının duzları ilə qarışıq yaranır, məsələn:
Azot oksidi (III), və ya azotlu anhidrit, N 2 O 3, tünd mavi bir mayedir, aşağı temperaturda belə NO və NO 2 halına düşür. Yenidən soyudulduqdan sonra bərabər miqdarda NO və NO 2 qarışığı N 2 O 3 əmələ gətirir:
![]()
Azot oksidi (III) azot turşusu HNO 2-yə uyğundur.
Azot oksidi (V), və ya azot anhidridi, N 2 O 5 - ağ kristallar, hətta otaq temperaturunda da, tədricən NO 2 və O 2 halına düşür. Fosforik anhidritin azot turşusuna təsiri ilə əldə edilə bilər:
Azot oksidi (V) çox güclü bir oksidləşdirici maddədir. Bir çox üzvi maddələr onunla təmasda alovlanır. Suda azot oksidi (V) nitrat turşusunun əmələ gəlməsi ilə yaxşı həll olunur.
Bərk vəziyyətdə N 2 O 5 nitrat ionu NO 3 və ion tərəfindən əmələ gəlir
nitronium YOX 2. Sonuncusu eyni sayda elektron ehtiva edir
cO 2 molekulu və sonuncu kimi, xətti bir quruluşa malikdir: O \u003d N \u003d O.
Cütlüklərdə N 2 O 5 molekulu simmetrikdir; onun quruluşunu nöqtələr üç mərkəzli bağlar (nitrik turşu molekulunun valentlik sxemi) göstərən aşağıdakı valentlik sxemi ilə təmsil oluna bilər.
|
Dina Kamilevna Gainullina - biologiya elmləri namizədi, Moskva Dövlət Universitetinin biologiya fakültəsinin İnsan və heyvan fiziologiyası bölməsində tədqiqatçı M.V. Lomonosova, qan dövranı fiziologiyası mütəxəssisi. Elmi maraq dairəsi, postnatal ontogenezdə erkən dövrdə damar sisteminin tənzimlənməsidir. |
Svetlana İvanovna Sofronova - eyni şöbənin aspirantı, endotel nitrat oksidi sintezinin hormonal tənzimlənməsi problemləri ilə məşğul olur. |
Olga Sergeevna Tarasova - biologiya elmləri doktoru, eyni şöbənin professoru və Rusiya Dövlət Elmlər Akademiyasının Biotibbi Problemlər İnstitutu, DSK-nın Əzələ Fiziologiyası Laboratoriyasının aparıcı elmi işçisi, qan dövranı və avtonom sinir sistemi sahəsində mütəxəssis. Elmi maraq dairəsi, ürək-damar sisteminin tənzimlənməsinin sistemli və yerli mexanizmlərinin qarşılıqlı təsiridir. |
Qan damarlarının tonu və bədəndəki qan təzyiqi bir çox sistem və mexanizmlərin əlaqəli işi ilə tənzimlənir, bunlar arasında damar endoteli də mühüm rol oynayır. Nitrik oksidin (NO) ifraz edilməsi endotel hüceyrələrin əsas funksiyalarından biridir və həkimlər çox vaxt disfunksiyasını NO istehsalının azalması ilə müxtəlif xəstəliklərlə əlaqələndirirlər. Bu sistemin işləməsi ilə bağlı müasir fikirlər nələrdir? Bu suala məqaləmizdə cavab verməyə çalışacağıq.
Ümumi məlumat
Bütün qan və limfa damarlarını, eləcə də ürək boşluqlarını əhatə edən hüceyrələrin təbəqəsi ilk dəfə 1847-ci ildə T. Schwann tərəfindən "aydın şəkildə fərqlənən bir membran" kimi təsvir edildi, bu da 18 il sonra W. Gis endotel adlandırdı. Nisbətən böyük damarlarda (damarlar və damarlar) bu təbəqə qan və hamar əzələ hüceyrələri arasında maneə rolunu oynayır və ən kiçik damarların, kapilyarların divarları tamamilə endotel hüceyrələrdən qurulur. Onların ümumi sayı çox böyükdür: bir yetkinin bədənində ümumi kütlə 1 kq-dan çoxdur!
XX əsrin 50-60-cı illərində. Elektron mikroskopla silahlanmış elm adamları endotelin quruluşunu ətraflı izah etdilər, lakin ürək-damar sisteminin funksiyalarının tənzimlənməsindəki rolu bəlli deyildi. 1980-ci ilə qədər endoteliy yalnız qan və damar divarları arasında seçici şəkildə keçirici bir maneə hesab olunurdu, baxmayaraq ki, o dövrdə qan laxtalanmasının qarşısını alan maddələr ifraz etmək qabiliyyətinə malik idi.
Endotelin funksiyaları haqqında müasir fikirlərin başlanğıcı 1980-ci ildə, R. Farchgott və J. Zawadski damar tonunun tənzimlənməsindəki roluna diqqət çəkdikdə qoyuldu. Zərif təcrübələrdə tədqiqatçılar sübut etdilər ki, asetilkolin kimi bir maddə dovşan cəsədindən təcrid olunmuş aorta hazırlıqlarının yalnız bir endotelinin olması halında rahatlamağa səbəb olur. Bu müşahidənin o qədər vacib olduğu ortaya çıxdı ki, Farchgott sonradan Nobel mükafatçılarından biri oldu (1998). Hal-hazırda, asetilkolinə və digər maddələrə reaksiya verən endoteldən asılı damar reaksiyası geniş çeşidli arteriya damarlarında - nəinki böyük, həm də orqanlara qan tədarükünü tənzimləyən kiçik tədqiqatlarda izah edilmişdir (Şəkil 1).

1986-cı ilə qədər, damar hamar əzələlərin rahatlamasına, asetilkolinin təsiri altında endoteldən çıxan azot oksidi (NO) səbəb olduğu ortaya çıxdı. Belə bir qısa müddətdə (cəmi altı il) endotel və damar hamar əzələ arasında vasitəçi rolu üçün bir çox digər müraciət edənlərdən NO-ni təcrid etmək necə mümkün oldu? Fakt budur ki, Farchgott və Zawadski'nin məşhur əsərindən 10 il əvvəl, NO'un vasodilatör təsiri öyrənildi. Həqiqətən, o vaxta qədər 100 il ərzində nitrogliserin (o, molekulların mənbəyi kimi xidmət edir) ürəyin qan damarlarının spazmları nəticəsində yaranan angina pektorisini müalicə edirdi. Endotelial rahatlama faktoru və NO'nin şəxsiyyəti həddindən artıq qeyri-sabitlik (xüsusən reaktiv oksigen növlərinin olması halında), hemoglobin və əlaqəli zülallarla qarşılıqlı təsir zamanı inaktivasiya və damar hamar əzələ hüceyrələrində oxşar biokimyəvi dəyişikliklərə səbəb olmaq kimi göstəricilərlə müəyyən edilmişdir.
İnsanlarda və heyvanlarda azot oksidi ürək-damar və digər sistemlərin əsas endogen tənzimləyicilərindən biridir. 1992-ci ildə, bu ilin molekulu adlandırıldı və bu gün bədəndəki funksiyalarına dair illik nəşr sayı bir neçə minə bərabərdir. Endoteliye endokrin bezlərdə olduğu kimi hüceyrələrin bir yerə yığılmadığı nəhəng bir endokrin orqan deyilə bilər, ancaq vücudumuzun bütün orqan və toxumalarına nüfuz edən damarlarda dağılır. Normal fizioloji şəraitdə endoteliya əsasən mexaniki olaraq aktivləşdirilir: qan axınının yaratdığı və ya təzyiq altında bir damar uzanaraq. Bundan əlavə, endotel hüceyrələri tənzimləyici molekullar, məsələn, purin birləşmələri (ATP və ADP), peptidlər (bradykinin, kalsitoninlə əlaqəli peptid, maddə P və s.) Tərəfindən aktivləşdirilə bilər.
Azot oksidi ilə yanaşı, endotel hüceyrələrində damar tonunu, toxumalara qan tədarükünü və qan təzyiqini təsir edən digər maddələr də sintez olunur. Beləliklə, prostasiklin (prostaglandin I 2) və endotelial hiperpolyarizasiya amili damarların rahatlanmasında YOX köməkçi ola bilər. Onların iştirak nisbəti heyvanın cinsindən və növündən, damar yatağının növündən və damarın ölçüsündən asılıdır. Məsələn, NO təsiri nisbətən böyük damarlarda, kiçik olanlarda hiperpolarizasiya edən amildir.
Endoteliyada yalnız vasodilatatorlar deyil, həm də vazokonstriktorlar meydana gəlir: bəzi prostaglandinlər, tromboksan, endotelin-1 peptidlər və angiotensin II, superoksidion. Sağlam bir bədəndə endotelin sekretor fəaliyyəti vasodilatlandırıcı amillərin istehsalına yönəldilmişdir. Ancaq müxtəlif xəstəliklər (sistemik və ya ağciyər hipertenziyası, miokard işemiyası, şəkərli diabet və s.) Və ya yaşlanmaqla sağlam bir bədəndə gizli endotel fenotip vasokonstriktiv təsirlər istiqamətində dəyişə bilər.
Endoteldən asılı olan tənzimləmə mexanizmlərinin müxtəlifliyinə baxmayaraq, onun normal işləməsi əksər hallarda NO sekresiya qabiliyyəti ilə əlaqələndirilir. Xəstəliklərdə endotel öz xüsusiyyətlərini dəyişdikdə həkimlər bu vəziyyəti endotel disfonksiyon adlandırırlar ki, bu da NO istehsalının azalmasını göstərir. YOX əhəmiyyətinə görə, tənzimləmə rolu, əvvəlcə normal, daha sonra damar patologiyasının bəzi formaları ilə bağlı mövcud fikirləri nəzərdən keçirəcəyik.
Endoteldə NO-nin sintezi və tənzimlənməsi
Təbiətdə azot oksidinin sintezi müxtəlif yollarla baş verə bilər. Belə ki, troposferdə şimşək axıdılması təsiri altında O 2 və N 2-dən, bitkilərdə NO 2 və karotenoidlər arasındakı fotokimyəvi reaksiya səbəbindən və heyvanlarda nitrit və nitratların metal atomları olan zülallarla qarşılıqlı təsiri nəticəsində meydana gəlir (məsələn, hemoglobin) ) Bu reaksiyaların hamısı bioloji katalizatorların - protein fermentlərinin iştirakı olmadan baş verir, buna görə sürəti idarə etmək nisbətən çətindir. Lakin, heyvanlarda fizioloji proseslərin tənzimləyicisi kimi NO-nin əsas miqdarı xüsusi fermentlər NO sintazalarının (NOS) təsiri altında əmələ gəlir və amin turşusu L-arginin azot atomunun mənbəyi kimi xidmət edir [,].
Fərqli cinslər tərəfindən kodlanmış NO sintazaların bir neçə növü (izoform) vardır. 1990-cı ildə fermentin neyron forması (nNOS) siçovul beynindən təcrid olunmuşdur. Bir az sonra immun sisteminin hüceyrələrində (makrofaglar) induksiya edilə bilən NOS (iNOS), endoteliyada isə - endotel NOS (eNOS) tapıldı. Digər bir NOS izoformu, mitokondriyada lokallaşdırılmış, hüceyrə tənəffüs proseslərini tənzimləyir. Çox sayda kofaktor NO sintezində iştirak etdiyinə görə, fermentin bütün izoformları onlar üçün xüsusi bağlayıcı sahələrə malikdirlər. Hər NOS molekulu iki eyni yarıdan ibarətdir. Onları bir dimerə birləşdirmək üçün koftaktor tetrahidrobiopterin tələb olunur. Onun çatışmazlığı ilə, eNOS reaktiv oksigen növlərinin istehsalına keçir (superoksid anion və H 2 O 2), bu, endotelə və damar divarının digər hüceyrələrinə zərər verə bilər.
Fermentin iki izoformu - eNOS və nNOS - birləşmə adlanır, çünki onlar həmişə hüceyrələrdə olur və nisbətən az miqdarda (iNOS ilə müqayisədə) NO sintez olunur və bu izoformların fəaliyyəti fizioloji stimullarla tənzimlənir. Bunun əksinə olaraq, iNOS davamlı olaraq yalnız bəzi hüceyrələrdə, məsələn, makrofaglarda sintez olunur və endotel, sinir və bir çox başqalarında yalnız xarici, əsasən iltihablı stimullara cavab olaraq görünür (məsələn, bakteriya hüceyrə divarlarının elementləri - bakterial lipopolisakkaridlər). Aktiv iNOS, eNOS və nNOS-dan 1000 dəfə daha sürətli YOX istehsal edir. Makrofaglar patogenləri məhv etmədən öldürmək üçün bu qədər böyük miqdarda NO istifadə edirlər.
Beləliklə, damar divarındakı əsas NO sintaz eNOSdur və əsasən endoteldə olur. Hamar əzələ hüceyrələrində eNOS geninin transkripsiyası xüsusi mexanizmlərlə, məsələn, "başlanğıc" yerinin metilizasiyasının qarşısını alır. Synthase, çox sayda tənzimləyici molekulların (müxtəlif ion kanalları və reseptorları) cəmləşdiyi xüsusi intruziyalarda, caveollarda endotel hüceyrənin xarici membranına bağlanır. Fermentin bu "fiksasiyası" onun reseptorları və kanalları ilə funksional əlaqəsini təmin edir, bu da eNOS fəaliyyətinin tənzimlənməsini asanlaşdırır. Caveollarda protein caveolin lokallaşdırılır, bu da stimullaşdırıcı stimul olmadıqda fermentin fəaliyyətini maneə törədir.
Endotel NO sintazanın funksional rolu hüceyrədəki molekulların sayından (eNOS gen ifadə səviyyəsi) və fəaliyyətindən asılıdır. Qeyd etmək lazımdır ki, yeni protein molekullarının sintezi nisbətən uzun olur, buna görə NO istehsalında uzunmüddətli dəyişiklikləri təmin etmək üçün istifadə olunur, məsələn, damar sistemini fiziki fəaliyyətə və ya yüksək hündürlükdə hipoksiyaya uyğunlaşdırarkən. NO sintezini, ilk növbədə hüceyrə funksiyalarının universal tənzimləyicisi olan Ca 2+-in hüceyrədaxili konsentrasiyasının dəyişməsini tez idarə etmək üçün digər mexanizmlərdən istifadə olunur. Dərhal qeyd edirik ki, bu cür fizioloji tənzimləmə yalnız eNOS və nNOS üçün xarakterikdir, iNOS üçün (Ca 2+ -dən asılı olmayan bir ferment) əsasən gen ifadəsi səviyyəsində baş verir.
Ca 2+ konsentrasiyasının müəyyən bir eşik səviyyəsinə qədər artması endotel NO sintazının kaveolindən çıxarılması və aktiv vəziyyətə keçməsi üçün zəruri şərtdir. Ca 2+ ilə yanaşı, fosforlaşma, eNOS fəaliyyətinin tənzimlənməsi üçün, yəni, hüceyrədaxili fermentlər, protein kinazları ilə fosfor turşusu qalığının kovalent olaraq əlavə edilməsi üçün böyük əhəmiyyət daşıyır. Fosforlaşma eNOS-un kalsiumla aktivləşmə qabiliyyətini dəyişdirir (Şəkil 2). Protein kinazları fosfor turşusu qalıqlarını eNOS molekulunun ciddi şəkildə müəyyənləşdirilmiş amin turşusu qalıqlarına bağlayır, bunlardan ən əhəmiyyətlisi 1177 (Ser1177) mövqeyindəki serin və 495 (Thr495) mövqeyindəki threonindir. Ser1177 saytı eNOS üçün əsas aktivləşdirmə saytı hesab olunur. Məlumdur ki, fosforlaşma dərəcəsi mühüm tənzimləyici amillərin təsiri altında sürətlə artır: qabıqlı stres, bradikinin, damar endotel artım amili və estradiol. Bu prosesi həyata keçirən əsas ferment Aktdır (başqa bir ad protein kinase B), lakin eNOS'u aktivləşdirə biləcək digər kinazlar da məlumdur (bu barədə daha sonra danışacağıq).
Thr495 yerindəki fosforlaşma ferment fəaliyyətini azaldır. Belə bir mənfi təsir bəzi patoloji şəraitdə - oksidləşdirici stres, şəkərli diabet və s. Əksinə, normal fizioloji təsiri ilə fosfat çıxarılır (yəni Thr495 deposforilatlar) və beləliklə eNOS-un Ca 2+ ilə yaxınlığını artırır. fəaliyyəti artır. Beləliklə, endotel hüceyrələrdəki eNOS-un intensivliyi, müxtəlif protein kinazlarının təsiri altında Ca 2+ səviyyəsi və fosforlaşma / deposforlaşma ilə dinamik olaraq idarə oluna bilər. Bu, nəticədə azot oksidinin sintezinin və buna görə ürək-damar sisteminə fizioloji təsirinin gözəl tənzimlənməsini təmin edir.
Hamar əzələ hüceyrələrinin rahatlama mexanizmləri
Endotel hüceyrələri tərəfindən ifraz olunan NO necə vasodilasiyaya səbəb olur? Bütün növ əzələ hüceyrələrinin daralması iki zülalın - aktin və myosinin qarşılıqlı təsiri ilə təmin edilir və hamar əzələ hüceyrələrində sonuncunun motor fəaliyyəti yalnız onun fosforlaşmasından sonra görünür. Bu, azot oksidi də daxil olmaqla hamar əzələ hüceyrələrinin daralma fəaliyyətinə təsir göstərən çox sayda tənzimləmə mexanizminin olmasını nəzərdə tutur.
YOX molekullar lipofilikdir, buna görə endotel hüceyrələrindən sərbəst əzələ daxil olurlar. Onlarda əsas NO qəbuledicisi sitozolda yerləşən və buna görə həll olunan (yəni hüceyrə membranları ilə əlaqəli olmayan) guanilat siklaza fermentidir. Azot oksidi aktivləşdirilmiş guanilat siklaz, başqa bir fermentin, protein kinase G.-nin güclü bir aktivatoru olan Ca 2+ sitoplazmatik konsentrasiyasının tənzimlənməsində iştirak edən çoxsaylı zülalların hamar əzələ hüceyrələrində hədəfi kimi xidmət edir.
Protein kinaz G, hamar əzələ hüceyrələrinin hiperpolarizasiyasına (membran potensialının daha çox mənfi dəyərlərə keçməsi) səbəb olan bəzi kalium kanallarını aktivləşdirir, xarici membranın potensial idarə olunan kalsium kanallarını bağlayır və bununla da Ca 2+-nin hüceyrəyə daxil olmasını azaldır. Bundan əlavə, aktiv vəziyyətdə olan bu ferment Ca 2+-in hüceyrədaxili anbarlardan sərbəst buraxılmasını maneə törədir və sitoplazmadan çıxarılmasına da kömək edir. Bununla yanaşı Ca 2+ konsentrasiyasını azaldır və hamar əzələləri rahatlaşdırır.
Zülal kinaz G, Ca 2+ homeostazına təsirindən əlavə, hamar əzələ hüceyrələrinin kontraktil aparatının Ca 2+ həssaslığını tənzimləyir, yəni Ca 2+ artdıqda aktivləşmə qabiliyyətini azaldır. Məlumdur ki, protein kinazı G-nin aktivləşdirilməsi (vasitəçilərin iştirakı ilə) hamar əzələ miyozininin fosforlaşma səviyyəsini azaldır, nəticədə aktinlə daha pis qarşılıqlı təsir göstərir və bu da istirahətə kömək edir. Təsvir edilən hadisələrin birləşməsi vasodilasyona, orqanlarda qan axınının artmasına və qan təzyiqinin azalmasına səbəb olur.
NO istehsalının fizioloji tənzimlənməsi
NO istehsal etmə qabiliyyəti endotelin normal funksional vəziyyətinin göstəricisi kimi çıxış edir: sağlam bir bədəndə NO-nin təsirinin (məsələn, eNOS-un farmakoloji blokadası yolu ilə) aradan qaldırılması vasokonstriksiyaya və sistematik təzyiqin artmasına səbəb olur. Demək olar ki, bütün normal fizioloji stimulların təsiri nəticəsində endoteldə (və ya və ya onun fəaliyyətində) NO sintazanın miqdarı artır. NO istehsalını tənzimləyən əsas amil qan axınıdır. Gəmi boyunca endotelin səthində hərəkət edərkən, qabıqlı stres yaranır. Bu stimul, mexaniki həssas kanalların aktivləşdirilməsi və Ca 2+ giriş yolu ilə hüceyrələrin içərisində lokallaşdırılmış endotel NO sintaza ötürülür. Başqa bir ötürmə variantı, protein protein kinaz aktivliyi artdıqda və eNOS-un (Ser1177-də) fosforlandırıldığı təqdirdə, membran fermentləri vasitəsilə həyata keçirilir. Qan axını az miqdarda NO az miqdarda endotel ilə ifraz olunmasını təmin edir (Şəkil 3).
Endotelin kəsilmə stresinə həssaslığında mühüm rol glikokalyx oynayır. Bu, hüceyrələri əhatə edən karbohidrat təbiətindəki polimer molekullarının bir təbəqəsidir, qalınlığı bir neçə mikrometr ola bilər və hətta endotelin özünün qalınlığından da artıq ola bilər. Glikoproteinlərin "kolları" damarın lümeni içərisində böyüdükcə, ilk növbədə qan axınının təsirini hiss edənlərdir. Deformasiya edən, qlikokalik liflər membran zülallarına, sonra isə eNOS-a siqnal ötürür. Bu mexanizm hələ çox öyrənilməsə də, onun əhəmiyyəti, müxtəlif xəstəliklərdə (ateroskleroz, şəkərli diabet və s.) Damarların qırılma stresinə reaksiyasının pozulmasının endotelinin "keçəlliyi", yəni qalınlığının azalması və quruluşun dəyişməsi ilə əlaqəli olması ilə sübut olunur. glikocalyx.
Artan qan axını endotel NO sintazasının və vasodilasiyanın aktivləşməsinə gətirib çıxarır və bu qədər uzun və ya təkrar məruz qalma bu fermentin endoteldə miqdarını artırır. Fiziki məşqlərin faydalı təsiri buna əsaslanır: Təlimin köməyi ilə narkotik istifadə etmədən endotel işini əhəmiyyətli dərəcədə yaxşılaşdıra biləcəyiniz məlumdur! Ancaq qeyd etmək lazımdır ki, bütün məşqlər belə faydalı təsir göstərmir. Əvvəlcə yük, sürətli gəzinti, qaçış və ya velosiped sürərkən meydana gələn kimi, işləyən əzələlərdə qan axınının sürətinin artması ilə müşayiət olunmalıdır və çəkilərlə güc məşqləri belə təsir göstərmir. İkincisi, güclə məşq edə bilməzsiniz: həddindən artıq yük altında eNOS-un fəaliyyətini azaldan əsas stres hormonu olan kortizol ifraz olunur.
Məşq zamanı endotel NO sintazasının əlavə aktivləşdirilməsi, adenozin monofosfatı (AMP) tərəfindən aktivləşdirilmiş protein kinazı ilə təmin edilir, bu, bədənimizin demək olar ki, bütün hüceyrələrində, o cümlədən endotel hüceyrələrində olur. Bu ferment "hüceyrə enerjisinin statusu sensörü" adlanır, çünki bir hüceyrənin sitoplazmasında AMP / ATP nisbətinin artması, yəni enerji xərcləməsinin meydana gəlməsini aşmağa başladığı zaman aktiv olur. Sıx sıxlaşan skelet əzələlərinin içərisində olan arteriyaların endoteliyində bu hipoksiya nəticəsində meydana gələ bilər - əzələ hüceyrələri çox O 2 istehlak edir və damar endotelindən məhrum olur. Bundan əlavə, son zamanlarda bu protein kinazının endotel hüceyrələrində aktivləşməsinin, kəsmə stressinin artması, yəni işləyən əzələlərə qan axınının artması ilə mümkün olduğu göstərilmişdir. Ser1177 yerində aktivləşdirilmiş protein kinaz fosforilatları eNOS, NO istehsal artır və qan damarları genişlənir.
Kardioloqlar yaxşı bilirlər ki, müntəzəm fiziki hazırlıq sayəsində təkcə skelet əzələlərində və ürəkdə intensiv qanla təmin olunan ürəklərdə deyil, həm də birbaşa məşqdə iştirak etməyən orqanlarda - beyində, dəridə və s. Endotel funksiyanı yaxşılaşdırmaq mümkündür. e. Bu, qan axınının endotelə təsirinə əlavə olaraq, endotel NO sintazasının tənzimlənməsi üçün digər mexanizmlərin olduğunu göstərir. Bunların arasında aparıcı rol, endokrin bezlər tərəfindən istehsal olunan, qanla nəql edilən və xüsusi reseptor zülallarının olması ilə müxtəlif orqanlarda hədəf hüceyrələrini tanıyan hormonlara aiddir.
Məşq zamanı endotelin işinə təsir edə bilən hormonlardan, hipofiz tərəfindən ifraz olunan böyümə hormonunu (böyümə hormonu) qeyd edirik. Həm özü, həm vasitəçiləri, insulinə bənzər böyümə amilləri, böyümə hormonu endotel NO sintazasının meydana gəlməsini və fəaliyyətini artırır.
Endotel funksiyalarının hormonal tənzimlənməsinin ən məşhur nümunəsi qadın cinsi hormonlarının, estrogenlərin təsiridir. Əvvəlcə bu fikir epidemioloji müşahidələr nəticəsində ortaya çıxdı ki, nədənsə uşaq doğulan qadınların kişilərlə müqayisədə endotel disfonksiyon ilə əlaqəli damar xəstəliklərindən daha az əziyyət çəkirlər. Üstəlik, qadınlarda, onun menstruasiya dövründə və ilk yarısında, qanda estrogen konsentrasiyası çox olduqda, endoteldən asılı olan vazodilasyon daha yaxşı olur. Bu müşahidələr çoxsaylı heyvan təcrübələrinə səbəb oldu. Beləliklə, qadın siçovullarında yumurtalıqların çıxarılması müxtəlif orqanların damarlarında (beyin, ürək, skelet əzələləri, böyrəklər, bağırsaqlar və s.) Endotel NO sintazasının məzmununu və fəaliyyətini azaldı və bu tip qadınlara estrogenin daxil olması, pozulmuş funksiyanın normallaşmasına kömək etdi. Estrogenlərin eNOS fəaliyyətinə təsiri Akt protein protein kinazının aktivləşməsi ilə əlaqələndirilir və artan eNOS sintezi onların endotel hüceyrə genomuna təsiri ilə əlaqələndirilir.
Maraqlıdır ki, beyində damarların reaksiyalarının pozulması kişilərdə cinsi bezlərin çıxarılması ilə aparılan təcrübələrdə də aşkar edilmişdir, baxmayaraq ki, testislər estrogenləri deyil, androgenləri, kişi cinsi hormonlarını ifraz edir. Bu paradoks, aromatazın beynin arteriyalarının endoteliyasında - androgenləri estrogenlərə çevirən bir ferment aşkar edildikdə aydın oldu. Beləliklə, estrogenin damar endotelinə qoruyucu təsiri kişilərdə də baş verə bilər. Ancaq bu vəziyyətdə birbaşa damar divarında əmələ gələn estrogenlər tərəfindən təmin olunan yerli tənzimləmə haqqında danışmalıyıq.
Sonda endotel NO sintazının tiroid hormonları tərəfindən tənzimlənməsini nəzərdən keçiririk. Məlumdur ki, damar endotelində işinin pozulması halında NO sintezinin intensivliyi dəyişir: hipertiroidizm artdıqca hipotiroidizm ilə azalır. Bu təsir əsasən endotel hüceyrələrdə NO sintazanın tərkibindəki dəyişikliklə əlaqədardır. Bununla birlikdə, bu yaxınlarda bu hormonların damar endotel hüceyrələrində başqa bir təsir mexanizminin mövcudluğuna dair sübutlar mövcuddur. Beləliklə, təcrübi hipertiroidi olan siçovul arteriyalarında Ser1177 sahəsindəki Ca 2+ asılı eNOS fəaliyyəti və onun fosforlaşması hipotiroidi olan siçovullara nisbətən xeyli yüksək idi.
Tiroid hormonlarının inkişaf edən bir bədəndəki toxumaların fərqlənməsində əsas rol oynadığı məlumdur. Lakin onların təsiri cərəyan edən proseslərin sürətlənməsi və ya yavaşlaması ilə məhdudlaşmır, çox vaxt proqramlaşdırma xarakteri daşıyır. Bu o deməkdir ki, müəyyən bir kritik yaşda tiroid hormonlarının çatışmazlığı ilə, hormonlar həyatın sonrakı mərhələlərində tətbiq olunsa da, hüceyrələr tam işləyə bilmirlər (insanlarda hormon terapiyası yalnız doğuşdan sonrakı ilk aylarda təsirli olur). Tiroid hormonlarının proqramlaşdırma təsirinin mexanizmləri yalnız sinir sistemi üçün, digər sistemlər üçün isə daha pis araşdırılmışdır. Ancaq hamıya məlumdur ki, hamiləlik dövründə ananın hipotiroidizmi, digər şeylərlə yanaşı, uşaqda ürək-damar xəstəliklərinin inkişafı üçün risk faktorudur. Maraqlıdır ki, doğuşdan sonrakı ilk həftələrdə gənc siçovulların damarlarında tiroid hormon reseptorlarının yüksəldilmiş səviyyəsi, həmçinin tiroksin (tetraiodothyronine) ni daha aktiv triiodothyronine çevirən ferment deiodinaz aşkar olunur. Bu müşahidələrə əsaslanaraq tiroid hormonlarının damar endotelinə də bir proqram təsir göstərə biləcəyini düşünmək cazibədardır. Bunun nə qədər həqiqət olduğunu gələcək araşdırmalar göstərəcəkdir.
Endotel tərəfindən NO sekresiyasının pozulması mexanizmləri
Təəssüf ki, NO istehsalını təmin etmək üçün damarlarımızın endotelinin imkanları məhdud deyil. Bədənin tənzimləmə sistemlərinin aktivliyi gənc və yetkin yaşda yüksəkdir, lakin bir sıra amillərin təsiri altında yaşlanma ilə azalır. Əvvəla, yalnız bir neçə yaşlı insan qədim yunan filosofu Aristotelin ifadəsinə cəhd edə bilər: "Həyat hərəkət tələb edir." İkincisi, bir çox hormonal sistemin fəaliyyəti yaşla azalır: böyümə hormonu və cinsi hormonların ifrazı azalır, tiroid bezi “yuxuya düşür”. Üçüncüsü, bütün hüceyrələrin metabolizmasında dəyişikliklər var. Xüsusilə, hüceyrənin enerji stansiyaları olan mitoxondrilər, NO-i təsirsiz hala gətirən və fəaliyyətini maneə törədən və endotel NO sintazasının tərkibini azaldan çox miqdarda reaktiv oksigen növləri istehsal etməyə başlayır. Göründüyü kimi, endoteldə yaşla bağlı dəyişikliklərin qarşısını almaq olmur, lakin inkişaf etdirilən hormon əvəzedici terapiyasından (məsələn, menopauzadan sonra qadınlarda) və ya antioksidanlar istifadə edərək yüksək kalorili qidaların qəbulunu məhdudlaşdırmaqla (bu da AMP tərəfindən aktivləşdirilmiş protein kinazlarının aktivliyini artırır) hərəkətliliyi artırmaqla yavaşlatıla bilər. və gerontologiyanın prioritet sahəsi olaraq qalır.
Damar endotelindəki NO sintezi niyə müxtəlif patologiyalar tərəfindən pozulur? Burada iki növ dəyişiklik mümkündür: sürətli (endoteldə NO sintazanın aktivliyinin azalması) və uzun müddətli - hüceyrələrdəki tərkibinin azalması. Müxtəlif xəstəlikləri ayrıca nəzərdən keçirməyəcəyik, ancaq eNOS-un işinə zərərli olanlar üçün ümumi olan mexanizmləri sadalayın. Xəstəliklərdə bu fermentin aktivliyinin azalması, protein kinaz C. aktivliyinin artması səbəbindən Thr495 yerində fosforlaşmasının artması ilə əlaqələndirilir. Güclü aktivatoru diasilqliseroldur. Normalda, bir çox membran reseptorlarından siqnal verməkdə ikincil vasitəçidir, ancaq endotel hüceyrələrdə həddindən artıq yığılması patologiyaya səbəb olur.
Belə dəyişikliklərin bariz nümunəsi şəkərli diabet kimi bir xəstəlik ola bilər ki, bu da sintezin pozulması və ya hüceyrələrdəki insulinin hərəkəti qanda qlükoza konsentrasiyasının artmasına səbəb olur. Qlükoza endotelinə insulin (skelet əzələ hüceyrələri, ürək, yağ toxuması və başqalarından fərqli olaraq) tərəfindən tənzimlənmədiyi üçün şəkər orada yığılır və protein kinaz C aktivləşdirən diacilgliserolun sintezi üçün substrat olur.
Bir çox ürək-damar patologiyasının bir markeri, artıq qeyd olunan oksidləşdirici stresdir. Reaktiv oksigen növlərinin artan formalaşması şəkərli diabet, ateroskleroz və arterial hipertenziyanın bir çox forması üçün xarakterikdir. Bu şəraitdə, renin-angiotensin sisteminin yüksək aktivliyi tez-tez müşahidə olunur və angiotensin II oksidləşdirici stresin güclü bir təxribatçısıdır, bu, bir tərəfdən eNOS-un fəaliyyətini azaldır (məsələn, oksidləşmiş aşağı sıxlıqlı lipoproteinlər protein kinaz C-ni aktivləşdirə bilər), digər tərəfdən isə gen ifadəsini azaldır. eNOS, bu da NO istehsalını azaldır. Anjiyotensin II (angiotenzin çevirən ferment inhibitorları və ya angiotensin II blokerlər) meydana gəlməsini və ya fəaliyyətini maneə törədən antioksidanların və ya maddələrin istifadəsi demək olar ki, həmişə NO meydana gəlməsini artırır. Deməliyəm ki, xəstəliklərdə azot oksidi istehsalının azalması nəinki eNOS-a birbaşa təsir ilə əlaqələndirilə bilər. Beləliklə, qlükokortikoidlərin endotelə təsiri yalnız fermentin özünün deyil, həm də onun koftaktoru olan tetrahidrobiopterinin tərkibini azaldır.
Endotel NO sintazasının pozulması, onun əsas substratı olan L-argininin olmaması ilə əlaqədar ola bilər. Bir qayda olaraq, bu amin turşusu bədənə kifayət qədər miqdarda qida ilə daxil olur və əlavə olaraq yetkinlərin orqanizmində birbaşa sintez edilə bilər. Bununla birlikdə, arginin NO sintazlarına əlavə olaraq, bir çox digər ferment, xüsusən də damar endotelində müxtəlif hüceyrələrdə yerləşən arginaz üçün substrat rolunu oynayır. Diabetes mellitus, oksidləşdirici stresdə, həmçinin immunitet sisteminin hüceyrələri tərəfindən ifraz olunan sitokinlərin (şiş nekrozu amili və s.) Təsiri altında iltihabi proseslərdə endoteldə arginaz miqdarı artır.
Nəhayət, insanlarda və digər heyvanlarda dimetilrarginin kimi endotelial NO sintaz inhibitorları görünə bilər. Endotel NO sintazasının bu "saxta substrat" \u200b\u200bfermentin aktiv mərkəzi üçün həqiqi substrat olan L-arginin ilə rəqabət aparır. Normalda, dimethylarginin bədəndə yalnız az miqdarda (yetkinlərdə ~ 60 mq / gün), lakin müxtəlif qan dövranı patologiyaları (arterial hipertansiyon, ateroskleroz, koronar çatışmazlıq və s.) Onun istehsalı əhəmiyyətli dərəcədə artır və endotel NO aktivlik göstərir. -syntase, müvafiq olaraq azalır.
Beləliklə, azot oksidi, endotelinin ona bitişik olan hamar əzələ hüceyrələrinə rahatlaşdırıcı təsir göstərərək, vasodilasiyaya səbəb olur və arzuolunmaz artımları sistem səviyyəsində hamarlaşdırır. Endoteliy bu problemləri həll etmək üçün kifayət qədər miqdarda NO sekresiya qabiliyyətini saxlayırsa, damar sisteminin vəziyyəti barədə narahat ola bilməzsiniz.
Bu iş Rusiya Əsas Tədqiqatlar Fondu tərəfindən dəstəkləndi. Qaralama NK 14-04-31377 mol.
Ədəbiyyat
.
Furchgott R. F., Zawadzki J. V. Arterial hamar əzələlərin asetilkolin ilə istirahətində endotel hüceyrələrin məcburi rolu // Təbiət. 1980. V. 288. P. 373–376.
.
Melkumyants A. M., Balaşov S. A. Arterial endotelin mexaniki həssaslığı. Tver, 2005.
Calcitonin Gen ilə əlaqəli Peptid) beyində və periferik sinir sistemində alternativ mRNA yayılması ilə kalsitoninlə eyni bir gendən əmələ gəlir.
Qalıq nömrələri, insanın eNOS molekulundakı yerə uyğun olaraq verilir.
Tərkibində azotun müxtəlif valentlər göstərməsi səbəbindən bir neçə oksid bu element üçün xarakterikdir: diazot oksidi, mono, tri-, di- və azotun pentaoksidləri. Onların hər birini daha ətraflı nəzərdən keçirək.
Tərif
Diazot oksidi (gülən qaz, azot oksidi) rəngsiz bir qazdır, termal sabitdir.
Suda zəif həll olunur. Güclü soyutma ilə N 2 O × 5.75H 2 O klarat məhluldan kristallaşır.
Tərif
Azot monoksidi həm rəngsiz qaz, həm də mavi bir maye şəklində mövcud ola bilər.
Bərk vəziyyətdə, tamamilə maye vəziyyətdə (N 2 O 2), qismən (≈ 25% N 2 O 2), qazda isə çox az dərəcədədir. Həddindən artıq termal sabitdir. Suda zəif həll olunur.
Tərif
Azot trioksidi Termal olaraq qeyri-sabit mavi bir mayedir.
Otaq temperaturunda 90% NO və NO 2 halına gəlir və qəhvəyi olur (NO 2), qaynama nöqtəsi yoxdur (əvvəlcə buxarlanır). Qatı vəziyyətdə, ion quruluşu olan ağ və ya mavi bir maddədir - nitrosil nitrit (NO +) (NO 2 -). Bir qazda ON-NO 2 molekulyar quruluşa malikdir.
Tərif
Azot dioksidi (tülkü quyruğu) qəhvəyi bir qazdır.
135 o-dan yüksək temperaturda - bu monomerdir, otaq temperaturunda - NO 2-nin qırmızı-qəhvəyi bir qarışığı və onun dimeridir (diazo tetraoksid) N 2 O 4. Maye vəziyyətdə, dimer rəngsiz, bərk vəziyyətdə isə ağ rəngdədir. Soyuq suda yaxşı həll olunur (doymuş həll parlaq yaşıldır), tamamilə reaksiya göstərir.
Tərif
Azot pentoksidi (azot anhidridi) Ağ bərk, rəngsiz bir qaz və mayedir.
Qızdırıldıqda, alt-üst olur və əriyir, otaq temperaturunda 10 saat ərzində parçalanır. Bərk vəziyyətdə ion bir quruluşa malikdir (NO 2 +) (NO 3 -) - nitroil nitrat.
Cədvəl 1. Azot oksidlərinin fiziki xüsusiyyətləri.
Azot oksidi almaq
Laboratoriya şəraitində, diazot oksidi quru ammonium nitratını (1) diqqətlə qızdırmaq və ya sulfamik və nitrat (73%) turşuların qarışığını (2) qızdırmaqla əldə edilir:
NH 4 NO 3 \u003d N 2 O + 2H 2 O (1);
NH 2 SO 2 OH + HNO 3 \u003d N 2 O + H 2 SO 4 + H 2 O (2).
Azot monoksidi azot və oksigenin sadə maddələrinin yüksək temperaturda (≈1300 o С) qarşılıqlı təsiri ilə əldə edilir:
N 2 + O 2 \u003d 2NO.
Bundan əlavə, azot oksidi (II) mis suyun seyreltilmiş nitrat turşusundakı əriməsinin reaksiya məhsullarından biridir:
3Cu + 8HNO 3 \u003d 3Cu (NO 3) 2 + 2NO + 4H 2 O.
Azot oksidlərindən (II) və (IV) -36 o azot oksidinin meydana gəlməsi ilə bir qaz qarışığını soyudanda:
NO + YOX 2 \u003d N 2 O 3.
Bu birləşmə arsen (III) oksidi (3) və ya nişasta (4) 50% nitrat turşusunun təsiri ilə əldə edilə bilər:
2HNO 3 + As 2 O 3 \u003d NO 2 + NO + 2HAsO 3 (3);
HNO 3 + (C 6 H 10 O 5) n \u003d 6nNO + 6nNO 2 + 6nCO 2 + 11nH 2 O (4).
Qurğuşun (II) nitratının termik parçalanması dioksidazın meydana gəlməsinə səbəb olur:
2Pb (NO 3) 2 \u003d 2PbO + 4NO 2 + O 2.
Eyni birləşmə mis konsentrat nitrat turşusunda həll edildikdə yaranır:
Cu + 4HNO 3 \u003d Cu (NO 3) 2 + 2NO 2 + 2H 2 O.
Azot pentoksidi quru xlorun quru gümüş nitrat (5) üzərindən keçməsi, həmçinin azot oksidi (IV) və ozon (6) arasındakı reaksiya nəticəsində əldə edilir:
2Cl 2 + 4AgNO 3 \u003d 2N 2 O 5 + 4AgCl + O 2 (5);
2NO 2 + O 3 \u003d N 2 O 5 + O 2 (6).
Azot oksidinin kimyəvi xüsusiyyətləri
Diazot oksidi biraz reaktivdir, seyreltilmiş turşular, qələvilər, ammonyak hidrat, oksigenlə reaksiya vermir. Qızdırıldıqda tam konsentratlaşdırılmış sulfat turşusu, hidrogen, metallar, ammonyak ilə reaksiya verir. Karbon və fosforun yanmasını dəstəkləyir. OVR-də həm zəif oksidləşdirici, həm də zəif bir azaldıcı maddənin xüsusiyyətlərini nümayiş etdirə bilər.
Azot monoksit su, seyreltilmiş turşular, qələvilər, ammonyak hidrat ilə reaksiya vermir. Dərhal oksigen bağlayır. Qızdırıldıqda, halogenlər və digər qeyri-metallar, güclü oksidləşdirici və azaldıcı maddələrlə reaksiya verir. Bir kompleksləşmə reaksiyasına girir.
Azot trioksidi turşu xüsusiyyətləri nümayiş etdirir, su, qələvi, ammonyak hidrat ilə reaksiya göstərir. Oksigen və ozon ilə reaksiya verir, metalları oksidləşdirir.
Azot dioksidi su və qələvi ilə reaksiya verir. OVR-də güclü bir oksidləşdirici maddənin xüsusiyyətlərini nümayiş etdirir. Metalların korroziyasına səbəb olur.
Azot pentoksidi turşu xüsusiyyətləri nümayiş etdirir, su, qələvi, ammonyak hidrat ilə reaksiya göstərir. Çox güclü bir oksidləşdirici maddədir.
Azot oksidinin istifadəsi
Diazot oksidi qida sənayesində (çırpılmış krem \u200b\u200bistehsalında propellant), tibbdə (inhalyasiya anesteziyası üçün), həmçinin raket yanacağının əsas komponenti kimi istifadə olunur.
Trioksid və azot dioksidi qeyri-üzvi sintezdə azot və kükürd turşularının çıxarılması üçün istifadə olunur. Azot oksidi (IV) raket yanacağı və qarışıq partlayıcı maddələrin tərkib hissələrindən biri olaraq tətbiq tapmışdır.
Problemlərin həllinə dair nümunələr
NÜMUNƏ 1
| Tapşırıq | Azot oksidi 63,2% oksigen ehtiva edir. Oksidin düsturu nədir. |
| Həll yolu | X elementinin bir molekuldakı HX kütləsi aşağıdakı düsturla hesablanır: ω (X) \u003d n × Ar (X) / M (HX) × 100%. Oksiddəki azotun kütləvi hissəsini hesablayırıq: ω (N) \u003d 100% - ω (O) \u003d 100% - 63.2% \u003d 36.8%. "X" (azot) və "y" (oksigen) ilə birləşməni təşkil edən elementlərin mol sayını bildirək. Sonra molar nisbəti aşağıdakı kimi görünəcək (D.I. Mendeleevin Dövri Cədvəlindən götürülmüş nisbi atom kütlələrinin dəyərləri tam ədədlərə yuvarlaqlaşdırılmışdır): x: y \u003d ω (N) / Ar (N): ω (O) / Ar (O); x: y \u003d 36.8 / 14: 63.2 / 16; x: y \u003d 2.6: 3.95 \u003d 1: 2. Beləliklə, azot və oksigenin birləşməsinin formulu NO 2 formasına sahib olacaqdır. Bu, azot oksidi (IV). |
| Cavab | YOX 2 |
NÜMUNƏ 2
| Tapşırıq | Hansı qazlar daha ağır və havadan daha yüngül və neçə dəfə: karbon qazı, azot dioksidi, karbonmonoksit, xlor, ammiak? |
| Həll yolu | Verilmiş bir qazın kütləsinin eyni temperaturda və təzyiqdə eyni həcmdə alınan başqa bir qazın kütləsinə nisbəti, ikinci qazdakı nisbi sıxlıq adlanır. Bu dəyər birinci qazın ikinci qazdan neçə dəfə ağır və ya yüngül olduğunu göstərir. Havanın nisbi molekulyar kütləsi 29-a bərabərdir (havadakı azot, oksigen və digər qazların miqdarı nəzərə alınmaqla). Qeyd edək ki, "havanın nisbi molekulyar kütləsi" anlayışı şərti olaraq istifadə olunur, çünki hava qazların qarışığıdır. D hava (CO 2) \u003d M r (CO 2) / M r (hava); D hava (CO 2) \u003d 44/29 \u003d 1.52. M r (CO 2) \u003d Ar (C) + 2 × Ar (O) \u003d 12 + 2 × 16 \u003d 12 + 32 \u003d 44. D hava (NO 2) \u003d M r (NO 2) / M r (hava); D hava (NO 2) \u003d 46/29 \u003d 1.59. M r (NO 2) \u003d Ar r (N) + 2 × Ar r (O) \u003d 14 + 2 × 16 \u003d 14 + 32 \u003d 46. D hava (CO) \u003d M r (CO) / M r (hava); D hava (CO) \u003d 28/29 \u003d 0.97. M r (CO) \u003d Ar (C) + Ar (O) \u003d 12 + 16 \u003d 28. D hava (Cl 2) \u003d M r (Cl 2) / M r (hava); D hava (Cl 2) \u003d 71/29 \u003d 2.45. M r (Cl 2) \u003d 2 × Ar (Cl) \u003d 2 × 35.5 \u003d 71. D hava (NH 3) \u003d M r (NH 3) / M r (hava); D hava (NH 3) \u003d 17/29 \u003d 0.57. M r (NH 3) \u003d Ar r (N) + 3 × Ar r (H) \u003d 14 + 3 × 1 \u003d 17. |
| Cavab | Karbon qazı, azot dioksidi və xlor havadan daha ağırdır, müvafiq olaraq 1,52; 1.59 və 2.45 dəfə, karbonmonoksit və ammiak 0.97 və 0.57 dəfə yüngül olur. |
OXİDİYYƏT sirri
Azot, +1 ilə +5 arasında mümkün olan bütün oksidləşmə vəziyyətlərinə rəsmi şəkildə uyğun bir sıra oksid meydana gətirir: N 2 O, NO, N 2 O 3, NO 2, N 2 O 5, lakin bunlardan yalnız ikisi azot oksidi (II) və oksiddir. azot (IV) - yalnız normal şəraitdə sabit deyil, həm də təbii və sənaye azot dövrlərində fəal iştirak edir. Buna görə də, onların xüsusiyyətlərini dəqiq olaraq (müqayisədə) öyrənəcəyik. Həmişə olduğu kimi molekulların quruluşu ilə başlayırıq.
Azot oksidlərinin molekullarının qurulması
Molekul YOX Quruluşu güman etmək olduqca sadədir: oksigenin iki açılmamış elektronu var, azotun üçü var - ikiqat bağlantı meydana gəlir və qalıqda bir boşaldılmamış elektron ... Belə bir "qeyri-standart" molekulun nə üçün sabit olduğunu sualına cavab vermək asan deyil. Yeri gəlmişkən, sabit sərbəst radikalların - açılmamış elektronları olan molekulların təbiətdə olduqca nadir olduğunu qeyd etmək lazımdır. Hesab etmək olar ki, NO molekulları cütləşir və ikiqat, ya da dimerik olan ONNO molekulunu meydana gətirəcəkdir. Beləliklə, boşalmamış bir elektron problemi həll etmək mümkündür.
MolekulYOX 2. Göründüyü kimi daha sadədir - bir oksigen atomu açılmamış elektron vasitəsilə NO molekuluna qoşuldu. (Əslində, bağlayan bir atom deyil, bir molekul deyil və YOX deyil, ONNO dimer'ə aiddir. Buna görə də, artan temperatur artdıqca bağlanma sürəti azalır - dimer yarıya bölünür.) İndi oksigendə boşalmayan bir elektron var - azot oksidi molekulu. (İv) ayrıca sərbəst bir radikaldır. Lakin, məlumdur ki, iki NO 2 molekul birləşəndə \u200b\u200bvə N 2 O 4 molekulu əmələ gəldikdə, əlaqə azot atomları vasitəsilə olur, yəni azotun bu çox açılmamış elektrona sahib olması deməkdir. Bunu necə etmək olar?
Cavab qeyri-ənənəvi, lakin donor-akseptor bağı tamamilə azotun “xarakterində” olur. Məntiqdən istifadə edərək, bir azot atomunun NO molekulundakı elektronları nəzərdən keçirin. Bu açılmamış bir elektron, sərbəst bir cüt elektron və oksigenlə əlaqədə daha iki elektron - cəmi beş. Və "təmasda olan" oksigen atomunun dörd orbitdə altı elektron var. Onları ikiyə bölsəniz, bir orbital sərbəst qalacaq. Bu, azot atomunun cüt cüt elektronunu tutur və bu əlaqədəki açılmamış elektron tamamilə əlaqəsizdir (Şəkil 1, 2).
Başqa bir məqamı da qeyd etmək lazımdır - bir dəfə bir cüt elektronlar yerləşdi s"əlaqə quran" orbitallar, hibridləşmədən keçmək məcburiyyətində qaldılar - ikinci atomu ümumi istifadə üçün ilk atomun səthində bərabər paylanmış bir cüt elektron təklif etmək çox çətindir. Sual yaranır: bir atom hibridləşmənin hansı növündən istifadə edir? Cavab: Üç elektron azot orbitalı bir vəziyyətdədir sp 2hibridləşmə. NO 2 molekulu bucaqlıdır, bucaq 134 ° -dir (bucaq 120 ° -dən çoxdur, çünki bir elektron bağlayıcı elektronları bir cüt elektrondan daha zəif itələyir) (Şəkil 3-5).
Azot oksidlərinin fiziki xüsusiyyətləri
Azot oksidiYOX Molekulyar kristal panjara; molekul yüngül, biraz qütbdür (oksigenin elektroniteti azotdan daha yüksəkdir, lakin çox deyil). Ərimə və qaynama nöqtələrinin az, lakin azotdan daha yüksək olacağını güman etmək olar, çünki molekulun hər hansı bir qütbü cazibə elektrostatik qüvvələrini sadəcə intermolekulyar qüvvələrə bağlamağa imkan verir. Bir dimer meydana gəlməsi, qaynama nöqtəsini artıraraq molekulu daha da ağırlaşdırır. Molekulun quruluşu suda aşağı bir həll olma təklif edir - bir həlledici NO-dan xeyli qütbdür. Ayrıca, nitrat oksidinin (II) nə rəngə, nə də qoxuya sahib olduğunu vurğulamağa dəyər.
Azot oksidi YOX 2. Kristal panjası da molekulyardır, lakin molekulun özü NO-dan daha ağır olduğundan və ölçülmək meyli nəzərəçarpacaq dərəcədə yüksək olduğundan bu maddə nəzərəçarpacaq dərəcədə daha yüksək temperaturda əriyib qaynamalıdır. Qaynama nöqtəsi 21 ° C-dir, buna görə normal şəraitdə - 20 ° C və 760 mm RT. Sənət - azot oksidi (IV) maye.
İndi həllolma ilə məşğul olaq. Xatırladaq ki, "həlletmə" sözü su ilə kimyəvi reaksiyaları da ifadə edə bilər; əsas odur ki, həlledici həlledicini udur. Su ilə oksidlərin reaksiyasında, bildiyiniz kimi, hidroksidlər əldə edilir - rəsmi olaraq onlar sadəcə nəmləndirilmiş oksidlərdir, lakin reallıq çox vaxt maraqlı və tamamilə qeyri-rəsmi olanları təqdim edir. Beləliklə, bu azot oksidi suda həll olur, eyni anda reaksiya verir və iki turşu bir anda əldə edilir!
Qeyd edək ki, azot oksidi (IV) xarakterik kəskin iy və qırmızı-qəhvəyi rəngə malikdir, çalarları konsentrasiyasına görə bir-birindən fərqlənir. Məhz bu rəng üçün atmosferə azot oksidlərinin atılmasına "tülkü quyruqları" deyilir.
Sən soruşursan: sirri haradadır? Oksidləşmə dərəcələrinin sirrinin birinci hissəsi sizin qarşınızdadır: niyə beşinci (tək) qrupun elementində hətta oksidləşmə dərəcəsi olan oksidlər sabitdir? (Eyni zamanda, sərbəst radikallar da var!) Ən ümumi mənada cavab aydındır - əgər sabitdirlərsə, bu onlar üçün çox faydalıdır. Enerjili şəkildə. Niyə? Göründüyü kimi, nöqtə azot və oksigen atomlarının spesifik quruluşudur - onların çox elektron və çox az orbitalı var. Qaydalarını diktə edən, belə "enerji faydaları" yaradan "orbital imkanlar" dır. Sonra "iki" və "dörd" rəqəmləri aydın olur: iki elektronda səkkizə qədər oksigen var və hər iki atomda cəmi dörd orbital var.
Həm də deyə bilərsən ki, YOX sadəcə ... bir oksigen molekulunun NO 2-yə çevrilməsini gözləyir. Bir metafora istifadə edərək, bir çox atomun "həyatın mənası" nın "həyatdakı tərəfdaş" - bir atom və ya başqa bir element atomlarını tapmaq istəyinin olduğunu qeyd edirik. Əlbəttə ki, qızıl kimi "inandırılmış bakalavrlar" var.
Azot oksidlərinin kimyəvi xüsusiyyətləri
1. Metallarla reaksiyalar.Müsbət oksidləşmə vəziyyətindəki azot atomu bir oksidləşdirici maddədir və oksidləşmə vəziyyəti nə qədər yüksəkdirsə, digər atomlardan da elektron seçmək qabiliyyəti nə qədər güclü olarsa, azot oksidləri, əsasən redüktan edən metallarla reaksiya verəcəkdir. Məhsullar reaksiya şərtlərindən və metalın özündən asılı olaraq tamamilə fərqli ola bilər. Məsələn, isti mis bütün azot oksidləri oksigen verir və özləri sadə bir maddə azotuna çevrilir:

Yaranan mis oksidi və azotun miqdarına görə azot oksidlərinin hansının misla reaksiya verdiyini müəyyən etmək mümkündür.
2. Qeyri-metallarla reaksiyalar. Əvvəlcə oksigen ilə reaksiyaları nəzərdən keçiririk. Burada oksidlər arasında çox ciddi bir fərq müşahidə olunur.
OksidNO azot oksidi (IV) əmələ gətirmək üçün oksigenlə reaksiya göstərir. Reaksiya tərsdir. Bundan əlavə, artan temperatur ilə bu reaksiya sürəti azalır:
2NO + O 2 \u003d 2NO 2.
Oksid NO 2 ümumiyyətlə oksigenlə reaksiya vermir.
Ozon hər iki oksidi azot oksidinə (V) çevirir.
Azot oksidiNO tamamilə ozonu birləşdirir:
2NO + O 3 \u003d N 2 O 5.
Azon oksidi (IV) NO 2, ozonla reaksiya olaraq oksigeni də buraxır:
2NO 2 + O 3 \u003d N 2 O 5 + O 2.
3. Su ilə reaksiyalar. NO oksid su ilə reaksiya vermir. Su ilə NO 2 oksid iki turşu meydana gətirir - azot turşusu (azot oksidləşmə vəziyyəti +5) və azot turşusu (azot oksidləşmə vəziyyəti +3). Oksigen olduqda, NO 2 oksidi tamamilə azot turşusuna çevrilir:
2NO 2 + H 2 O \u003d HNO 3 + HNO 2,
4NO 2 + O 2 + 2H 2 O \u003d 4HNO 3.
4. Turşularla reaksiyalar.Oksidlərin heç biri - Xeyr və ya NO 2 - turşularla reaksiya vermir.
5. Alkalilərlə reaksiyalar. Hər iki azot oksidi qələvi ilə reaksiya verir.
Oksid NO azot turşusu, azot oksidi (I) və azotun qələvi duzunu əmələ gətirir:
10NO + 6NaOH \u003d 6NaNO 2 + N 2 O + N 2 + 3H 2 O.
Oksid NO 2, iki turşunun qələvi duzları ilə birləşir - azot və azot:
2NO 2 + 2NaOH \u003d NaNO 3 + NaNO 2 + H 2 O.
Gizli oksidləşmə vəziyyətlərimizə qayıdaq. Sərbəst hərəkət edə biləcəyiniz "qaz" vəziyyətindən oksigen azot birləşmələrinin "sulu məhlul" vəziyyətinə keçməsi zamanı kollektivizmin çiçəkləndiyi, qütb su molekullarının mövcud olduğu və aktiv olduğu yerlərdə heç kim molekulun, atomun və ionun olmasına imkan vermir. təklikdə "istiqamət dəyişikliyi" var. Tək qrupun bir elementinə uyğun olduğu kimi, tək oksidləşmə vəziyyətləri sabit olur. (Lakin sabitdir. Nit turşusu, məsələn, yalnız məhlulda mövcud ola bilər, əks halda parçalanır. Lakin azot oksidlərinə (II) və (IV) şəklində uyğun olan turşular ümumiyyətlə yoxdur. Hər şey müqayisədən məlumdur.)
Maraqlıdır ki, NO 2 açıq turşu oksidi qələvi ilə reaksiya vermir, həm də YOX - xassəli və oksidləşmə vəziyyətində qeyri-turşu, digər oksidləşmə vəziyyətinin birləşmələri - qəribə! Sirr? Olduqca!
Azotlu hidroksid (V) molekulunun quruluşu - azot turşusu
Azotlu hidroksidlərdən birini, ancaq ən çox tonajı - azot turşusunu nəzərdən keçirəcəyik.
Nitrik turşu molekulu qütbdür (ilk növbədə oksigen və hidrogenin fərqli elektronitetliliyinə görə, azot olduğu kimi, molekulun içərisində gizlidir) və asimmetrikdir. Azotun oksigenlə əlaqələri arasındakı mövcud üç bucaq fərqlidir. Azotun formal oksidləşmə vəziyyəti ən yüksəkdir, yəni +5. Lakin bu vəziyyətdə, azot atomunda digər atomlarla cəmi dörd əlaqə - azotun valentliyi dörddür. Başqa bir sirr.
Bunun necə baş verə biləcəyi aydındır atom valentliyi sayca oksidləşmə vəziyyətindən çoxdur. Bunun üçün molekuldakı eyni atomlar arasında bir əlaqə yaratmaq kifayətdir. Məsələn, hidrogen peroksiddə oksigen iki valensiyaya malikdir və oksidləşmə vəziyyəti yalnız –1. Oksigen, hidrogenlə ortaq elektron əlaqəni özünə daha yaxın bir şəkildə çəkə bildi və iki oksigen atomunun cüt cütü ortada yerləşdi. Ancaq necə etmək olar atom valentliyi idi az oksidləşmə?
Düşünək: azot turşusu molekulu necə işləyir? Molekulun quruluşunu onun hazırlanması prosesini nəzərə alsanız başa düşmək daha asandır. Nitrik turşusu azot oksidinin (IV) su ilə reaksiyasından əldə edilir (oksigen olduqda): iki NO 2 molekul eyni zamanda su molekulunu açılmamış elektronları ilə "vurur", nəticədə hidrogenin oksigenlə bağlantısı hər zamankı kimi pozulur (oksigendəki bir cüt elektron və "çılpaq") proton ") və" vicdanla "- NO 2 molekulu elektronu ilə hidrogen alır, digəri - OH radikal (Şəkil 6). İki turşu əmələ gəlir: hər iki turşu güclüdür, ikisi də tez bir zamanda protonlarını ən yaxın su molekullarına verir və nəticədə və ion şəklində qalırlar. İon sabit deyil, iki HNO 2 molekul suda parçalanır, NO 2 və NO. NO oksid yalnız azot turşusu alınana qədər oksigen ilə reaksiya verir, NO 2-yə çevrilir və s.
Formal olaraq, bir oksigen atomu ilə azot atomunun ikiqat bağlantı, digəri ilə adi tək bir əlaqə ilə əlaqəli olduğu ortaya çıxır (bu oksigen atomu hidrogen atomu ilə də bağlıdır). HNO 3-dəki azot bir donor qəbuledici bağı ilə üçüncü bir oksigen atomuna bağlanır və azot atomu bir donor rolunu oynayır. Azot atomunun hibridləşməsi olmalıdır sp 2 quruluşu düz bir üçbucaq olduğunu təyin edən ikiqat bir bağın olması səbəbiylə. Əslində, azot atomunun və üç oksigen atomunun parçası düz üçbucaq olduğu ortaya çıxır, yalnız azot turşusunun molekulunda bu üçbucaq səhvdir - üç ONO bucağının hamısı fərqlidir, buna görə də üçbucağın fərqli tərəfləri. Molekul dağılanda üçbucaq müntəzəm, bərabər tərəfli olur. Beləliklə, içindəki oksigen atomları ekvivalent olur! Bütün istiqrazlar eyni olur (ikiqat istiqraz vahid bir istiqrazdan daha qısadır). Necə?
Gəlin əsaslandıraq. sp 2- Azot atomunun hibridləşməsi eyni növ hibridləşmə və oksigen atomlarının yaranmasına səbəb olur. Hibridləşmədə iştirak etməyən və dörd atomun hamısında mövcud olan p-orbitalılar arasında bir planar quruluş əldə edilir.
İndi valent elektronların ümumi sayı ilə məşğul olacağıq: bir ionun tərkibində beş elektron azot, üç oksigen atomu üçün altı və bütövlükdə iona cəmi iyirmi dörd olan bir yük verən daha bir element var. Bunlardan altı elektron üç vahid istiqrazın əmələ gəlməsi üçün tələb olunur, on iki elektron hibrid orbitlərdə molekulun perimetri boyunca yerləşir (hər oksigen atomu üçün iki elektron cüt), altı elektron eyni dördü üçün qalır səhHibridləşmədə iştirak etməyən orbitals. Bu vəziyyətdə mümkün olan yeganə ağlabatan izahat, elektronlarının bütün atomlarının tək bir elektron buluduna sosiallaşmasıdır (Şəkil 7). Bu, kiçik atom radiusu və kiçik interatomik məsafələr tərəfindən asanlaşdırılır. Və simmetriya ümumiyyətlə enerji baxımından faydalıdır və buna görə bütövlükdə strukturun dayanıqlığını artırır. Bu, elektronların bir neçə atomla ictimailəşməsinin yeganə işi deyil, oxşar "kollektiv elektron iqtisadiyyat" üzvi kimya, məsələn, aromatik birləşmələrdə tapılmışdır.
Bununla birlikdə, molekulun quruluşu haqqında fikirlərə əsaslanaraq nitrat turşusunun xüsusiyyətlərinin proqnozlarına qayıdırıq. Bir ion şəklində olmağın açıq üstünlüyü yalnız sulu bir məhlulda turşu dissosiyasiyasının yüksək dərəcəsini deyil, eyni zamanda susuz turşunun dağılma ehtimalını da izah edir. Bu maddənin fiziki xüsusiyyətlərini təyin edən dissosiasiya.
Azot turşusunun fiziki xüsusiyyətləri
İonlaşmış birləşmə, qismən olsa belə, qaza çevrilmək çətindir. Beləliklə, qaynama nöqtəsi kifayət qədər yüksək olmalıdır, lakin bu qədər kiçik bir molekulyar çəki ilə (və yüksək hərəkətliliyə görə) ərimə temperaturu yüksək olmamalıdır. Buna görə 20 ° C-də toplama vəziyyəti maye olur.
Suda həll olma vəziyyətinə gəldikdə, bir çox digər qütblü mayelər kimi, nitrat turşusu su ilə istənilən nisbətdə asanlıqla qarışdırılır.
Saf nitrat turşusu rəngsiz və qoxusuzdur. Ancaq tərkibində həll olan oksigen və nitrat oksidinə (IV) parçalanması səbəbindən adi konsentratlı nitrat turşusunun sarı-qəhvəyi rəngə və NO 2-yə kəskin iy verən bir xüsusiyyətə sahib olduğunu söyləmək olar.
Nitrik turşu molekulunun quruluşunun kimyəvi xüsusiyyətlərinə necə təsir etdiyini görək.
Azot turşusunun kimyəvi xüsusiyyətləri
Diqqət etməli olduğumuz əsas şey azot atomunun ən yüksək dərəcədə oksidləşməsinin olması azot turşusunun xüsusiyyətlərini məhdudlaşdırır, oksidləşdirici maddələrlə reaksiya vermir. Lakin azaldan maddələrlə, ilk növbədə metallarla qeyri-ənənəvi və dəyişkən reaksiya göstərir.
1. Metallarla reaksiyalar. Azot turşusu metallarla hətta seyreltilmiş məhlullarda da güclü oksidləşdirici maddə kimi reaksiya verir (sulfid turşusundan fərqli olaraq, oksidləşdirici xüsusiyyətlərini yalnız konsentrat şəklində göstərir). Adətən bir metal nitrat əmələ gəlir, ancaq hidrogen əvəzinə qazlı azot birləşmələri buraxılır: NO 2, NO, N 2 O, N 2 və ya dərhal bir turşu mühitdə ammonium ionuna çevrilən ammonyak. Prinsipcə, metalın azot turşusu ilə reaksiyasında bütün bu "dəstə" qazlar əmələ gəlir, lakin metaldan və turşunun konsentrasiyasından asılı olaraq müəyyən komponentlər üstünlük təşkil edəcəkdir.
Belə ki, laboratoriya şəraitində, azot oksidi (II), mis qırıntılarının azot turşusu ilə 1,2 q / sm 3 sıxlığı ilə qarşılıqlı təsiri ilə əldə edilir, yəni mis qazlı reaksiya məhsullarında seyreltilmiş turşu ilə qarışdırıldıqda, bu oksid aydın şəkildə üstünlük təşkil edir:
Lakin eyni sıxlıqdakı (və buna görə konsentrasiyada) azot turşusunun dəmirlə reaksiyasında, qarışıqdakı azot oksidinin (II) tərkibi yalnız 40% - yarısından az, qalan 60% ammonium nitrat, azot, azot oksidi arasında bərabər paylanır (I ) və azot oksidi (IV) (Şəkil 8).
Belə bir maraqlı və həyati bir faktı qeyd etmək lazımdır ki, nə dəmir, nə də alüminium 100% nitrat turşusu ilə reaksiya vermir (buna görə də bu metallardan hazırlanmış tanklarda və digər qablarda saxlanıla və daşınar). Fakt budur ki, bu metallar saf turşuda həll olunmayan oksidlərin davamlı filmləri ilə örtülmüşdür. Turşu xüsusiyyətlərinin təzahürü üçün turşunun nəzərəçarpacaq dərəcədə dağılması və bunun üçün su tələb olunur.
2. Qeyri-metallarla reaksiyalar.Azot turşusu oksigen və ozon ilə reaksiya vermir.
3. Su ilə reaksiya olmur.Su yalnız turşu dağılmasını təşviq edir.
4. Turşularla reaksiyalar.Azot turşusu metabolik və ya mürəkkəb reaksiya kimi digər turşularla reaksiya vermir. Bununla birlikdə, güclü bir oksidləşdirici maddə kimi reaksiya verməyə qadirdir. Konsentrləşdirilmiş azot və hidroklor turşularının qarışığında tənliklə ümumiləşdirilə bilən geri dönüşlü reaksiyalar meydana gəlir:
![]()
Yaranan atom xloru çox aktivdir və metal atomlarından asanlıqla elektron alır və "onun yanında" olan xlorid ionu meydana gələn metal ionları ilə sabit kompleks ionlar əmələ gətirir. Bütün bunlar, hətta qızılları məhlula çevirməyə imkan verir. Qızılın "metalların kralı" olduğuna görə, konsentratlaşdırılmış azot və xlor turşularının qarışığı aqua regia adlanır.
Konsentratlı kükürd turşusu güclü bir su aparıcı vasitə olaraq, azot turşusunun azot oksidinə (IV) və oksigenə parçalanmasına kömək edir.
5. Əsaslarla və əsas oksidlərlə reaksiyalar.. Azot turşusu güclü qeyri-üzvi turşulardan biridir və qələvi ilə təbii reaksiya göstərir. Həm də həll olunmayan hidroksidlər və əsas oksidlərlə reaksiya verir. Bu reaksiyalar eyni zamanda nitrat turşusunun bütün duzlarının suda yaxşı həll olmasına imkan verir, buna görə reaksiya məhsulları onun gedişinə müdaxilə etməyəcəkdir.
Saylarında NO, NO 2 və HNO 3 birləşmələrinin fiziki xüsusiyyətləri
Azot oksidi (II) YOX. Molar kütləsi 30 q / mol. Ərimə nöqtəsi -164 ° C, qaynama nöqtəsi -154 ° S. Normal şəraitdə (0 ° C, 1 atm) qazsız NOun sıxlığı 1.3402 q / l təşkil edir. Atmosfer təzyiqində və 20 ° C-də həllolma 100 q suya 4,7 ml NO qaza bərabərdir.
Azot oksidi (IV.)) YOX 2. Molar kütləsi 46 q / mol. Ərimə nöqtəsi -11 ° С, qaynama temperaturu 21 ° С. Qazlı NO 2-nin sıxlığı n at. 1.491 q / l. Çözünürlük - bu oksidin əvvəlcə havada su ilə reaksiya verməsi və sonra yaranan nitrat turşusunun əriməsi şərti ilə məhdudiyyətsiz sayıla bilər (60% HNO 3 meydana gəlməsinə qədər).
Azot oksidi (IV) aktiv şəkildə rəngsizləşdiyindən (140 ° C-də tamamilə NO 2 monomer şəklində olur, lakin 40 ° C-də monomer artıq 30% qalır və 20 ° C-də demək olar ki, tamamilə N 2 O 4 dimerinə keçir). , onda fiziki xüsusiyyətlər bir monomerdən daha çox bir dimer ilə əlaqələndirilir. Bu, olduqca yüksək qaynama nöqtəsini izah edə bilər (N 2 O 4 olduqca ağır bir molekuldur). Dimerizasiya dərəcəsini rəngə görə qiymətləndirmək olar: monomer sıx rənglidir, dimer isə rəngsizdir.
Azot turşusuHNO 3. Molar kütləsi 63 q / mol. Ərimə nöqtəsi –41.6 ° С, qaynama temperaturu 83 ° С. Maye 100% turşunun sıxlığı 1,513 q / sm 3-dir. Çözünürlük məhdud deyil, başqa sözlə turşu və su istənilən nisbətdə qarışdırılır. Nitrik turşu məhlullarının təmiz su və turşunun qaynar nöqtələrindən yuxarı olan temperaturda qaynadıqlarını qeyd etmək lazımdır. Maksimum temperaturda (122 ° C) 68.4% həll qaynar, həll və buxarın faiz tərkibi eynidır.
Buxarın qaynama zamanı tərkibi mayenin tərkibinə uyğun olduğu maddələrin qarışıqlarına azeotrop və ya ayrılmaz deyilir. ("Azeotrope" sözü yunan dilindən gəlmişdir. - qaynatmaq, - dəyişdirmək, - mənfi prefiks.) Az miqdarda turşu konsentrasiyası üçün buxarda suyun miqdarının artması məhlulun konsentrasiyasına səbəb olan məhlulla müqayisədə xarakterikdir. Daha yüksək konsentrasiyalarda, əksinə, buxar tərkibi turşu ilə zənginləşdirilir.
Azot birləşmələrinin kimyəvi xüsusiyyətləri (əlavə)
Aralıq bir oksidləşmə vəziyyəti olan bir atom olan hər hansı digər maddə kimi, azot oksidləri (II) və (IV), azot turşusundan fərqli olaraq, reaksiya tərəfdaşından asılı olaraq həm oksidləşdirici, həm də azaldıcı maddələr kimi çıxış edə bilər. Ancaq bu reaksiyaların çoxu "əlaqəsizdir" və buna görə də zəif öyrənilmişdir.
"Müvafiq" reaksiyalardan, suyun iştirakı ilə azot oksidinin (IV) kükürd oksidi (IV) ilə reaksiyasını qeyd etmək lazımdır:
Bu reaksiya aktuallıq kəsb edir, çünki kükürd (IV) oksidinə əlavə oksigen yalnız yüksək temperaturda və katalizatorun iştirakı ilə baş verir, azot oksidinə (II) oksigen əlavə edilməsi adi şəraitdə baş verir. Beləliklə, azot oksidi (IV) sanki kükürd oksidinin oksigen bağlamasına kömək edir. Bu reaksiya adi şərtlərdə davam edir (qarışıqda əlavə təzyiq və istiləşmə tələb olunmur).
Azot oksidi (II) eyni zamanda kükürd dioksidi (IV) ilə reaksiya verir, lakin tamamilə fərqli şərtlərdə: ya 500 atmosfer təzyiqində (!), sonra kükürd oksidi (VI) və azot alınır, ya da sulu bir məhlulda sonra sulfat turşusu və azot oksidi əldə edilir (I )
Azot oksidi (I) Həddindən artıq xoş bir qoxu və şirin dadı var. Oksigen, su, turşu və qələvi məhlulları ilə reaksiya vermir. 500 ° C-dən yuxarı temperaturda elementlərə parçalanır, başqa sözlə, olduqca sabitdir.
Molekulun quruluşu maraqlıdır: xətti molekul mərkəzi azot atomunun tetravalent olduğu O \u003d N \u003d N-dir. İki cüt bağ yaradır: biri kovalent bağ yaratmaq üçün tipik bir sxemə görə oksigenlə (iki elektron azot, iki elektron oksigen), digəri bir azot atomu ilə (üç açılmamış elektronlarından ikisini birləşdirir və boş bir orbital meydana gətirir), biri istiqrazların - kovalent, ikincisi - donor - qəbuledici (Şəkil 9).
 |
Şek. 9. |
Azot oksidi (III).NO və NO 2-dən ibarətdir, qoşulmamış elektronlarını cütləşdirdilər. Artıq ərimədən sonra (-101 ° С) müvafiq qazlara parçalanmağa başlayır.
Azot oksidi (V).Oksigen vasitəsilə bağlanan NO 2 qrupundan ibarətdir. Azot oksidindən (III) bir az daha sabit bir birləşmə otaq temperaturunda parçalanmağa başlayır. Təbii ki, içindəki istiqrazların bir hissəsi donor qəbul edəndir. Və heç bir "pentavalent azot".
Azot turşusunun kimyəvi xüsusiyyətlərinə əlavə olunmalıdır ki, oksidləşə biləcəyi qeyri-metallarla mükəmməl reaksiya göstərir. Beləliklə, konsentratlaşdırılmış nitrat turşusu kükürd, fosfor və kömürlə reaksiya verir və sırasıyla kükürd, fosfor və karbon turşuları əmələ gətirir.
Azot turşusunun üzvi maddələrlə reaksiyaları maraqlı və vacibdir. Məsələn, toluendəki üç hidrogen atomu NO 2 qrupu ilə əvəz edildikdə, trinitrotoluol (və ya sadəcə tol) meydana gəlir - partlayıcı.
Azot oksidlərinin və nitrat turşusunun ekoloji xüsusiyyətləri
Azot oksidi (I)nisbətən hərəkətsiz və buna görə "ekoloji cəhətdən neytral". Bununla birlikdə, insana yalnız əyləncədən başlayaraq ("gülən qaz" ləqəbi verildi) və tibbdə tətbiqini tapan dərin bir yuxu ilə bitən bir insana narkotik təsir göstərir. Maraqlıdır ki, zərərsizdir və tibbi anesteziya üçün azot oksidi (I) ilə oksigen qarışığı havadakı azot və oksigen nisbəti ilə eyni nisbətdə istifadə olunur. Narkotik təsir bu qazın inhalyasiyası dayandırıldıqdan dərhal sonra çıxarılır.
Digər iki azot oksidi asanlıqla bir-birinə, sonra turşulara, sonra isə anionlara keçir. Beləliklə, bu maddələr təbii miqdarda olduqda təbii mineral gübrələrdir. "Qeyri-təbii" miqdarda bu qazlar nadir hallarda yalnız atmosferə daxil olur. Bir qayda olaraq, kompleks şəkildə hərəkət edən zəhərli birləşmələrin bütöv bir "dəstəsi" əmələ gəlir.
Məsələn, gübrələrdən azot oksidləri, nitrat turşusu, ammonyak və tozdan əlavə, yalnız bir azot gübrəsi zavodunda kükürd oksidləri, flüor birləşmələri və bəzi üzvi birləşmələr yayılır. Elm adamları müxtəlif otlar, kollar və ağacların belə “buketlərə” müqavimətini öyrənirlər. Artıq məlumdur ki, təəssüf ki, ladin və şam qeyri-sabitdir və tez ölür, bununla birlikdə ağ akasiya, Kanadalı qovaq, söyüd və bir sıra digər bitkilər belə şəraitdə mövcud ola bilər, üstəlik bu maddələrin havadan çıxarılmasına öz töhfələrini verirlər.
Şiddətli azot oksidi zəhərlənməsi, əsasən müvafiq sənaye sahələrində qəza halında əldə edilə bilər. Bu qazların xüsusiyyətlərindəki fərqlərə görə bədənin cavabı fərqli olacaqdır. "Kaustik" NO 2, ilk növbədə nazofarenksin, gözlərin selikli qişasına təsir göstərir, ağciyər ödeminə səbəb olur; YOX, suda seyrək və kaustik deyil, ağciyərlərdən keçir və qan dövranına daxil olur, mərkəzi və periferik sinir sistemlərində pozğunluq yaradır. Hər iki oksid müxtəlif yollarla olmasına baxmayaraq qan hemoglobinə reaksiya verir, lakin eyni nəticə ilə - hemoglobin oksigen almağı dayandırır.
Nitrik turşunun ekoloji xüsusiyyətləri iki "yarıdan" ibarətdir. Güclü bir turşu olaraq, təkcə canlı toxumalara (insan dərisi, bitki yarpağı) deyil, həm də torpağa da dağıdıcı təsir göstərir - turşu (azot və kükürd oksidlərinin olması səbəbindən) yağışlar, təəssüf ki, nadir deyil. Dəridə turşu olarsa, kimyəvi bir yanma meydana gəlir, bu daha ağrılı və termaldan daha uzun müddət sağalır. Bunlar əsas ekoloji xüsusiyyətlər idi. hidrogen kationu.
Tədqiqata keçək anion . Güclü bir turşunun təsiri altında məhz bu turşu xüsusiyyətləri ön plana çıxır, buna görə anionun xüsusiyyətləri duzların nümunəsi ilə ən yaxşı şəkildə nəzərə alınır.
Nitrat ionunun fauna və flora ilə qarşılıqlı təsiri. Fakt budur ki, nitrat ionu təbiətdəki azot dövrünün tərkib hissəsidir, həmişə mövcuddur. Adi şəraitdə və seyreltilmiş məhlullarda sabitdir, zəif oksidləşmə xüsusiyyətlərinə malikdir, metal kationları çökdürmür və beləliklə bu ionların məhlulda torpaqda, bitkilərdə və s. Daşınmasını asanlaşdırır.
Nitrat ionu yalnız digər maddələrin balansını pozan çox miqdarda zəhərli olur. Məsələn, bitkilərdə nitratların çox olması ilə askorbin turşusunun miqdarı azalır. (Xatırlatmaq yerinə düşər ki, canlı bir orqanizm o qədər incə qurulmuşdur ki, çox miqdarda hər hansı bir maddə tarazlığı pozur və buna görə də zəhərli olur.)
Bitkilər və bakteriyalar zülallar və digər zəruri üzvi birləşmələr yaratmaq üçün nitratlardan istifadə edirlər. Bunu etmək üçün nitrat ionunu ammonium ionuna çevirin. Bu reaksiya metal ionları (mis, dəmir, manqan və s.) Olan fermentlər tərəfindən katalizləşdirilir. Bitkilərdə ammonyak və ammonium ionunun daha çox toksikliyi səbəbindən, ammonium ionunun nitrata çevrilməsinin əks reaksiyası yaxşı inkişaf etmişdir.
Heyvanlar lazım olan bütün üzvi birləşmələri qeyri-üzvi olanlardan necə quracağını bilmirlər - uyğun fermentlər yoxdur. Ancaq mədə və bağırsaqlarda yaşayan mikroorqanizmlər bu fermentlərə sahibdirlər və nitrat ionunu nitrit ionuna çevirə bilərlər. Fe 2+ -dən Fe 3+ -ə qədər hemoglobində dəmir çevirərək, bir zəhər olaraq hərəkət edən nitrit ionudur.
Fe 3+ olan və methemoglobin adlı bir birləşmə hava oksigenini çox möhkəm bağlayır, buna görə də onu toxumalara verə bilməz. Nəticədə, bədən oksigen çatışmazlığından əziyyət çəkir, beyin, ürək və digər orqanların işində pozğunluqlar olur.
Adətən, nitrit ionu mədədə deyil, bağırsaqda əmələ gəlir və qan dövranına girməyə vaxt tapmır və bütün bu məhvləri əmələ gətirir. Buna görə nitrat zəhərlənməsi olduqca nadirdir. Ancaq başqa bir təhlükə var: bədənimizdə ammonyakın hidrogen atomlarının üzvi radikallarla əvəz olunduğu bir çox maddə var. Belə birləşmələrə amin deyilir. Aminlərin nitrit ionları ilə reaksiyası zamanı nitrosaminlər əmələ gəlir - kanserogenlər:
Qaraciyər üzərində hərəkət edirlər, ağciyərlərdə və böyrəklərdə şişlərin meydana gəlməsinə kömək edirlər. Askorbin turşusunun tanış inhibitorunun nitrosaminlərin meydana gəlməsi reaksiyasının aktiv inhibitoru olması maraqlıdır.
O.R. VALEDINSKAYA
(Moskva Dövlət Universiteti, Moskva)