Nəzəri giriş. Emissiya spektrlərinin üç növü var: xətt, zolaqlı və davamlı. "Atom spektrləri" mövzusunda fizikadan təqdimat. Hansı cisimlər zolaqlı spektrlərlə xarakterizə olunur
Emissiya spektrlərinin üç növü var - xətt, zolaqlı və davamlı. Xətt spektrləri ayrı-ayrı atomların və ya ionların buraxdığı hallarda müşahidə olunur. Onlar müəyyən bir maddə üçün xarakterik olan, qaranlıq boşluqlarla ayrılmış bir sıra xətlərdən ibarətdir. Hər bir xətt monoxromatik adlanan xüsusi dalğa uzunluğuna uyğundur. Xətt spektrləri atom daxilində baş verən hadisələri xarakterizə edir.
Zolaqlı spektrlər molekullar tərəfindən yayılır. Qrup bir-birinə yaxın məsafədə yerləşən spektral xətlər silsiləsidir. Zolaqlı spektrlərin emissiyası molekulun enerji vəziyyətlərinin təcrid olunmuş atomun vəziyyətləri ilə müqayisədə mürəkkəbliyini göstərir, onu təşkil edən nüvələrin vibrasiya və fırlanma hərəkətləri ilə əlaqədardır.
Davamlı spektrlər bərk cisimlər tərəfindən yayılır. Bu spektrlərin davamlı təbiəti bərk cismi təşkil edən hissəciklərin güclü qarşılıqlı təsirinin nəticəsidir.
Xətt spektrinin növü müvafiq kimyəvi elementin atomunun quruluşundan asılıdır, buna görə də bütün kimyəvi elementlər həm xətlərin sayına, həm də dalğa uzunluqlarına görə bir-birindən fərqlənən ciddi şəkildə müəyyən edilmiş xətt spektrlərinə malikdirlər. Ən sadə xətt spektri ən sadə quruluşa malik olan hidrogen atomu tərəfindən istehsal olunur. Bu spektrə xas olan nümunələrin izahatlarının axtarışı atomun kvant mexaniki nəzəriyyəsinin yaradılmasına gətirib çıxardı.
Hər şeydən əvvəl qeyd etmək lazımdır ki, hər hansı bir atomun, o cümlədən hidrogen atomunun emissiya spektrindəki xətlər təsadüfi yerləşməyib, sıra adlanan qruplara birləşdirilə bilər. Bu silsilələrdəki xətlərin düzülüşü müəyyən nümunələrə tabedir. Hidrogen atomunun spektrinin görünən hissəsində bu Balmer seriyası, ultrabənövşəyidə - Lyman seriyası, yaxın infraqırmızıda - Paşen seriyası və s. Bu seriyaların hər birindəki xətlərin l dalğa uzunluqları üçün eksperimental olaraq tapılmış düstur belədir:
Bu ümumiləşdirilmiş Balmer düsturu adlanır. Bu formulada R = 1,097×10 7 m -1- Rydberg sabiti, n Və m tam ədədlər. Verilən üçün n nömrə m-dən başlayaraq bütün tam dəyərləri qəbul edir n+1. Əgər n=1 düstur (1) Lyman seriyasını təsvir edir, n=2 Balmer seriyası, n=3- Paşen seriyası.
Bu formulun fiziki mənası Borun Plankın kvant fərziyyəsi və Ruterford atomunun klassik planet modeli əsasında yaratdığı hidrogen atomunun və hidrogen kimi atomların quruluşu nəzəriyyəsindən irəli gəlir. Bor inkişaf etdirdiyi nəzəriyyənin əsas müddəalarını irəli sürdü.
Birinci postulat: bir atomda atomun enerjisinin müəyyən dəyərlərinə uyğun gələn bir sıra diskret stasionar vəziyyətlər var: E 1, E 2, E 3,… . Stasionar vəziyyətdə atom nə enerji buraxır, nə də udur.
İkinci postulat: enerjinin emissiyası və udulması bir stasionar vəziyyətdən digərinə keçid zamanı baş verir. Bu vəziyyətdə bir kvant enerji buraxılır və ya udulur hn, iki stasionar vəziyyət arasındakı enerji fərqinə bərabərdir:
hn = E m - E n (2)
Harada h- Plank sabiti. İfadə (2) m vəziyyətindən n vəziyyətinə keçid zamanı atomun buraxdığı və ya udduğu monoxromatik şüalanmanın n tezliyini müəyyən edir (Bohr tezliyi şərti).
Bor nəzəriyyəsindəki diskret stasionar vəziyyətlər orbitləri kvantlaşdırmaq üçün xüsusi bir qaydadan istifadə edərək seçilmişdir, bu qayda aşağıdakı kimi tərtib edilmişdir: klassik mexanikaya görə mümkün olan bütün orbitlərdən yalnız elektronun bucaq impulsunun dəyərin çox olduğu orbitlər həyata keçirilir. üçüncü postulat):
Formula (3) m- elektron kütləsi; Vn- başına elektron sürəti n st stasionar orbit; r n- bu orbitin radiusu; n- tam ədəd: 1, 2, 3, ....
Borun ardınca Ze yüklü nüvədən və yüklü bir elektrondan ibarət atom sistemini nəzərdən keçirək - e.
At Z= 1, belə bir sistem hidrogen atomuna uyğundur, digər Z ilə - hidrogen kimi bir atom, yəni. bir elektrondan başqa hamısı çıxarılan atom nömrəsi Z olan atom. Hesablamaları sadələşdirmək üçün fərz edək ki, elektron dairəvi orbitdə fırlanır və nüvənin kütləsi elektronun kütləsi ilə müqayisədə sonsuz böyükdür, nüvə isə hərəkətsizdir.
Elektronu n-ci stasionar orbitdə saxlayan mərkəzdənqaçma qüvvəsi Kulonun nüvəyə cazibə qüvvəsi ilə yaranır.
Buradan: , (4)
olanlar. Bir elektron orbit boyunca hərəkət edərkən, onun kinetik enerjisi və potensial enerjisi əlaqə ilə əlaqələndirilir 2T = -U (5)
(4) tənliyini (3) tənliyinə bölərək n-ci stasionar orbitdə elektronun sürəti üçün ifadə alırıq.
N-ci stasionar orbitdə elektronun ümumi enerjisi (E) kinetik və potensial enerjilərdən ibarətdir və (5) düsturunu nəzərə alaraq, aşağıdakılara bərabərdir:
Sürətin (6) qiymətini bu düstura əvəz etməklə, atomun stasionar hallarının enerjiləri üçün aşağıdakı ifadəni alırıq:
Elektron m orbitindən n orbitinə keçdikdə (3) düsturuna uyğun olaraq bir kvant enerji buraxılır.
Beləliklə, spektral xəttin tezliyi
Spektroskopiyada adətən dalğa nömrələrindən istifadə olunur. Sonra
Hidrogen üçün (Z = 1) düstur (7) formasını alır:
və hidrogen atomunun spektral xətlərinin dalğa nömrələri üçün empirik olaraq tapılmış ümumiləşdirilmiş Balmer düsturu (1) ilə üst-üstə düşür. (1) və (8) düsturlarından belə nəticə çıxır
Bu qiymət Ridberq sabitinin eksperimental olaraq müəyyən edilmiş qiyməti ilə üst-üstə düşür.
Şəkil 1-də hidrogen atomunun enerji səviyyələrinin diaqramı və üç sıra spektral xətti göstərilir.
Daha yüksək səviyyələrdən n = 1 səviyyəsinə keçid ultrabənövşəyi Lyman seriyasından (I) radiasiyaya uyğundur, bunun üçün (8) düsturundan əldə edirik:
Burada m = 2, 3, 4, ...
Daha yüksək səviyyələrdən n = 2 səviyyəsinə keçid görünən Balmer seriyasından (II) radiasiyaya uyğundur:
Burada m = 3, 4, 5, ...
Daha yüksək səviyyələrdən n = 3 səviyyəsinə keçid infraqırmızı Paschen seriyasının (III) radiasiyasına uyğundur:
Burada m = 4, 5, 6, ...
Atom işığı udduqda elektronlar aşağı səviyyədən yuxarı səviyyələrə keçir. Bu zaman atom əsas vəziyyətdən həyəcanlanmış vəziyyətə keçir.
Bor nəzəriyyəsi daxili məntiqi uyğunsuzluqla xarakterizə olunurdu, ona görə də o, atom hadisələrinin ardıcıl tam nəzəriyyəsinə çevrilə bilmədi. Hazırda atom və molekulların spektrləri kvant mexanikası çərçivəsində izah olunur.
Kvant mexanikasında mikrohissəciklərin vəziyyətini təsvir etməyə yanaşma klassikdən əsaslı şəkildə fərqlənir. Klassik mexanikada olduğu kimi, hissəciyin kosmosdakı mövqeyini və onun trayektoriyasını birmənalı şəkildə müəyyən etməyə imkan vermir, çünki mikro aləmdə bu anlayışlar mənasını itirir, ancaq proqnozlaşdırır: bu hissəciyi müxtəlif vaxtlarda hansı ehtimalla aşkar etmək olar. kosmosdakı nöqtələr. Buna görə də kvant mexanikası statistik xarakter daşıyır.
Kvant mexanikasının riyazi aparatının əsasını sistemin vəziyyətinin təsvirinin bu vəziyyəti səciyyələndirən koordinatların və zamanın Y müəyyən funksiyası ilə həyata keçirildiyi ifadəsi təşkil edir. Bu funksiya dalğa funksiyası adlanır. Fiziki məna daşıyan dalğa funksiyasının özü deyil, dV həcm elementində obyektin (mikrohissəciklərin) aşkarlanması ehtimalını müəyyən edən modulunun kvadratıdır. Əgər Y funksiyası normallaşdırılıbsa, onda dw = |Y| 2 dV (9)
Dalğa funksiyasının xassələrini öyrənək. |Y|-nin fiziki mənası haqqında yuxarıda deyilənləri nəzərə alaraq 2 dalğa funksiyası, Y olmalıdır:
1. final, çünki ehtimal birdən çox ola bilməz;
2. birmənalı;
3. davamlı, çünki ehtimal birdən dəyişə bilməz.
Beləliklə, kvant mexanikasında sistemin vəziyyətini təsvir etmək üçün bu sistemin dalğa funksiyasını bilmək lazımdır. Qeyri-relativistik kvant mexanikasında əsas tənlik olan Şrödinger tənliyindən tapılır. Bu tənlik alınmayıb, lakin ümumi mülahizələrə əsaslanaraq irəli sürülüb. Onun etibarlılığı ondan əldə edilən nəzəri nəticələrin eksperimental faktlarla üst-üstə düşməsi ilə sübut edilir. Ümumiyyətlə, Schrödinger tənliyi aşağıdakı formaya malikdir:
Burada m- hissəcik kütləsi, U- əks işarə ilə alınan güc sahəsi potensialına bərabər olan koordinatların və zamanın funksiyası; i- xəyali vahid, - Laplas operatoru, .
Əgər hissəciyin yerləşdiyi qüvvə sahəsi stasionardırsa (zamandan asılı deyil), onda potensial U zamandan asılı deyil və xarici qüvvə sahəsində sözügedən hissəciyin potensial enerjisi mənasını alır. Bu halda, Y biri yalnız koordinatlardan, digəri isə yalnız zamandan asılı olan iki funksiyanın məhsulu kimi təqdim edilə bilər.
Burada E- stasionar sahə vəziyyətində zamanla dəyişməyən hissəciyin ümumi enerjisi.
Bu ifadəni funksiya üçün (10) tənliyinə əvəz etdikdən sonra y(x,y,z) aşağıdakı tənlik alınır:
stasionar vəziyyətlər üçün Şrödinger tənliyi adlanır.
Hidrogen atomunu kvant mexanikası baxımından nəzərdən keçirək. Nüvə sahəsindəki elektronun potensial enerjisinin qiymətini stasionar Şrödinger tənliyinə əvəz edək:
Bu halda tənlik (11) formasını alır:
Hidrogen atomunun nüvəsinin sahəsi sferik simmetriyaya malik olduğundan bu tənliyi sferik koordinat sistemində həll etmək məqsədəuyğundur. (r, j, Q). Həll dalğa funksiyasını iki funksiyanın məhsulu kimi təmsil edən dəyişənlərin ayrılması üsulu ilə həyata keçirilir, onlardan biri yalnız asılıdır. r, ikincisi isə yalnız bucaq koordinatlarından j , Q.
y(r,Q,j) = R(r)×Y(Q,j)
Bu təqdimatla, bir hissəciyin koordinat dəyərlərinə malik olma ehtimalı rəvvəl r+dr kvadratla müəyyən edilir |rR| 2.
Şrödinger tənliyinin (12) həlli aşağıdakı əsas nəticələrə gətirib çıxarır.
1. Hidrogen elektronu diskret enerji spektrinə malikdir. Enerjinin öz dəyərləri aşağıdakı ifadə ilə müəyyən edilir:
Harada n- hər hansı müsbət tam dəyəri alan əsas kvant nömrəsi ( n = 1, 2, 3, ...).
2. Elektronun orbital bucaq impulsu L yalnız aşağıdakı diskret dəyərlər seriyasını qəbul edə bilər:
Harada l- orbital (azimutal) kvant nömrəsi. Aşağıdakılardan istənilən qiymət ala bilər: l= 0, 1, 2, 3, ..., (n-1) - yalnız n dəyər. Vəziyyəti ilə l= 0 adətən s - dövlət, ilə adlanır l = 1 – R- vəziyyət, c l= 2 – d-dövləti, ilə l = 3 – f- vəziyyət və s.
3. Orbital bucaq impulsunu fəzada (z) fiziki olaraq seçilmiş istiqamətə nisbətən yalnız elə istiqamətləndirmək olar ki, onun bu istiqamətə proyeksiyası --ə çox olsun, buna görə də
m- maqnit kvant nömrəsi adlanır. Aşağıdakı dəyərləri qəbul edə bilər:
m=0, ±1, ±2, … , ± l- cəmi (2 l+ 1) dəyərlər.
Beləliklə, bir hidrogen atomunda bir elektronun vəziyyəti üç kvant nömrəsi ilə müəyyən edilir - əsas n, dövlətin enerjisini təyin edən E n; azimutal l, elektronun bucaq momentumunu xarakterizə edən L, və maqnit m, oriyentasiyanı müəyyən edən L məkanda seçilmiş istiqamətə nisbətən. Dövlətlər öz dalğa funksiyaları ilə təsvir olunur Yn, l, m bunlar Şredinger tənliyinin (18) həlləridir.
Schrödinger tənliyi qeyri-relativistikdir. Relyativistik effektləri nəzərə almaq (Dirak tənliyi) elektronun kvant nömrəsi ilə təyin olunan öz bucaq momentumunun - spininin mövcudluğuna gətirib çıxarır. s, 1/2-ə bərabərdir:
Fırının seçilmiş z istiqamətinə proyeksiyası 2s + 1= 2 müxtəlif qiymət ala bilər:
elektron spin proyeksiyasının kvant nömrəsi haradadır. Spin nəzərə alınmaqla, atomdakı elektronun vəziyyəti dörd kvant nömrəsi ilə xarakterizə olunur: kvant nömrələrinə n, l, m spin kvant nömrəsi əlavə edilməlidir Xanım.
Qeyd edək ki, atom dünyası hadisələri üçün xarakterik olan fiziki kəmiyyətlərin kvant mexanikasında diskretliyi təbii olaraq Şrödinger (Dirak) tənliyinin həllindən irəli gəlir, halbuki Bor nəzəriyyəsində o, mahiyyət etibarı ilə qeyri-müəyyənliyin əlavə şərtlərindən istifadə etməklə təqdim edilməli idi. klassik təbiət.
Hissə A. Düzgün cavabı seç:
A) Floresan lampa
B) televizor ekranı
B) İnfraqırmızı lazer
D) Közərmə lampası
A) Qızdırılan bərk maddələr üçün
B) Qızdırılan mayelər üçün
A) Qızdırılan bərk maddələr üçün
B) Qızdırılan mayelər üçün
D) Qızdırılan atom qazları üçün
B hissəsi. Hər biri üçün
A) Davamlı spektr
B) Xətt spektri
B) Band spektri
D) Absorbsiya spektrləri
Fizika 11 Test “Şüalanma növləri və spektrlər”
Hissə A. Düzgün cavabı seç:
A1. Hansı bədənin radiasiyası termaldir?
A) Floresan lampa
B) televizor ekranı
B) İnfraqırmızı lazer
D) Közərmə lampası
A2. Hansı cisimlər zolaqlı udulma və emissiya spektrləri ilə xarakterizə olunur?
A) Qızdırılan bərk maddələr üçün
B) Qızdırılan mayelər üçün
B) Yuxarıda göstərilən orqanlardan hər hansı biri üçün
D) Qızdırılan atom qazları üçün
D) Nadirləşmiş molekulyar qazlar üçün
A3. Hansı cisimlər xətti udma və emissiya spektrləri ilə xarakterizə olunur?
A) Qızdırılan bərk maddələr üçün
B) Qızdırılan mayelər üçün
B) Nadirləşmiş molekulyar qazlar üçün
D) Qızdırılan atom qazları üçün
D) Yuxarıda göstərilən orqanlardan hər hansı biri üçün
B hissəsi. Hər biri üçün xüsusiyyətləri uyğun spektr tipini seçir
- Spektrlər, atomları həyəcanlanmamış vəziyyətdə olan bir maddədən davamlı spektr yaradan bir mənbədən işığı ötürməklə əldə edilir.
- Fərqli və ya eyni rəngli, fərqli yerlərə malik fərdi xətlərdən ibarətdir
- Qızdırılmış bərk və maye maddələr, yüksək təzyiq altında qızdırılan qazlar buraxırlar.
- Molekulyar vəziyyətdə olan maddələr verin
- Atom vəziyyətində qazlar və aşağı sıxlıqlı buxarlar tərəfindən yayılır
- Çoxlu sayda bir-birinə yaxın olan xətlərdən ibarətdir
- Onlar müxtəlif maddələr üçün eynidir, ona görə də maddənin tərkibini müəyyən etmək üçün istifadə edilə bilməz
- Bu, müəyyən bir maddə tərəfindən udulmuş tezliklər toplusudur. Maddə işıq mənbəyi olmaqla, yaydığı spektrin həmin xətlərini udur
- Bunlar müəyyən diapazonun bütün dalğa uzunluqlarını ehtiva edən spektrlərdir.
- İşıq mənbəyinin kimyəvi tərkibini spektral xətlərlə mühakimə etməyə imkan verir
A) Davamlı spektr
27.02.2014 28264 0Hədəf: spektral analizin praktiki əhəmiyyətini göstərir.Şagirdləri zehni fəaliyyət prosesində çətinlikləri dəf etməyə təşviq etmək, fizikaya marağı inkişaf etdirmək.
Dərslər zamanı
I.Təşkilat vaxtı
II.Ev tapşırığını yoxlamaq.
IN Tomson modelinin mahiyyəti nədir?
- Rezerfordun alfa hissəciklərinin səpilməsi ilə bağlı təcrübəsinin diaqramını çəkin və izah edin. Bu təcrübədə nə görürük?
- Maddənin atomları tərəfindən alfa hissəciklərinin səpilməsinin səbəbini izah edin?
- Atomun planetar modelinin mahiyyəti nədir?
III. Yeni materialın öyrənilməsi
“Spektr” sözünü fizikaya Nyuton gətirmiş və ondan elmi əsərlərində istifadə etmişdir. Klassik latın dilindən tərcümə olunan "spektr" sözü "ruh", "tökmə" deməkdir, bu fenomenin mahiyyətini - rəngsiz günəş işığı şəffaf prizmadan keçəndə şənlik göy qurşağının görünüşünü olduqca dəqiq əks etdirir.
Bütün mənbələr ciddi şəkildə müəyyən edilmiş dalğa uzunluğunda işıq istehsal etmir. Radiasiyanın tezlik paylanması radiasiya intensivliyinin spektral sıxlığı ilə xarakterizə olunur.
Spektrlərin növləri
Emissiya spektrləri
Maddənin şüalanmasında olan tezliklər (və ya dalğa uzunluqları) toplusuna emissiya spektri deyilir. Üç növdə gəlirlər.
Möhkəmqırmızıdan müəyyən diapazonun bütün dalğa uzunluqlarını ehtiva edən spektrdir y k= 7,6 10 7 və bənövşəyi rəngə qədər
y f= 4-10 11 m Davamlı spektr qızdırılan bərk və maye maddələr, yüksək təzyiq altında qızdırılan qazlar tərəfindən buraxılır.
İdarə olundu -Bu, atom vəziyyətində qazların və aşağı sıxlıqlı buxarların yaydığı spektrdir. Fərqli və ya eyni rəngli, fərqli yerlərə malik fərdi xətlərdən ibarətdir. Hər bir atom müəyyən tezliklərdə bir sıra elektromaqnit dalğaları yayır. Buna görə də hər bir kimyəvi elementin öz spektri var.
zolaqlı -Bu, molekulyar vəziyyətdə olan bir qazın yaydığı spektrdir.
Xətt və zolaq spektrləri maddənin qızdırılması və ya elektrik cərəyanının keçməsi ilə əldə edilə bilər.
Absorbsiya spektrləri
Absorbsiya spektrləri davamlı spektr yaradan mənbədən işığın atomları həyəcansız vəziyyətdə olan maddədən keçməsi ilə əldə edilir.
Absorbsiya spektri - müəyyən bir maddə tərəfindən udulmuş tezliklər toplusudur. Kirchhoff qanununa görə, bir maddə işıq mənbəyi kimi yaydığı spektrin həmin xətlərini udur.
Spektral analizin kəşfi hətta elmdən uzaq insanlar arasında da böyük maraq doğurdu, o zamanlar bu, çox tez-tez baş vermirdi. Həmişə olduğu kimi, belə hallarda, boş həvəskarlar, Kirchhoff və Bunsendən çox əvvəl hər şeyi edən bir çox başqa elm adamı tapdılar. Bir çox sələflərindən fərqli olaraq, Kirchhoff və Bunsen kəşflərinin əhəmiyyətini dərhal anladılar.
İlk dəfə onlar aydın şəkildə başa düşdülər (və buna başqalarını da inandırdılar) spektral xətlərin maddənin atomlarına xas xüsusiyyət olduğunu.
18 avqust 1868-ci ildə Kirchhoff və Bunsenin kəşfindən sonra fransız astronomu Pierre-Jules-Cesar Jansen (1824-1907) Hindistanda günəş tutulması zamanı günəş tacının spektrində naməlum təbiətli sarı xətt müşahidə etdi. İki ay sonra ingilis fiziki Cozef Norman Lokyer (1836-1920) günəş tutulmalarını gözləmədən günəş tacını müşahidə etməyi öyrəndi və eyni zamanda onun spektrində eyni sarı xətti kəşf etdi. Onu yayan naməlum elementi helium, yəni günəş elementi adlandırdı.
Hər iki alim kəşfləri ilə bağlı Fransa Elmlər Akademiyasına məktub yazıb, hər iki məktub eyni vaxtda gəlib və 1868-ci il oktyabrın 26-da Akademiyanın iclasında oxunub. bu hadisənin şərəfinə qızıl medal - bir tərəfdən Jansen və Lokyerin profili, digər tərəfdən arabada tanrı Apollon və "Günəş qabarıqlıqlarının təhlili" yazısı.
Yer üzündə helium 1895-ci ildə William Ramsay tərəfindən torium minerallarında kəşf edilmişdir.
Emissiya və udma spektrlərinin tədqiqi maddənin keyfiyyət tərkibini təyin etməyə imkan verir. Bir birləşmədə elementin kəmiyyət tərkibi spektral xətlərin parlaqlığını ölçməklə müəyyən edilir.
Maddənin spektrindən onun keyfiyyət və kəmiyyət tərkibini təyin etmək üsuluna spektral analiz deyilir. Müxtəlif buxarların yaydığı dalğa uzunluqlarını bilməklə maddənin müəyyən elementlərinin mövcudluğunu müəyyən etmək mümkündür. Bu üsul çox həssasdır. Kütləsi 10~10 q-dan çox olmayan elementi aşkar etmək mümkündür.Spektral analiz elmdə böyük rol oynamışdır. Onun köməyi ilə ulduzların tərkibi öyrənildi.
Müqayisəli sadəliyinə və çox yönlülüyünə görə spektral analiz metallurgiya və maşınqayırmada maddənin tərkibinə nəzarət etmək üçün əsas üsuldur. Spektral analizdən istifadə etməklə filizlərin və mineralların kimyəvi tərkibi müəyyən edilir. Spektral analiz həm absorbsiya, həm də emissiya spektrlərindən istifadə etməklə həyata keçirilə bilər. Mürəkkəb qarışıqların tərkibi molekulyar spektrdən istifadə etməklə təhlil edilir.
IV. Öyrənilən materialın möhkəmləndirilməsi
- Xətt emissiya spektrləri bir-biri ilə qarşılıqlı əlaqədə olmayan həyəcanlı atomların yaranmasına səbəb olur. Hansı cisimlərin emissiya spektri xətti var? (Yüksək nadirləşdirilmiş qazlar və doymamış buxarlar.)
- Ağ-qaynar metallar və ərimiş metal hansı spektri əmələ gətirir? (Möhkəm.)
- Elektrik lampasının qırmızı-isti sarğıdan spektroskopdan istifadə edərək hansı spektri müşahidə etmək olar? (Möhkəm.)
- Elementar tərkibini təyin etmək üçün spektral analiz laboratoriyalarında hər hansı maddələr tədqiq olunan hansı birləşmə vəziyyətindədir? (Qaz halında.)
- Niyə eyni kimyəvi elementin udma spektrində qaranlıq xətlər xətti emissiya spektrinin rəngli xətlərinin yerlərində dəqiq yerləşir? (Hər bir kimyəvi elementin atomları yalnız özlərinin yaydıqları spektrin şüalarını udurlar.)
- Günəş spektrinin udma xətləri ilə nə müəyyən edilir? (Günəş atmosferinin kimyəvi tərkibi.)
V. Dərsi yekunlaşdırmaq
Ev tapşırığı
§ 54. Dərslikdən özünə nəzarət üçün suallar
1 seçim
1. Parıltı hansı radiasiya növünə (termal və ya lüminessent) aiddir?
1. qırmızı-qaynar metal tökmə; 2. flüoresan lampalar;
3. ulduzlar; 4. bəzi dərin dəniz balıqları.
A. 1, 3 – termal, 2, 4 – luminescent; B. 1, 2, 3, 4 – yalnız istilik;
V. 1, 2, 3, 4 və termal və luminescent; D. 1, 4 – istilik, 2, 3 – luminescent.
2. Bərk cisimlərin elektronlarla bombardmanı nəticəsində yaranan parıltı adlanır:
A. elektrolüminessensiya B. katodolüminesans C. istilik parıltısı
D. kimilüminesans D. fotolüminessensiya
3. Bir-biri ilə qarşılıqlı təsir göstərməyən həyəcanlanmış molekullardan ibarət cisimlər şüalar buraxır
4. Hansı cisimlər zolaqlı udulma və emissiya spektrləri ilə xarakterizə olunur?
B. Yuxarıda göstərilən cisimlərdən hər hansı biri üçün D. Qızdırılan atom qazları üçün
D. Nadirləşmiş molekulyar qazlar üçün
5. Davamlı (bərk) spektrlər yerləşən cisimlər tərəfindən verilir
A. yalnız bərk vəziyyətdə çox yüksək temperaturda;
B. molekulların bağlanmamış və ya zəif birləşdiyi qaz molekulyar vəziyyətdə
birlikdə;
V. atomların praktiki olaraq qarşılıqlı təsir göstərmədiyi qazlı atom vəziyyətində
birlikdə;
G. bərk və ya maye halda, həmçinin yüksək sıxılmış qazlarda
6. Qaz halında atom halında olan maddə verir:
A. şüalanmanın davamlı spektri B. şüalanmanın xətti spektri
B. zolaqlı emissiya spektri D. davamlı udma spektri
D. zolaqlı udma spektri
7. Spektral analiz müəyyən etməyə imkan verir:
A. maddənin kimyəvi tərkibi; B. bədən hərəkətinin sürəti; B. bədən həcmi;
G. bədən çəkisi; D. bədən istiliyi; E. hava təzyiqi.
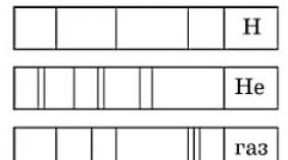
8 . Şəkildə Na, H, Ca və naməlum qazın udma spektrlərinin fotoşəkilləri göstərilir. By
Spektrlərə əsaslanaraq, naməlum qazın nəzərəçarpacaq miqdarda olduğunu söyləmək olar
A. natrium (Na), hidrogen (H), kalsium (Ca); B. hidrogen (H) və kalsium (Ca);
B. natrium (Na) və hidrogen (H); G. natrium (Na) və kalsium (Ca
Fizika 11 Test “Şüalanma növləri. Spektrlər"
Seçim 2
1. Atomların işıq saçmaq üçün itirdiyi enerjinin enerji ilə kompensasiya edildiyi radiasiya
şüalanan cismin atomlarının (və ya molekullarının) istilik hərəkətinə deyilir:
A. elektrolüminessensiya B. fotolüminessensiya C. istilik şüalanması
D. katodolüminesans D. kimilüminesans
2. Elektroluminesans enerjinin yaratdığı şüalanmadır
A. şüalanan bərk cismin səthini bombalayan elektronlar;
B. atomlarla toqquşan elektronlara ötürülən elektrik sahəsi
şüalanan bədən;
B. şüalanan cismin atomları tərəfindən udulmuş elektromaqnit dalğaları;
G. şüalanan cismin ionlarının elektrik qarşılıqlı təsiri zamanı ayrılır
3. Çox nadir qazların və doymamış buxarların həyəcanlanmış atomları, yox
bir-biri ilə qarşılıqlı əlaqədə olan spektrləri yayırlar:
A. zolaqlı; B. bərk; V. idarə edirdi.
4. Həyəcanlı, daim qarşılıqlı təsirdə olan molekul və ionlardan ibarət bərk cisimlər.
spektrləri yaymaq:
A. zolaqlı; B. bərk; V. idarə edirdi.
5. Hansı cisimlər xətti udma və emissiya spektrləri ilə xarakterizə olunur?
A. Qızdırılan bərk maddələr üçün B. Qızdırılan mayelər üçün
B. Nadirləşmiş molekulyar qazlar üçün D. Qızdırılan atom qazları üçün
D. Yuxarıda göstərilən orqanlardan hər hansı biri üçün
6. Qaz halında olan maddə, əgər qaz bir-biri ilə zəif birləşmiş molekullardan ibarətdirsə, verir:
A. xətti udma spektri B. davamlı emissiya spektri
B. zolaqlı emissiya spektri D. xətti emissiya spektri
D. davamlı udma spektri
7. Spektral analizdir
A. spektrin növü üzrə şüalanma növünün (termal, lüminessent və s.) təyini üsulu;
B. maddənin kimyəvi tərkibini onun spektrindən təyin etmək üsulu;
B. prizmanın və ya difraksiya barmaqlığının xassələrinin təhlili;
D. onun spektrindən maddənin aqreqasiya vəziyyətinin təyini
8. Şəkildə H, He, Sr və naməlum qazın emissiya spektrlərinin fotoşəkilləri göstərilir. Görünüşünə görə
spektrləri, naməlum qazın nəzərəçarpacaq miqdarda olduğunu ifadə etmək olar
A. hidrogen (H) və helium (He); B. hidrogen (H), stronsium (Sr) və helium (He);
B. stronsium (Sr) və hidrogen (H); G. stronsium (Sr) və helium (He)

"Ultrabənövşəyi şüalanma" - Bir qrup insanda fotoallergiyanın baş verməsi. Zərərli hərəkət. Ozon qatı. Dalğa uzunluğu - 10-dan 400 nm-ə qədər. UV radiasiyasının mühüm xüsusiyyəti onun bakterisid təsiridir. Radiasiya qəbulediciləri. Günəş, ulduzlar, dumanlıqlar və digər kosmik obyektlər. Dalğa tezliyi – 800*10? 3000*10 Hz-ə qədər. Mənbələr və qəbuledicilər.
"UV radiasiya" - 130 nm-ə qədər vakuum UV şüalanması. Ultrabənövşəyi radiasiya. Ultrabənövşəyi şüalanmanın spektri. Ultrabənövşəyi şüalanma mənbələri. Ultrabənövşəyi şüalanmanın bioloji təsiri. Məsələn, adi şüşə 320 nm-də qeyri-şəffafdır. Ultrabənövşəyi şüalar, ultrabənövşəyi şüalar. UV şüaları haqqında maraqlı faktlar.
"Radiasiyalar" - Orijinallik - radiasiyanın insanlara təsirinin nəzəri və fiziki mənasını çatdırır. Layihə başa çatdıqdan sonra tələbələr problemi həll etmək üçün dizayn təqdim etməlidirlər. Qiymətləndirmə meyarı. Müəllim təqdimatı. Layihənizi qoruyun. Elektromaqnit şüalanması insan orqanizminə necə təsir edir? Tədris və metodik material.
"Görünən radiasiya" - Radiasiya görünən işıqla müşayiət olunmadıqda ən təhlükəlidir. İnfraqırmızı şüalanma həyəcanlanmış atomlar və ya ionlar tərəfindən yayılır. Belə yerlərdə xüsusi göz qoruyucuları taxmaq lazımdır. Ərizə. İnfraqırmızı şüalanma 1800-cü ildə ingilis astronomu V.Herşel tərəfindən kəşf edilmişdir. İnfraqırmızı görünən radiasiyaya bitişikdir.
“Elektromaqnit şüalanmanın xüsusiyyətləri” - İnsan sağlamlığına təsir. Dalğa və tezlik diapazonu. Kəşf edənlər. Əsas xüsusiyyətlər. Elektromaqnit şüalanma. Kanyonun dibi. Qorunma üsulları. İnfraqırmızı şüalanma. Texnologiyada tətbiq. Radiasiya mənbələri.
"İnfraqırmızı və ultrabənövşəyi radiasiya" - Johann Wilhelm Ritter və Wollaston William Hyde (1801). Floresan lampalar Solaryum laboratoriyasında alətin kvarslanması. İnfraqırmızı fotoqrafiya (sağda damarlar görünür) İnfraqırmızı sauna. Havanı ionlaşdırır. Bakteriyaları öldürür. Günəş Merkuri-kvars lampaları. İnfraqırmızı və ultrabənövşəyi radiasiya. Kiçik dozalarda UVI.