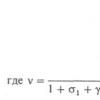Реакции окисления восстановления в аналитической химии. Использование реакций окисления-восстановления. Вопросы и упражнения
В анализе
Реакции окисления-восстановления широко используются в аналитической химии для различных целей: для открытия ионов, для разделения смеси ионов, для переведения малорастворимых осадков в раствор, для маскировки, для стабилизации растворов при хранении, для количественного определения.
1. Открытие катионов и анионов, разделение ионов.
Многие окислительно-восстановительные реакции сопровождаются ярко выраженным внешним эффектом, что дает возможность широко использовать их для обнаружения ионов. Так можно открыть катионы: Cu 2+ , Mn 2+ , Cr 3+ , Bi 3+ , Sb 3+ , Hg 2+ , Ag + , анионы: J - , Br - , SO 3 2 - , S 2 O 3 2 - и др. Ион висмута Bi 3+ можно открыть при приливании к щелочному раствору солей, содержащих катион Sn 2+ , исследуемого раствора, по появлению черного бархатистого осадка металлического висмута:
SnCl 2 + 4KOH = K 2 SnO 2 + 2KCl + 2H 2 O;
2Bi(NO 3) 3 + 3K 2 SnO 2 + 6KOH = 2Bi↓ + 6KNO 3 + 3K 2 SnO 3 + 3H 2 O;
2Bi 3+ + 3SnO 2 2 - + 6OH - → 2Bi↓+ 3SnO 3 2 - + 3H 2 O
Ион ртути Hg 2+ обнаруживают реакцией с медью по появлению на медной пластинке блестящего налета металлической ртути:
Hg(NО 3) 2 + Cu = Cu(NO 3) 2 + Hg↓;
Hg 2+ + Cu = Cu 2+ + Hg↓
На цинковой пластинке ионы Sb 3+ восстанавливаются до черного бархатистого осадка металлической сурьмы:
2SbCl 3 + 3Zn = 2Sb↓ + 3ZnCl 2
В отсутствии ионов висмута ионы сурьмы можно обнаружить по образованию оранжево-красного осадка сульфида сурьмы при взаимодействии с тиосульфатом натрия Na 2 S 2 O 3:
2SbCl 3 + 3Na 2 S 2 O 3 + 3H 2 O = Sb 2 S 3 ↓ + 3H 2 SO 4 + 6NaCl
Окисление катионов Mn 2+ оксидом свинца (IV) или персульфатом аммония (NH 4) 2 S 2 O 8 позволяет селективно открывать этот катион по появлению малинового окрашивания за счёт образующегося аниона MnO 4 - :
2Mn(NO 3) 2 + 5PbO 2 + 4HNO 3 = 2HMnO 4 + 5Pb(NO 3) 2 + 2H 2 O
2MnSO 4 + 5(NH 4) 2 S 2 O 8 + 8H 2 O = 2HMnO 4 + 5(NH 4) 2 SO 4 + 7H 2 SO 4
Окисление катиона Cr 3+ персульфатом аммония (NH 4) 2 S 2 O 8 в кислой среде идёт до дихромат-иона Cr 2 O 7 2 - , придающего раствору оранжевый цвет:
Cr 2 (SO 4) 3 + 3(NH 4) 2 S 2 O 8 + 7H 2 O (NH 4) 2 Cr 2 O 7 + 2(NH 4) 2 SO 4 + 7H 2 SO 4
Используя в качестве восстановителя ион Mn 2+ , в щелочной среде по моментальному почернению пятна капельным методом открывают в растворе ион серебра Ag + : Ag + + Cl - = AgCl¯
2AgCl + Mn(NO 3) 2 + 4NaOH = 2Ag¯ + 2NaCl + MnO(OH) 2 + 2NaNO 3 + H 2 O
В качестве восстановителей чаще всего используют металлы (Zn, Fe, Al, Cu), пероксид водорода H 2 O 2 в кислой среде, тиосульфат натрия Na 2 S 2 O 3 , сероводород H 2 S, сернистую кислоту H 2 SO 3 и другие вещества, легко отдающие электроны.
Из окислителей наиболее широко применяют дихромат калия K 2 Cr 2 O 7 , перманганат калия KMnO 4 , хлорную воду, пероксид водорода в щелочной среде, азотную кислоту, соли азотной кислоты, оксид свинца (IV) PbO 2 и др.
При проведении анализа необходимо учитывать, что ионы восстановителей Fe 2+ , I - , S 2 - , SO 3 2 - не могут сосуществовать в растворе с ионами окислителей NO 2 - , Fe 3+ , Sn 4+ , MnO 4 - , Cr 2 O 7 2 - .
В ходе анализа, используя в качестве окислителя пероксид водорода в щелочной среде, можно отделить ионы Mn 2+ , Fe 2+ от ионов Zn 2+ , Al 3+ :
2Fe(NO 3) 2 + H 2 O 2 + 4NaOH = 2Fe(OH) 3 ¯ + 4NaNO 3
Mn(NO 3) 2 + H 2 O 2 + 2NaOH = MnO(OH) 2 ¯ + 2NaNO 2 + 2H 2 O
Ионы Mn 2+ и Fe 2+ связываются в осадок, а в растворе остаются ионы, содержащие алюминий и цинк.
Подобным образом, используя H 2 O 2 в щелочной среде, можно разделить ионы Mn 2+ и Mg 2+ :
Mg(NO 3) 2 + 2NaOH = Mg(OH) 2 ¯ + 2NaNO 3
При обработке образующихся осадков раствором хлорида аммония гидроксид магния растворяется, а MnO(OH) 2 остаётся в осадке.
Сульфит-ион SO 3 2 - можно открыть, восстановив его металлическим цинком в кислой среде до сероводорода:
Na 2 SO 3 + 2HCl = 2NaCl + SO 2 + H 2 O
SO 2 + 3Zn + 6HCl = H 2 S + 3ZnCl 2 + 2H 2 O
Иодная вода при взаимодействии с растворами сульфитов обесцвечивается:
Na 2 SO 3 + I 2 + H 2 O = 2HI + Na 2 SO 4 .
Нитрит–ионы NO 2 - в кислой среде окисляют ионы I - до свободного йода, который обнаруживают по посинению раствора крахмала:
2NaNO 2 + 2NaI + 2H 2 SO 4 = I 2 ¯ + 2Na 2 SO 4 + 2NO + 2H 2 O
Нитрат–ион можно открыть сульфатом железа (II) в среде концентрированной серной кислоты по образованию соли железа SO 4 бурого цвета:
2HNO 3 + 6FeSO 4 + 3H 2 SO 4 = 3Fe 2 (SO 4) 3 + 2NO + 4H 2 O
FeSO 4 + NO = SO 4
2. Растворение малорастворимых соединений.
При растворении металлов, сплавов, многих труднорастворимых осадков также используются окислительно–восстановительные реакции:
Zn + 2HCl = ZnCl 2 + H 2
3PbS + 6HCl + 2HNO 3 = 3PbCl 2 ¯ + 3S¯ + 2NO + 4H 2 O.
3. Маскировка.
Например, для обнаружения карбонатов в присутствии сульфитов к исследуемому раствору добавляют несколько капель разбавленной серной кислоты и раствор перманганата калия, выделяющийся газ пропускают через известковую воду. О наличии иона CO 3 2 - судят по помутнению известковой воды. Раствор перманганата калия окисляет SO 3 2 - в SO 4 2 - , что исключает образование SO 2 , который так же, как и CO 2 вызывает помутнение известковой воды:
Na 2 CO 3 + H 2 SO 4 = Na 2 SO 4 + CO 2 + H 2 O
CO 2 + Ca(OH) 2 = CaCO 3 ¯ + H 2 O
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O
4. Для стабилизации растворов легко восстанавливающихся или окисляющихся реагентов в них вводят соответствующие восстановители или окислители. Например, в растворы солей олова (II) для предупреждения окисления до Sn 4+ вводят металлическое олово, в растворы солей Fe 2+ - металлическое железо или аскорбиновую кислоту, в растворы солей Hg 2 2+ - металлическую ртуть.
Растворы некоторых сильных окислителей хранят в склянках из тёмного стекла, чтобы исключить фотохимические процессы. Например, пероксид водорода на свету разлагается:
2H 2 O 2 2H 2 O + O 2
Перманганат калия на свету восстанавливается водой до MnO 2 , который выпадает в виде бурого осадка:
4KMnO 4 + 2H 2 O 3O 2 + 4MnO 2 ¯ + 4KOH
Окислительно–восстановительные реакции лежат в основе целой группы методов количественного анализа, таких как перманганатометрия, иодометрия и др.
Окислительно-восстановительные реакции являются самыми распространенными и играют важную роль в природе и технике. Дыхание и обмен веществ живых организмов, коррозия металлов, горение топлива - это примеры окислительно-восстановительных реакций. С помощью ОВР получают металлы, щелочи, кислоты и многие другие ценные продукты. ОВР используют для очистки веществ, природных и сточных вод, газовых выбросов предприятий. Окислители и восстановители, образующие окрашенные растворы, широко применяют для анализа различных веществ методом титрования. С упрощенным вариантом метода анализа вы познакомитесь в данной работе.
Экспериментальная часть
Опыт 1. Влияние рН среды на характер протекания окислительно-восстановительной реакции
Известны соединения
марганца, содержащие этот элемент в
различных степенях окисления:
, ,
, ,
, .
Этивещества
проявляют различные окислительно-восстановительные
свойства и окрашивают растворы в разные
цвета:
.
Этивещества
проявляют различные окислительно-восстановительные
свойства и окрашивают растворы в разные
цвета:
 в темно-малиновый,
в темно-малиновый, - в зеленый,
- в зеленый, образует бесцветный раствор,
образует бесцветный раствор, выпадает в виде бурого осадка.В химических
реакциях
выпадает в виде бурого осадка.В химических
реакциях
 восстанавливается до одного из указанных
веществ в зависимости от кислотности
среды.
восстанавливается до одного из указанных
веществ в зависимости от кислотности
среды.
Для оценки влияния
рН среды на окислительные свойства
перманганата калия в три пробирки
налейте по 2-3 мл раствора сульфита натрия
 .В одну
пробирку добавьте 1 мл раствора
.В одну
пробирку добавьте 1 мл раствора
 ,
во второй пробирке оставьтераствор соли
нейтральным, в третью пробирку добавьте
1 мл раствора
,
во второй пробирке оставьтераствор соли
нейтральным, в третью пробирку добавьте
1 мл раствора
 .
В каждуюпробирку
внесите одинаковое количество (2-3 мл)
раствораперманганата
калия
.
В каждуюпробирку
внесите одинаковое количество (2-3 мл)
раствораперманганата
калия
 .
.
Отметьте изменение
окраски растворов и напишите схемы
реакций, протекающих в разных средах.
Определите степень окисления Mn
в его соединениях, расставьте коэффициенты
в уравнениях. Сделайте вывод о влиянии
рН среды на окислительные свойства
 .
.
Опыт 2. Определение содержания железа( II ) в его соли методом перманганатометрии
Метод перманганатометрии
применяется для количественного
определения веществ, способных окисляться,
и основан на изменении окраски соединений
Mn
при изменении его степени окисления.
При титровании подкисленного раствора
определяемого вещества раствором

 восстанавливается до
восстанавливается до ,
что сопровождается обесцвечиванием
раствора соли марганца. Когда исследуемое
вещество прореагирует полностью, от
одной капли прилитого раствора
,
что сопровождается обесцвечиванием
раствора соли марганца. Когда исследуемое
вещество прореагирует полностью, от
одной капли прилитого раствора появляется слабое розовое окрашивание.
Появлениеокраски
свидетельствует об окончании реакции
и наличии незначительного избытка
реактива.
появляется слабое розовое окрашивание.
Появлениеокраски
свидетельствует об окончании реакции
и наличии незначительного избытка
реактива.
Определив
экспериментально количество
израсходованного
 ,
можно по закону эквивалентов рассчитать
количество исследуемого вещества.
,
можно по закону эквивалентов рассчитать
количество исследуемого вещества.
Количественное
определение двухвалентного железа
основано на том, что в кислой среде ион
 легко окисляется перманганатом до иона
легко окисляется перманганатом до иона .Реакция,
протекающая в процессе титрования
раствора соли двухвалентного железа,
выражается следующей схемой:
.Реакция,
протекающая в процессе титрования
раствора соли двухвалентного железа,
выражается следующей схемой:
Для выполнения
работы взвесьте на аналитических весах
с точностью до 0,0002 г (на часовом стекле)
несколько кристаллов сульфата железа
 ,
известного под названием железный
купорос. Запишите массу соли в тетрадь.
Пересыпьте соль в коническую колбу,
налейте в нее 50 мл раствора серной
кислоты, и, осторожно перемешивая,
дождитесь растворения соли.
,
известного под названием железный
купорос. Запишите массу соли в тетрадь.
Пересыпьте соль в коническую колбу,
налейте в нее 50 мл раствора серной
кислоты, и, осторожно перемешивая,
дождитесь растворения соли.
В бюретку с помощью
воронки налейте раствор
 известной концентрации; под бюреткуподставьте
стакан. Подняв кончик бюретки выше
уровня зажима, вытесните воздух и
заполните его раствором. Установите
уровень раствора в бюретке на нулевой
отметке (для темных жидкостей это
делается по верхнему краю мениска).
известной концентрации; под бюреткуподставьте
стакан. Подняв кончик бюретки выше
уровня зажима, вытесните воздух и
заполните его раствором. Установите
уровень раствора в бюретке на нулевой
отметке (для темных жидкостей это
делается по верхнему краю мениска).
Держа колбу с
раствором
 в руке, при
постоянном перемешивании добавляйте
небольшими порциями раствор
в руке, при
постоянном перемешивании добавляйте
небольшими порциями раствор
 до появления слабо розового окрашивания.
По окончании титрования запишите в
тетрадь объем израсходованного раствора
перманганата калия.
до появления слабо розового окрашивания.
По окончании титрования запишите в
тетрадь объем израсходованного раствора
перманганата калия.
Напишите уравнение реакции, определите число электронов, отдаваемых ионом железа, и рассчитайте молярную массу его эквивалента по формуле (1):
 (1)
(1)
Массу окисленного
железа рассчитайте, используя закон
эквивалентов
:
число
эквивалентов
 равно числу эквивалентов
равно числу эквивалентов ,
поэтому в
данном случае выполняется равенство:
,
поэтому в
данном случае выполняется равенство:
 , (2)
, (2)
где
 - масса окисленного железа, г;
- масса окисленного железа, г;
 –молярная масса
эквивалента
–молярная масса
эквивалента
 ,
г/моль;
,
г/моль;
 (
( )–молярная
концентрация эквивалента
)–молярная
концентрация эквивалента ,
моль/л;
,
моль/л;
 (
( )–объем
раствора
)–объем
раствора ,
л, определенный экспериментально.
,
л, определенный экспериментально.
Из выражения 2 найдите массу окисленного железа:
Процентное содержание железа в соли рассчитайте по формуле:
 (4),
(4),
где
 –
масса анализируемой соли, г.
–
масса анализируемой соли, г.
Экспериментально полученное значение массовой доли железа в его соли сравните с расчетным значением.
Как известно, когда частица (атом, ион, молекула) отдает электрон, то она окисляется и является восстановителем, если принимает – восстанавливается и является окислителем. Реакции окисления ми восстановления неразрывно связаны, их называют окислительно-восстановительными (редокс) реакциями. Большинство применяемых в аналитической химии о-в реакций протекает в растворах.
О – в реакции очень широко используются в аналитической химии.
1) Для перевода ионов и соединений из более низких в более высокие степени окисления и наоборот для предотвращения их вредоносного влияния на анализ (например, окисление Fe 2+ до Fe 3+ ;
2) Для обнаружения ионов, дающих характерные реакции с окислителями или восстановителями, например Mn 2+ (бесцв.) ® МnO 2 (черно-бурый); Mn 2+ (бесцв.) ® MnO 4 - (малиновый).
3) Для разделения ионов, окисляющихся или восстанавливающихся с образованием малорастворимых ионов.
Используют различные методы:
¾ перманонатометрия (в основе лежит реакция Mn 2+ ® MnO 4 - , при этом меняется цвет);
¾ йодометрия (I - ®I 2) и т.д.
Для окислительно-восстановительных реакций характерно наличие в растворе, как минимум, 2-х окисленных и 2-х восстановленных форм, т.е 2 пары окислитель-восстановитель.
Для выяснения направления протекания окислительно-восстановительной реакции используется понятие окислительно-восстановительного потенциала, который для каждой пары окислитель-восстановитель свой.
Бывает стандартный о-в потенциал и нестандартный. Зависимость О-В потенциала данной пары от концентрации окислителя и восстановителя выражается посредством уравнения Нернста.
Как известно, при погружении металлической пластинки в раствор соли этого металла на границе раствор/электрод возникает потенциал, непосредственно измерить который не представляется возможным. Оценивают относительно нулевой точки – стандартного водородного электрода, который состоит из инертного проводника - платиновой пластинки, покрытой чернью, погруженную в раствор кислоты с а Н + = 1, а через раствор пропускают под давлением 1 атм. газообразный водород.
Протекает реакция Н + + е « ½ Н 2
(Н + + е ® Н адс
Н адс + Н адс ®½ Н 2)
Т.о. на платине устанавливается равновесие, которое, в зависимости от условий, можно смещать в любую сторону. Величина потенциала этого электрода условно принята за 0.
Для равновесных условий справедливо уравнение Нернста:
Стандартный электродный потенциал водородного электрода, т.е. потенциал водородного электрода, погруженного в раствор с активностью ионов, относительно которых он обратим, равной 1 при стандартных условиях, R – универсальная газовая постоянная, Т – абсолютная температура, F – число Фарадея, равно 96500 Кл. Можно записать:


Если электрод из инертного металла, например, платины, опустить в раствор, в котором происходит окислительно-восстановительный процесс, то на границе электрод/раствор возникает скачок потенциала, обусловленный этим процессом. Такие системы (и их потенциалы) называются окислительно-восстановительными или redox – системами (потенциалами).

где - стандартный потенциал о-в электрода, и - соответственно активности окисленной и восстановленной формы, n – число электронов, участвующих в окислительно-восстановительном процессе.
Возьмем оловянный электрод, представляет платиновую пластину, погруженную в водный раствор с солью Sn 2+ и Sn 4+ , напр. Sn(NO 3) 2 и Sn(NO 3) 4:
Sn 4+ + 2е « Sn 2+ . Эта реакция является потенциал-определяющей на платине и определяет окислительно-восстановительный потенциал среды.
 или:
или:

Возьмем электрод, представляющий платиновую пластину, погруженную в водный раствор с растворимыми солями Fe 2+ и Fe 3+ :
Fe 2+ + е « Fe 3+ Эта реакция является потенциал-определяющей на платине и определяет окислительно-восстановительный потенциал среды.

Если соединить 2 разных электрода, получим электрохимический (гальванический) элемент при этом электрод с более положительным потенциалом называют анодом, а отрицательным потенциалом – катодом.
Потенциалы, измеренные в паре с водородным электродом, при концентрации (активности) ионов, равной 1 и температуре 25 0 С называются нормальными.
Если пренебречь контактной разностью потенциалов, то ЭДС элемента (Е) равна разности электродных потенциалов:
![]() ,
,
где - потенциалы катода (более положительного) и анода (более отрицательного) электродов соответственно. На катоде идет процесс восстановления, а на аноде – окисления.
Кроме гальванических элементов, окислительно-восстановительные реакции в растворах также протекают в том направлении, когда окислителем является окисленная форма, окислительно-восстановительный потенциал (ОВП) которой больше, а восстановителем – восстановленная форма пары, окислительно-восстановительный потенциал которой меньше. Поэтому при записи и подборе коэффициентов в аналитической химии огромное значение имеют полуреакции ОВ реакций, их уравнения и зависимость по Нернсту.. Поэтому при записи и подборе коэффициентов в аналитической химии используется только метод полуреакций (метод электронного баланса не используется).
При этом учитывают закон сохранения массы вещества и принцип электронейтральности, т.е. число зарядов должно быть одинаково.
Рассмотрим О-В реакцию:
КMnO 4 + Na 2 SO 3 + … ® Mn 2+ + Na 2 SO 4
I полуреакция:
II полуреакция:
По уравнению Нернста:
Т.о. под ln находится [Н + ], меняя ее мы меняем ОВП.
Следует иметь ввиду, что после составления ионно-молекулярного уравнения каждой из полуреакций уравнивают число атомов всех элементов левой и правой части:
Если исходный ион или молекула содержат больше атомов кислорода, чем продукт реакции, то:
1. В кислой среде избыток атомов кислорода связывают ионами Н + в молекулы воды;
2. В нейтральной и щелочной среде избыток атомов кислорода связывают молекулами воды в группы ОН – ;
Если исходный ион или молекула содержат меньше атомов кислорода, чем продукт реакции, то:
1. Недостаток атомов кислорода в кислых и нейтральных растворах компенсируется за счет молекул воды;
2. В щелочных растворах – за счет ионов ОН –
По уравнению Нернста полуреакции можно менять ОВП не только за счет концентрации окисленной и восстановленной формы, но и за счет величины рН раствора. Т.о. один и тот же окислитель (MnO 4 –) при различных рН раствора дает различные продукты.
а) в кислой среде окисляется до Mn 2+
MnO 4 – + 8Н + + 5е ® Mn 2+ + 4Н 2 О 2
SO 3 2– + 2OH – -2е ® SO 4 2– + Н 2 О 5
2MnO 4 – + 16Н + + 5SO 3 2– + 10OH – ® 2Mn 2+ + 5SO 4 2– + 13Н 2 О
2MnO 4 – + 6Н + + 5SO 3 2– + ® 2Mn 2+ + 5SO 4 2– + 3Н 2 О
2КMnO 4 + 5Na 2 SO 3 + 3Н 2 SO 4 ® 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3Н 2 О
б) в нейтральной среде – до МnO 2:
КMnO 4 + Na 2 SO 3 + Н 2 О ® 2MnO 2 + 5Na 2 SO 4 + KОН
(конц-и твердых фаз не пишутся).
§ 1. Окисление-восстановление как один из основных методов химического анализа
Понятие о реакциях окисления - восстановления. Окисление - восстановление является одним из основных методов химического анализа и широко применяется в аналитической практике. Поэтому знание теории окислительно-восстановительных процессов для аналитика имеет большое значение. В этом параграфе, опуская подробности, мы лишь напомним некоторые основные понятия о реакциях окисления-восстановления, поскольку они подробно излагаются в курсе общей и неорганической химии. Основоположниками ионно-электронной теории реакций окисления-восстановления в СССР являются Я. И. Михайленко и Л. В. Писаржевский.
Окислением называют реакцию, связанную с потерей частицей (атомом, ионом или молекулой) электронов, а восстановлением - приобретение электронов.
Вещество, получающее электроны от окисляющегося вещества, называют окислителем, а отдающее электроны другому веществу, - восстановителем.
Реакции окисления и восстановления взаимно обусловлены, неразрывно связаны между собой и не могут рассматриваться изолированно друг от друга. Именно поэтому их называют реакциями окисления - восстановления (редокс-реакциями).
Реакции окисления - восстановления всегда связаны с переходом (отдачей или присоединением) электронов и сопровождаются изменением (увеличением или уменьшением) степени окисления элементов:
Окислители. В качестве окислителей в аналитических лабораториях чаще всего применяют: хлорную и бромную воду, , , , царскую водку.

Л. В. Писаржевский (1874-1938).
Кроме того, следует иметь в виду, что окислителями также являются ионы и некоторые другие.
Мерой окислительной способности данного окислителя (атома или иона) является сродство к электрону, представляющее собой энергию (работу, выражаемую в электрон-вольтах), которая высвобождается при присоединении к нему электрона (см. гл. III, § 27).
Восстановители. В качестве восстановителей применяет: металлические цинк, железо и алюминий, и т. п., восстановителями являются также ионы и др.
Мерой восстановительной способности данного восстановителя (атома или иона) является ионизационный потенциал (потенциал ионизации), численно равный энергии (работе, выражаемой в электрон-вольтах), которую нужно затратить для того, чтобы удалить от него электрон на бесконечно далекое расстояние (см. гл. III, § 27).
Реакции диспропорционирования (самоокисление - самовосстановление). Одно и то же вещество в зависимости, от условий реакции может быть и окислителем, и восстановителем Например:
В реакции (а) азотистая кислота является окислителем, в реакции (б) - восстановителем.
Вещества, проявляющие и окислительные, и восстановительные свойства, способны к реакциям самоокисления - самовосстановления. Такие реакции называют реакциями диспропорционирования. К реакциям диспропорционирования способны многие соединения.
Рассмотрим подробно окислительно-восстановительные свойства перекиси водорода, широко применяемой в аналитической практике.
Перекись водорода в силу специфического характера строения ее молекул Н-О-О-Н проявляет себя и как окислитель, и как восстановитель:

В реакциях с восстановителями она играет роль окислителя; а) в кислой среде

Под действием сильных окислителей она проявляет восстановительные свойства:
б) в кислой среде

Перекись водорода может проявлять восстановительные свойства не только в кислой (см. выше), но и в нейтральной, и в щелочной средах:

Известны также реакции, протекающие как в кислой, так щелочной и нейтральной средах, в которых перекись водорода является окислителем. Например: а) в кислой среде:

б) в нейтральной среде

в) в щелочной среде

Но, кроме того, известны такие реакции, в которых перекись водорода при сравнительно незначительном изменении среды играет роль то окислителя, например:

то восстановителя, например:

Вследствие двойственности окислительно-восстановительного характера перекиси водорода, она склонна вступать в реакции диспропорционирования:

Окислительно-восстановительные свойства металлов, неметаллов и образуемых ими ионов. Металлы являются восстановителями. Теряя свои электроны, атомы металлов превращаются в электроположительные ионы. Например:
Ионы металлов проявляют либо окислительные, либо восстановительные свойства. Приобретая электроны, ионы металлов переходят либо в ионы низшей зарядности (а), либо в нейтральное состояние (б):
Теряя электроны, ионы металлов превращаются либо в ионы высшей зарядности (а), либо в сложные ионы (б):
Неметаллы также могут проявлять и восстановительные, и окислительные свойства. Теряя электроны, атомы неметаллов превращаются в электроположительные ионы, образующие в водной среде окислы или сложные кислородсодержащие ионы. Например:
Приобретая электроны, атомы неметаллов превращаются в электроотрицательные ионы. Например:
Отрицательные ионы неметаллов являются восстановителями. Теряя электроны, отрицательные ионы неметаллов переходят либо в нейтральное состояние (а), либо в сложные ионы (б):
Подавляющее большинство сложных кислородсодержащих ионов несет отрицательные заряды, например некоторые ионы заряжены положительно: .
Сложные кислородсодержащие ионы, в состав которых входят электроположительные элементы, теряя свои электроны, превращаются в другие сложные ионы, содержащие те же элементы, но более электроположительной степени окисления. Например:
Приобретая электроны, сложные ионы превращаются в другие сложные ионы, в состав которых входят ионы элементов низшей валентности (а), в нейтральные молекулы (б) или в отрицательно заряженные ионы неметаллов (в):

Химическая связь. Химические реакции сопровождаются, как правило, изменением электронного строения атомов реагирующих элементов за счет полного перехода электронов (ионная связь), уменьшения или увеличения электронной плотности (поляризация), а также за счет обобществления пар электронов (ковалентная связь).
Деление веществ в зависимости от характера химической связи на ковалентные и ионные в известном смысле условно и основывается на преимущественном проявлении того или иного типа химической связи. Например, ионная и неполярно-ковалентная связи являются лишь крайними границами полярно-козалентной связи, которую можно рассматривать как отклонение от чисто ионной и ковалентной.
Подробное изложение теории химической связи не входит в нашу задачу, поскольку эти вопросы излагаются в курсах строения вещества, общей, неорганической и органической химии. Однако мы должны обратить внимание на то, что реакции окисления - восстановления можно рассматривать как реакции, сопровождающиеся переходом электронов от одних атомов, молекул и ионов к другим.
Составление уравнений окислительно-восстановительных реакций. При составлении уравнений реакций окисления - восстановления не имеет особого значения - происходит ли образование идеальной ионной связи. Это тем более несущественно, что даже ионное превращение элементов, связанное с переходом электронов от одних атомов к другим, не сопровождается, как известно, образованием идеальной ионной связи.
Существуют различные способы составления уравнений реакций окисления - восстановления. Ниже рассматривается ионно-электронный метод, основанный на составлении двух полуреакций: 1) полуреакции окисления и 2) полуреакции восстановления, и предусматривающий пользование студентами прилагаемыми в конце книги номограммами для определения направления реакции окисления - восстановления. С помощью этих номограмм можно без особого труда раздельно написать ионноэлектронные уравнения полуреакций и затем суммировать их в общее ионное уравнение реакции окисления - восстановления.
Балансирование полуреакций проводят с таким расчетом, чтобы общее число электронов, перешедших к окислителю, равнялось числу электронов, потерянных восстановителем.
Если представить себе все вещества, написанные в левой части 1-й полуреакции и 2-й полуреакции подсобного уравнения, как израсходованные на реакцию ("расход"), а написанные в правой части, как полученные в результате реакции ("приход"), то составление уравнения реакций в окончательном виде не составляет никаких трудностей. Для этого нужно лишь подвести итог (составить баланс).
Перед составлением уравнения, пользуясь указанными номограммами (см. Приложение) или таблицей окислительно-восстановительных потенциалов (см. табл. 5, стр. 96), нужно решить основной вопрос пойдет ли данная реакция или не пойдет.
Это необходимо делать потому, что многие реакции, уравнения которых можно сбалансировать, т. е. написать на бумаге, на самом деле при данных условиях практически не идут.
Например, не идет реакция
но идет обратная реакция
Идут реакции:

а обратные им реакции в тех же условиях практически не протекают.
Рассмотрим следующую реакцию окисления - восстановления:
Подсобное уравнение
Нетрудно заметить, что уравнение реакции окисления - восстановления в полной форме является результатом суммирования двух полуреакций.
В этом примере ионы высшей степени окисления с освобождающимися ионами кислорода образуют в кислой среде соответственно нерастворимую в воде метаоловянную кислоту и бисульфат-ион , а ионы водорода с ионами кислорода в кислой среде образуют молекулы воды.
В молекулярной форме приведенная выше реакция может быть представлена так:
В общем виде при составлении правой части ионно-электронного уравнения реакции окисления - восстановления необходимо руководствоваться следующими правилами
В отношении ионов водорода
1) с освобождающимися (а) или образующимися (б) ионами кислорода или ионами гидроксила (в) ионы водорода образуют нейтральные молекулы боды:
2) с ионами фтора, серы, селена, теллура, азота и других элементов, находящихся в состоянии низших степеней окисления, ионы водорода образуют соответствующие слабые электролиты:
3) с нейтральными молекулами воды и аммиака ионы водорода образуют ионы гидроксония и аммония.
В отношении ионов гидроксила
1) в процессе окисления соединений элементов низших степеней окисления в высшие степени окисления, в присутствии ионов гидроксила образуются кислородные соединения элементов высших степеней окисления и вода:
2) с элементами, склонными к образованию нерастворимых в воде гидроокисей, ионы гидроксила образуют осадки гидроокисей:
3) при окислении элементов, склонных к комплексообразованию, ионы гидроксила образуют с ними гидроксокомплексные ионы:
4) с ионами водорода и ионами аммония ионы гидроксила соответственно образуют молекулы воды (а) и аммиака (б):
В отношении молекул воды
1) с освобождающимися (а) или образующимися (б) ионами кислорода молекулы воды образуют гидроксильные ионы:
2) в процессе окисления ионов элементов низших степеней окисления в высшие молекулы воды образуют комплексные кислородсодержащие ионы (а) и нерастворимые в воде соединения (б), а также ионы водорода:
3) в процессе восстановления соединений элементов высшей степени окисления в низшие степени окисления в присутствии воды образуются соединения элементов низших степеней окисления (а), нерастворимые в воде соединения (б) и ионы гидроксила:
В отношении остальных ионов
1) одно-, двух- и трехзарядные ионы металлов, склонные давать нерастворимые соединения, в нейтральной или кислой среде образуют с кислотными остатками нерастворимые соли, например:
Следует иметь в виду, что свободные (или гидратированные) катионы, несущие свыше трех положительных зарядов, как правило, в водных растворах не существуют. Высокозарядные ионы в процессе разнообразных реакций окисления - восстановления, реагируя с водой, моментально соединяются с ионами кислорода воды, образуя сложные кислородсодержащие ионы типа :

Применение реакций окисления - восстановления в аналитической химии. Реакции окисления - восстановления широко применяются в химическом анализе.
1. Для перевода ионов и соединений элементов низших форм окисления в высшие (а) и высших форм в низшие (б) с целью предотвращения их вредного влияния в процессе проведения анализа:
а) для предварительного окисления до в тех случаях, когда ионы железа (II) мешают ходу анализа;
б) для восстановления в процессе осаждения в хлористоводородном растворе сероводородом .
2. Для обнаружения ионов, дающих характерные реакции с окислителями или восстановителями, например:

3. Для разделения ионов, окисляющихся или восстанавливающихся с образованием малорастворимых соединений, например:
4. Для количественного определения многих неорганических и органических соединений весовым или объемным методом (см. книга 2).

1. Сущность реакций окисления-восстановления. Стандартный и реальный редокс-потенциал. Уравнение Нернста
2. Основные положения теории окислительно-восстановительных реакций
3. Реакции диспропорционирования
4. Зависимость величин редокс-потенциалов систем от различных факторов (ЭДС реакции, рН)
5. Применение окислительно-востановительных реакций в аналитической химии
6. Катионы V аналитической группы. Реакции катионов V аналитической группы.
КЛЮЧЕВЫЕ СЛОВА И ТЕРМИНЫ
Окислительно-восстановительные реакции
Процесс окисления
Процесс восстановления
Окислитель
Восстановитель
Реакции окисления внутримолекулярные, межмолекулярные, дис-пропорционирования
Гальванический элемент Платиновая чернь
Стандартные окислительно-восстановительные потенциалы Реальные окислительно-восстановительные потенциалы Уравнение Нернста
Катализаторы
Ингибиторы
Автокаталитические реакции Сопряженные реакции Индуцированные реакции
V аналитическая группа катионов
Групповой реагент на V аналитическую группу катионов
Реакции ионов железа (II)
Реакции ионов железа (III)
Реакции ионов марганца (II)
Реакции ионов висмута
Реакции ионов сурьмы (III, V)
Систематический ход анализа катионов V аналитической группы
Окислительно-восстановительные реакции в аналитической химии
Окислительно-восстановительные реакции - это реакции, которые сопровождаются переходом электронов от одних частиц (атомов, молекул и ионов) к другим, что приводит к изменению степеней окисления элементов.
Окисление - это процесс, при котором происходит отдача
№° - ё - Н2О2 - 2ё - 2Н+ + О2 БОз2- + 2ОН- - 2ё - БО42- + Н2О
Восстановление - это процесс, при котором происходит присоединение
электронов атомом, молекулой или ионом:
Б° + 2ё - Б2-Н2О2 + 2Н+ + 2ё - 2Н2О СГ2О72- + 14Н+ + 6ё - 2Сг3+ + 7Н2О МпО4- + 8Н+ + 5ё - Мп2+ + 4Н2О
В качестве восстановителей в аналитической химии чаще всего применяют: Н2О2, БпС12, Н2Б, Н2БО3, Ка2Б2О3; в качестве окислителей -С12; Вг2; Н2О2; К2Сг2О7; КМпО4; НШ3 и другие.
В реакциях окисления-восстановления всегда участвуют два вещества, одно из которых является восстановителем, а другое окислителем. При этом количество электронов, принятых окислителем, всегда должно быть равно количеству электронов, отданных восстановителем.
Типы окислительно-восстановительных реакций
К основным типам окислительно-восстановительных реакций относятся следующие:
1 - межмолекулярные окислительно-восстановительные реакции (элементы, изменяющие степень окисления, находятся в составе разных молекул):
РЪБ + 4Н2О2 ^ ^РЪБО4 + 4Н2О
восстановитель окислитель
№С1 + КаС1О +^БО4 ^ С12 + Ка2БО4 + Н2О;
2 - внутримолекулярные окислительно-восстановительные реакции (элементы, изменяющие степень окисления, входят в состав одной молекулы):
NH4NO3 ^ N2 O + 2H2O
(NnH4)2 C+2O7 - N2° + Сг2Оз + 4H2O;
3 - реакции диспропорционирования (самоокисления-самомовосста-новления) (атомы одного и того-же элемента по-разному изменяют степень окисления):
C°l2 + 2NaOH - NaCl + NaClO + H2O 2H2O2 - 2H2O + O2
В общем виде окислительно-восстановительный процесс выражается следующим образом:
где: Red - восстановитель-частица, отдающая электроны;
Ox - окислитель-частица, которая способна принимать электроны.
Таким образом, мы имеем дело с сопряженной окислительно-восстановительной или редокс-парой.
В качестве простейших редокс-пар можно привести следующие: Fe3+/ Fe2+, Се4+/ Се3+ и т.д. Обе формы этих пар представляют собой одноатомные ионы, в которых осуществляется непосредственный переход электронов от одной частицы к другой.
Чаще имеют место более сложные процессы, в которых одновременно переходят электроны и атомы, например:
Mn2+ + 2H2O - 2e -- MnO2^ + 4H+.
Окислительно-восстановительная реакция может происходить лишь при непосредственном взаимодействии окислителя (окисленной формы) одной сопряженной редокс-пары с восстановителями (восстановленной формой) другой сопряженной редокс-пары. При этом общая редокс-реак-ция состоит из двух частных:
аОх! + ne аRedl
BRed2 - ne bOx2
aOxi + bRed2 ^ аRedl + bOx2
Таким образом, каждую окислительно-восстановительную реакцию можно представить как сумму двух полуреакций. Одна из них отражает превращение окислителя, а другая - восстановителя.
Окислительно-восстановительный потенциал
Деление окислительно-восстановительных реакций на полуреакции является не только формальным приемом, который облегчает понимание процесса передачи электронов, но имеет вполне определенный физический смысл.
Если компоненты каждой полуреакции поместить в разные сосуды, растворы которых соединены солевым мостиком (трубка, заполненная гелем агар-агара, пропитанным насыщенным раствором KCl), опустить в каждый из сосудов инертные электроды (платиновая проволока) и замкнуть их на гальванометр (рис.), то последний покажет наличие электрического тока. Такое устройство называют гальваническим элементом, а каждый из сосудов с раствором и платиновой проволокой - полуэлементом.
Fe2+ -- Fe3+ + ё
Ce4+ + ё - Ce3+
Рис. Схема гальванического элемента: 1 - платиновые электроды; 2 - электролитический ключ (трубка, заполненная раствором КС1); 3 - потенциометр; 4 - стакан.
При прохождении реакции в гальваническом элементе химическая энергия превращается в электрическую. Электродвижущая сила (ЭДС) гальванического элемента представляет собой разность потенциалов двух электродов (ЭДС=Е1-Е2) и характеризует способность электронов восстановителя переходить к окислителю.
Потенциал отдельной редокс-пары (в нашем примере Бе /Бе и Се4+/Се3+) измерить невозможно. В связи с этим указанную задачу решают путем комбинирования полуэлемента, потенциал которого необходимо определить, с полуэлементом, потенциал которого принят за стандарт. В качестве такого полуэлемента (электрода) используют стандартный водородный электрод. Этот электрод представляет собой платиновую пластинку, покрытую слоем платиновой черни, которая погружена в раствор кислоты с активностью ионов водорода, равной единице. Электрод омывается водородом при давлении 1,013-10 Па (1 атм). При этом слой платиновой черни насыщается водородом, который ведет себя как водородный электрод, находящийся в растворе в равновесии с ионами водорода:
Н2 (г) = 2Н+ + 2ё.
Потенциал этого электрода принят равным нулю при всех температурах.
Учитывая, что ЭДС гальванического элемента равна разности потенциалов электродов (Е1 - Е2) и Е2 = 0 (стандартный водородный электрод): для указанного гальванического элемента будем иметь ЭДС = Е1. Таким образом, потенциал данного электрода равен ЭДС гальванического элемента, который состоит из этого электрода и стандартного водородного электрода.
В случае, когда все компоненты полуреакции находятся в стандартном состоянии (гипотетический одномолярный раствор с коэффициентами активности компонентов, равными единице, при нормальном атмосферном давлении и температуре).
Потенциал такого электрода называют стандартным электродным потенциалом и обозначают Е0.
Зависимость между реальным равновесным окислительно-восстановительным потенциалом электрода (потенциал электрода в нестандартных условиях - Е) и стандартным электродным потенциалом (Е0) передается уравнением Нернста:
Е = Е0 +-1п ох
где: R - универсальная газовая постоянная, равная 8,312 Дж/(моль К); T - абсолютная температура; F - постоянная Фарадея, равная 96 500 Кл;
n - число электронов, принимающих участие в электродном процессе;
aox, ared - активности окисленной и восстановленной форм вещества соответственно, возведенные в степени, равные соответствующим стехиометрическим коэффициентам. Если учесть, что активность можно представить как произведения концентрации на коэффициент активности, то уравнение Нернста можно записать в следующем виде:
E = E0 + ^ ln Y°x
nF " Y red"
где: y0x - коэффициент активности окисленной формы;
Yred - коэффициент активности восстановленной формы. Когда в уравнение полуреакции кроме окисленной и восстановленной формы входят и другие ионы, то их концентрации (активности) должны быть включены в уравнение Нернста.
Так потенциал редокс-пары EMn04-/ Mn2+ , для которой уравнение полуреакции имеет вид:
Mn04- + 8H+ + 5e ^ Mn2+ + 4H20,
вычисляют по уравнению:
*Mn°47 Mn2+ - Е Mn°47 Mn2+ + ln "
Если в уравнение Нернста подставить численные значения констант и перейти к десятичным логарифмам, то для температуры 25°С оно принимает вид:
Е = Е» + 0,059 18 "Ус
0,059 lg |0x] + 0,059 lg
Величину
в последнем уравнении называют
формальным потенциалом и обозначают как Е0(1).
Если в уравнение Нернста ввести формальный потенциал, то оно приобретает вид:
E0(D + 0059 lg |°x]
Из последнего уравнения следует, что Е - Е0(1), когда [°x] - 1,0.
Равенство Е 0(1)
свидетельствует
формальный потенциал зависит от ионной силы раствора. Если ионной силой раствора пренебречь, то получим равенство Е0(1) = Е0. Для многих аналитических расчетов точность такого приближения вполне достаточна.
Стандартный потенциал редокс-системы используют в качестве объективной характеристики окислительно-восстановительных свойств соединений. Чем больше положительное значение стандартного потенциала, тем сильнее окислитель. В тоже время восстановленные формы сильных окислителей обладают слабо выраженными восстановительными свойствами и, наоборот, окисленные формы сильных восстановителей обладают слабыми окислительными свойствами. Таким образом, окислительно-восстановительные реакции протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
Сравнение величин стандартных потенциалов может быть использовано для предсказания направления окислительно-восстановительной реакции.
Однако следует учитывать, что стандартные потенциалы могут значительно отличаться от реальных и направление реакции может меняться.
На величину реального потенциала оказывают влияние такие факторы, как рН среды, концентрации реагентов, комплексообразование, образование осадков и др.
Следует отметить, что рН среды оказывает влияние на реальный потенциал не только в тех случаях, когда концентрации Н+ и ОН- ионов входят в уравнение Нернста, но иногда и в случаях их отсутствия в этом уравнении. Это может быть связано с изменением формы существования ионов в растворе (влияние на гидралитические и другие равновесные процессы).
Как отмечалось на стр. 96 потенциал редокс-пары Е°мпО4тмп2+ зависит от концентрации ионов водорода (указанная величина может изменяться от 1,51 В до 1,9 В), в связи с чем это свойство используют для фракционированного окисления галогениданионов до свободных галогенов. Так при рН от 5 до 6 перманганат окисляет лишь йодиды (Е°у 21- = 0,53 В), при рН 3 окисляются бромиды (Е°Вг2/ 2Вг- = 1,06 В) и только при значительно более высокой кислотности окисляются хлориды (Е°су 2сг = 1,395 В).
Изменение величины рН может влиять не только на величину редокс-потенциала, но, иногда, и на направление хода реакции. Например, реакция:
ЛвО43" + 2Н+ + 21" - ЛбОз3" + 12 + Н2О,
в кислой среде протекает слева направо, а в щелочной (рН 9, создаваемое с помощью КаНСО3) - справа налево.
Существует следующее правило для создания реакционной среды, необходимой для оптимального течения процесса: если в результате окислительно-восстановительной реакции накапливаются Н+ или ОН--ионы, то необходимо создать среду, которая обладает противоположными свойствами (щелочную или кислую соответственно).
Кроме того, для реакции нужно брать компоненты (окислитель и восстановитель), которые реагируют в одинаковой среде. В противном случае может иметь место торможение процесса.
В качестве примера, который иллюстрирует влияние на потенциал и направление реакции малорастворимого соединения, можно привести реакцию взаимодействия Си2+ и I-.
Стандартный потенциал редокс-пары Си /Си составляет 0,159 В, а для пары 12/21- он равен 0,536 В. Приведенные данные свидетельствуют о том, что ионы Си2+ не могут окислять ионы I-. Однако в процессе этой реакции образуется малорастворимая однойодистая медь Си1 (ПРСи1 = 1,1Т0-
). Образование этого осадка резко снижает концентрацию ионов Си в растворе. При этом активность ионов Си2+ в растворе можно определить из равенства:
Используя уравнение Нернста, можно показать, что
E°cu-/ oui = Е0си2+/ cu+ - 0,059lgnP CuI = 0,865 В.
Таким образом, редокс-пара Cu /CuI имеет потенциал, который превышает потенциал пары I2/I- в результате чего указанное превращение становится возможным.
Константа равновесия окислительно-восстановительной реакции
Во многих случаях необходимо знать не только направление окислительно-восстановительной реакции, но и насколько полно она протекает. Так в количественном анализе используют те реакции, которые практически протекают на 100 \% (или приближаются к этому). Степень протекания реакции определяется константой равновесия.
Если уравнение окислительно-восстановительной реакции представить в общем виде схемой:
aOx1+ pRed2 ^ yRed1+ 5Ox2 ,
то константа ее равновесия (К) будет иметь вид:
K = a a ■ Я в-.
Используя уравнение Нернста для окислительно-восстановительных пар, участвующих в реакции, можно показать, что при 25°С:
1 т^ Ox, /Re d, Ox2/Red2/
или в общем виде:
T, (E ox - E Re d) ^n
где: ERed- стандартные потенциалы пар, выступающих в данной ре-
акции в качестве окислителя и восстановителя соответственно; n - число электронов, принимающих участие в процессе. Из последнего уравнения следует, что чем больше разность потенциалов (EOx- ERed), тем больше константа равновесия и тем полнее будет протекать реакция слева направо. Однако следует помнить, что большое значение константы равновесия не свидетельствует о высокой скорости протекания процесса.
На скорость протекания реакции оказывают влияние такие факторы, как механизм реакции, концентрация реагентов, температура раствора, наличие катализаторов или ингибиторов.
Скорость реакции возрастает при увеличении концентрации реагентов, а также при повышении температуры. Обычно увеличение температуры на 10° приводит к ускорению реакции в 2-4 раза. Так, например, при взаимодействии перманганата калия с раствором щавелевой кислоты реакция идет медленно и для ее ускорения раствор подогревают. Кроме того, эта реакция относится к автокаталитическим (катализатором является один из продуктов реакции - ионы Мп).
В ряде случаев имеют место так называемые сопряженные или индуцированные окислительно-восстановительные реакции.
Например, при окислении перманганатом калия ионов Бе2+ в растворе, подкисленным соляной кислотой, часть перманганата калия расходуется на окисление хлорида:
2Мп04- + 10С1- + 16Н+ - 2Мп2+ + 5С12 + 8Н2О.
В отсутствие ионов Бе2+ эта реакция не происходит, хотя разность стандартных потенциалов позволяет ее протекание. Для предотвращения побочной реакции указанный процесс проводят в растворах, подкисленных серной кислотой.
Применение окислительно-восстановительных реакций в аналитической химии
Окислительно-восстановительные реакции широко используются в качественном и количественном анализе.
В качественном анализе окислительно-восстановительные реакции используются для:
Переведения соединений из низших степеней окисления в высшие и наоборот;
Переведения малорастворимых соединений в раствор;
Обнаружения ионов;
Удаления ионов.
Так реакции окисления пероксидом водорода в щелочной среде используются в анализе катионов IV аналитической группы для переведения соединений Бп(И), Ав(Ш), Сг(Ш) в гидроксо- и оксоанионы этих элементов в высших степенях окисления.
Например, анионы [Сг(0Н)6] - окисляются в хромат ионы:
2[Сг(0Н)б]3- + 3Н20^2Сг042- + 8Н2О + 2ОН-. Анионы [Бп(0Н)6]4- - в гидроксоанионы [Бп(0Н)6]2-: [Бп(0Н)б]4- + Н202- [Зп(0Н)6]2- + 2ОН-.
Арсенит ионы Аб0зз- - в арсенат ионы Аб04з-:
Аб0з3- + Н202^=* Аб043- + Н20.
В тоже время указанный реагент окисляет одновременно и некоторые ионы V и VI аналитической группы: 8Ь(Ш)-8Ь^), Бе2+- Бе3+; Мп2+- Мп02-пН20, Со2+-Со3+.
Окислительные свойства пероксида водорода в кислой среде используют для обнаружения хромат- и дихромат-ионов по реакции образования надхромовой кислоты (раствор синего цвета):
Сг2072- + 4Н202 +2Н+ -2Н2Сг06 + 3Н20.
Пероксид водорода в азотнокислой среде используют в качестве восстановителя для переведения осадков Мп02-пН20 и Со(ОН)3 в раствор в виде катионов Мп2+и Со2+соответственно:
Мп02-пН20 +Н202 +2Н+^=* Мп2+ + |02 + (п+2)Н20, 2Со(ОН)3 +Н202 +4Н+^ 2Со2+ + |02 + 6Н20.
Для обнаружения ионов Ав(Ш) и Аб^) используют реакцию восстановления их металлическим цинком до газообразного продукта АбНз.
В анализе катионов II группы применяют реакцию диспропорционирования соединений ртути:
НВ2С12 + М1з- [НвМДО! +Нв|.
Для обнаружения катионов Бп используют их восстанавливающие свойства по отношению к соединениям двухвалентной ртути:
Бп2+ + + 4 С1 - + [БпС16]2-.
Ионы БЬ^) обнаруживают путем их восстановления до БЬ0 действием на их анионы металлическим цинком на никелевой пластинке (образование гальванической пары):
2[БЬС16]- + 57п- 57п2+ + 2БЬ| +12С1-.
Катионы Ы обнаруживают, восстанавливая их в щелочной среде до металлического висмута гексагидроксостаннит (II) ионами:
2Ы(0Н)з| + 3[Бп(0Н)6]4- - 2БЦ + 32- +60Н-.
Обнаружение ионов Мп основано на их окислении до окрашенных в красный цвет Мп04- ионов с помощью персульфата аммония:
2Мп2+ +5Б2082- + 8Н2<0^ 2Мп04- + 16Н+ + 10Б042-.
В качественном анализе часто используют такие окислители, как HN03, хлорную и бромную воду.
Так образовавшуюся в систематическом ходе анализа смесь осадков сульфидов Cu2S и HgS разделяют, обрабатывая ее разбавленной азотной кислотой при нагревании:
3Cu2S + 4NO3" +16H+ - 6Cu2+ + 3S| + 4N0| + 8H20.
При этом в указанных условиях осадок HgS в отличие от Cu2S не растворяется.
Осадок HgS растворяется в бромной воде в присутствии хлороводородной кислоты или в смеси концентрированной HN03 и концентрированной HCl:
HgSj + Бг2 + 2Cl- - + 2Br- + Sj, 2HgS| + 2HNO3 + 6HC1 - 3 + 3S|+2N0 + 4H2O.
Черный осадок металлической сурьмы, полученный при ее обнаружении (см. выше), окисляют азотной кислотой с образованием белого осадка метасурьмяной кислоты:
3Sb| + 5MV + 5H+ - 3HSb03| + 5N0|+ H20.
Окислительно-восстановительные реакции широко используют не только в качественном анализе катионов, но и в анализе анионов.
Так в ходе анализа на анионы выполняют пробу на анионы-окислители (Cr2072-, As043-, N03-) действием раствора KI в кислой среде в присутствии хлороформа. При этом образуется свободный йод, окрашивающий слой хлороформа в красно-фиолетовый цвет.
Кроме того, проводят пробу на анионы-восстановители (C204 S203 S2-, S032-, As033-, I-, N02-), основанную на обесцвечивании раствора йода в слабокислой среде (за исключением As033-, которые обнаруживают в слабощелочной среде).
На окислительно-восстановительных реакциях основана проба с концентрированной H2S04 (Cl-, Br-, I-, Cr042-, N03-, S032-, S2032Ti др.), при этом выделяются газообразные продукты (Cl2, I2, C02 и др.).
Для обнаружения таких анионов-восстановителей, как S03 "и C204 N02- используют реакции, в результате которых обесцвечиваются растворы KMn04:
5S02 + 2H20 +2Mn04- ^ 5S022- + 4H+ + 2Mn2+ 5C2042- +2Mn04- + 16H+ ^ 10C02t + 2Mn2+ + 8H20 5N02-+2Mn04- + 6H+^ 2Mn2+ + 5N03- + 3H20.
Для удаления нитрит-ионов при обнаружении нитрат-ионов используют реакцию с кристаллическим аммония хлоридом:
N02-+ Mi/^ N2| + 2H20.
Катионы V аналитической группы Те2+, Те3+, М^+, Mn2+, 8Ъ (III), 8Ъ (V), Б13+
Общая характеристика
К V аналитической группе относятся катионы Б-элементов - М§2+, р-элементов - БЬ (III), БЬ (V), Ы3+ и ё-элементов - Бе3+, Бе2+, Мп2+. Вследствие сильного поляризующего действия катионов V аналитической группы многие их соединения (гидроксиды, сульфиды, фосфаты) не растворяются в воде. В воде растворяются хлориды, бромиды, нитриты, нитраты, ацетаты, сульфаты катионов V аналитической группы.
Групповым реагентом на катионы V аналитической группы является концентрированный раствор аммиака, который осаждает их в виде гидроксидов, нерастворимых в избытке реагента.
Дальнейший ход анализа катионов V аналитической группы основан на различной растворимости гидроксидов этих катионов в концентрированных растворах солей аммония, кислотах, а также на использовании различных окислительно-восстановительных реакций и реакций осаждения этих катионов.
Соединения Бе - желто-бурого цвета, а Бе - светло-зеленого; растворы соединений других катионов - бесцветны.
Реакции катионов V аналитической группы
Действие растворов натрия гидроксида или калия гидроксида
С растворами №0Н или К0Н катионы магния, марганца, висмута и сурьмы образуют белые аморфные осадки гидроксидов, зеленые -гидроксидов железа (II) и красно-бурые - гидроксидов железа (III):
Мв2+ + 20Н- - Мв(0Н)2^, Мп2+ + 20Н- ^ Мп(0Н)2^, Бе2+ + 20Н- - Бе(0Н)2^, Бе3+ + 30Н- - Бе(0Н)з^, [БЬС16]3- + 30Н- - БЬ(0Н)з^ + 6С1-, [БЬС16]- + 50Н- - БЬ(0Н)5^ + 6С1-, БЬ(0Н)5^ - НБЬ0з^ +2Н20, Ы3+ + 30Н- ^ Ы(0Н)3^.
Все гидроксиды катионов V аналитической группы растворяются в кислотах, например:
Бе(0Н)3^ + 3Н+ - Бе3+ + 3Н20.
Гидроксиды 8Ь (III) и 8Ь (V) за счет амфотерных свойств растворяются в избытке щелочей:
8Ь(ОИ^ + ЗОИ" - 3-, ^ + ОИ- - -.
Гидроксиды магния, марганца (II) и железа (II) растворимы также в насыщенном растворе №І4С1, например:
Ыв(ОИ)2^ + 2МІ4+ - Ыв2+ + 2МІ3-И2О.
Это свойство используют для отделения магния гидроксида от других гидроксидов катионов V аналитической группы в систематическом ходе анализа.
Действие раствора аммиака
При действии раствора аммиака на растворы катионов V аналитической группы выпадают осадки соответствующих гидроксидов:
Ыв2+ + 2МіуИ2О - Ыв(ОИ)2^ + 2М1/, - + 5Міз-И2О - ШЬОз| + 6С1- + 5МІ4+ + 2^О, 3- + 3КИз-И2О - 8Ь(ОИ)з^ + 6С1- + ЗМІ4+, Мп2+ + 2МІ3-И2О ^ Мп(ОИ)2^ + 2МІ/, Бе2+ + 2МіуИ2О ^ Бе(ОИ)2^ + 2МИ+, Бе3+ + 3МІ3-И2О ^ Бе(ОИ)3^ + 3М1Л
Катионы висмута при действии раствора аммиака образуют белый осадок основной соли, состав которой изменяется в зависимости от концентрации раствора, температуры:
Ві3+ + 2Мі3-И2О + С1- - Ві(ОИ)2С1^ + 2МІ/, Ві(ОИ)2С1^ - ВіОС1^ + И2О.
Гидролиз солей ЗЬ (III), ЗЬ (V) и висмута
Соли висмута, сурьмы (Ш^) гидролизуются с образованием белых осадков основных солей:
3- + И2О - 8ЬОС1^ + 5С1- + 2И+, - + 2 И2О - 8ЬО2С1^ + 5С1- + 4И+, Ві3+ + И2О + Ж)3- ^ ВіОЖ)3^ + 2И+.
Все осадки растворимы в кислотах.
Реакция ионов магния
Действие раствора натрия гидрофосфата Na2HPO4
Катионы магния образуют с раствором натрия гидрофосфата в присутствии аммиачного буферного раствора белый кристаллический осадок:
Mg2+ + HPO42- + NH3-H2O ^ MgNHPO^ + H2O.
Эту реакцию можно выполнять как микрокристаллоскопическую. Кристаллы MgNH4PO4, образовавшиеся во время быстрой кристаллизации, имеют характерную форму.
Реакция ионов железа (II)
Действие раствора калия гексацианоферрата (III) K3
Катионы железа (II) образуют с раствором калия гексацианоферрата (III) осадок синего цвета ("турнбулевая синь"):
3Fe2+ + 23- ^ Fe32^.
Реакция специфична и позволяет обнаружить катионы Fe дробным методом.
Осадок не растворяется в кислотах. В щелочах он разлагается: Fe32^ + 6OH- - 3Fe(OH)2^ + 23-.
Реакции ионов железа (III)
1. Действие растворов калия гексацианоферрата (II) K4
Катионы железа (III) образуют с раствором калия гексацианофер-рата (II) темно-синий осадок ("берлинская лазурь"):
4Fe3+ + 34- - Fe43^
Реакция Fe с гексацианоферратом (III) калия специфична и позволяет открывать их дробным методом.
Реакцию необходимо проводить в кислой среде при рН=3. Однако при сильном подкислении или добавлении избытка реагента осадок растворяется.
В щелочах осадок разлагается:
Fe43^ + 12OH- - 4Fe(Offb^ + 34-.
2. Действие тиоционат-ионов
Катионы железа (III) образуют с тиоцианат-ионами комплексные соединения железа (III), которые окрашивают раствор в красный цвет, например:
Fe3+ + 3NCS- - .
При избытке тиоцианат-ионов образуются комплексные ионы различного состава:
-; 2-; 3-.
Выполнять реакцию необходимо в кислой среде при рН=2. Обнаруже-
нию Fe с тиоцианат-ионами мешают анионы (F, PO4 " и др.), которые образуют с Fe3+ более стойкие комплексы, например:
6F- -- 3- + 3NCS-.
Реакции ионов железа (Ш), (П)
Действие раствора сульфосалициловой кислоты
Катионы железа (III), (II) образуют с сульфосалициловой кислотой комплексы различного цвета в зависимости от рН раствора. При рН=1,8-2,5 образуется комплекс фиолетового цвета:
При рН= 4-8 образуется комплекс красного цвета:

При рН=8-11 образуется комплекс желтого цвета:

Реакции, протекающие в систематическом ходе анализа при обнаружении ионов марганца
Марганца (II) гидроксид легко окисляется пероксидом водорода, при этом образуется темно-бурый осадок Н2МпО3 (МпО2- пН2О).
2е + Мп(ОН)2^ + Н2О ^ Н2МпО3^ + 2Н+ 1
2е + Н2О2 + 2Н+ - 2Н2О__
Мп(ОН)2^ + Н2О2 -> Н2МпО3 + Н2О^
Марганец (IV) восстанавливается также до марганца (II) в сернокислой или азотнокислой среде при действии Н2О2:
2е + Н2МпО3^ + 4Н+ ^ Мп2+ + 3Н2О 1 2е + Н2О2 - О2Т + 2Н+__
Н2МпО3^ + Н2О2 + 2Н+ -> Мп2+ + О2Т+ 3Н2О
Сильные окислители, например, персульфат аммония (М14)282О8, окисляют Мп (II) до ионов МпО4-, которые окрашивают раствор в красный цвет:
5е + Мп2+ + 4Н2О ^ МпО4- + 8Н+ 2
2Мп2+ + 5Б2О82- + 8Н2О -> 2МпО4- + 16Н+ + 10БО42-
Реакция протекает при нагревании и в присутствии солей серебра (катализатор). Эту реакцию используют для обнаружения ионов марганца (II) в систематическом ходе анализа.
Реакции ионов висмута
Действие свежеприготовленного натрия гексагидроксостанита (П) Na44-.
Гексагидроксостанит (11)-ионы восстанавливают ионы Bi до металлического висмута черного цвета. Ионы 4- устойчивы только в щелочных растворах. Катионы висмута в этих условиях образуют белый осадок Bi(OH)3:
Sn2+ + 2OH- - Sn(OH)2^, Sn(OH)2^ + 4OH- - 4-, Bi3+ + 3OH- ^ Bi(OH)3^.
3e + Bi(OH)3^ ^Bil + 3OH- 2
2e + 4- - 2-_^ _ | 3
2Bi(OH)3^ + 34- - 2Bi^ + 32- + " 6OH-
При выполнении реакции обнаружения катионов висмута следует избегать избытка концентрированной щелочи и нагревания, так как в этих условиях может выпасть черный осадок Snl- вследствие реакции диспропорционирования:
24- - 2- + Sn^ + 6OH-.
Реакция ионов сурьмы Действие металлического цинка
Металлический цинк на никелевой пластинке восстанавливает ионы сурьмы (III) и (V) до металлической сурьмы:
23- + 3Zn - 2SU + 3Zn2+ + 12C1-.
Никелевая пластинка образует с цинком гальваническую пару, в которой положительным электродом является Ni, а отрицательным - Zn. Никель получает электроны, которые отдает ему цинк, и передает их ионам сурьмы, которые восстанавливаются до металла. Осадок металлической сурьмы на никелевой пластинке не растворяется в хлороводородной кислоте, но растворяется в азотной кислоте:
5e + Sb^ + 3H2O ^ HSbO3^ + 5H+ 3
3e + NO3- + 4H+ - NOt + 2H2O_\_5_
3Sb^ + 5NO3- + 5H+ - 3HSbO3^ + 5NOt + H2O
Систематический ход анализа катионов V аналитической группы
Катионы железа (II) и железа (III) обнаруживают дробным методом в отдельных пробах действием растворов калия гексацианоферрата (III) и гексацианоферрата (II) соответственно:
3Fe2+ + 23- - Fe32^, 4Fe3+ + 34- ^ Fe43^.
Катионы сурьмы (III) и сурьмы (V) мешают обнаружению всех катионов V аналитической группы. Сурьму (III) окисляют раствором HNO3 до сурьмы (V), которая выпадает в виде осадка HSbO3. Осадок отделяют центрифугированием и растворяют в концентрированной хлороводородной кислоте. Сурьму (V) в растворе обнаруживают действием цинка на никелевой пластинке.
Все катионы V группы, оставшиеся в центрифугате, осаждают в виде соответствующих гидроксидов действием концентрированного раствора аммиака.
Для отделения магния гидроксидов к осадку прибавляют насыщенный раствор аммония хлорида и 3\% раствор Н2О2. При этом осадок Mg(OH)2 растворяется, а катионы Mn2+ окисляются до H2MnO3 (MnO2-nH2O). Осадок, состоящий из Fe(OH)3, BiONO3, H2MnO3 (MnO2-nH2O), отделяют центрифугированием. В центрифугате обнаруживают катионы магния действием раствора натрия гидрофосфата в присутствии аммиачного буферного раствора.
При действии на осадок азотной кислоты гидроксиды железа (III) и висмута растворяются, а H2MnO3 (MnO2-nH2O)^ остается в осадке, который отделяют центрифугированием.
В центрифугате катионы висмута обнаруживают действием свежеприготовленного раствора Na4.
Осадок H2MnO3 (MnO2-nH2O) растворяют в азотной кислоте в
присутствии H2O2, при этом MnO2-nH2O восстанавливается до Mn . Их обнаруживают действием раствора аммония персульфата.
Систематический ход анализа смеси катионов V аналитической группы выполняют в соответствии со схемой.
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ V АНАЛИТИЧЕСКОЙ ГРУППЫ
Бе2+, Ре3+, Мп2+, М^+, Ві3+, 8Ъ (III), 8Ъ (V)