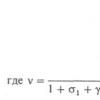Конспект объемные отношения газов при химических реакциях. Расчеты объёмных отношений газов при химических реакциях
Для химической реакции aA + bB = cC + dD
выполняется соотношение
где nА и nВ – количества вступивших в реакцию исходных веществ, пС и nD – количества образовавшихся продуктов, а, b, с и d – стехиометрические коэффициенты.
От количеств веществ легко перейти к их массам:
Для газообразных веществ чаще задают или определяют их объемы. Если реагент В и продукт D – газы, то проводят переход от количеств этих веществ к их объемам:
![]()
При известных (по условию) количестве, массе или объеме (для газа) одного из веществ, участвующих в реакции, можно рассчитать значения всех величин для остальных веществ.
В случае смеси газов А и В, один из которых участвует в реакции, можно найти взятое соотношение их объемов VA: VB, а при заданном соотношении – объем их смеси (или наоборот).
Пример решения задачи
При высокой температуре магний реагирует с азотом, взятым в виде смеси с аргоном, общим объемом 5,6 л (н.у.), и образует 15 г нитрида. Рассчитайте объемное отношение газов V(N2): V(Ar) в исходной смеси.


Задания для самостоятельного решения части А
1. Прореагировало 6 л оксида азота (II) с 5 л кислорода (объемы измерены при равных условиях), следовательно, в конечной смеси объемное отношение продукта к одному из реагентов равно
2. В замкнутом сосуде сожгли 24 г графита в 67,2 л (н. у.) кислорода и получили объемное отношение кислород: продукт равным
3. Пропустили через озонатор 7,5 моль кислорода, который частично превратился в озон. Последний полностью затрачен на «сжигание» (при нормальных условиях) 0,5 моль сероводорода (превращается в SO2); следовательно, объемное отношение O3: O2 на выходе из озонатора составляло
4. Бромид калия массой 142,8 г прореагировал количественно в растворе с хлором, взятым в виде смеси с воздухом в объемном отношении 1 (хлор): 2 (воздух). Общий объем (в литрах) исходной смеси газов был
5. Для полного сгорания 17,92 л (н.у.) смеси СН4 + Н2 потребовался 1 моль кислорода. В исходной смеси объемное отношение СН4: Н2 равно:
6. Газ А, полученный при прокаливании 0,04 моль КClO3 на катализаторе, смешали (при н. у.) в сосуде с газом Б, выделившимся при обработке 6 г кальция водой, и получили смесь с объемным отношением А: Б, равным
7. После сжигания нитробензола в избытке кислорода получена смесь продуктов (азот, углекислый газ, вода), в которой содержится 4 л (н. у.) азота, а объемное отношение N2: O2 равно 4: 1. В этих условиях исходный объем (в литрах, н. у.) кислорода составлял
8. Проведено термическое разложение 1 моль хлорида аммония в стальном баллоне, уже содержавшем 11,2 л (н. у.) аммиака. Конечное объемное отношение NH3: НCl равно
9. Смесь кислорода и хлора с объемным отношением 9: 1 использована для выделения 0,5 моль простого вещества из раствора KI, следовательно, общий объем (в литрах, н. у.) затраченной смеси газов равен
10. Через озонатор пропустили кислород, полученный при прокаливании 1 моль КClO3 на катализаторе, при этом 5 % кислорода превратилось в озон и на выходе из озонатора объемное отношение O2: O3 составило
Физико-химические закономерности формирования тонкопленочных металлополимерных систем из газовой фазы
Тонкопленочные металлополимерные материалы
(металлизированные полимеры, металлические изделия с тонким полимерным покрытием,
многослойные системы и др.), формируемые методами вакуумной техно...
Эпитаксиальный рост Ge на поверхности Si(100)
С физикой
тонких пленок связаны достижения и перспективы дальнейшего развития
микроэлектроники, оптики, приборостроения и других отраслей новой техники.
Успехи микроминиатюризации электронн...
Компоненты, обладающие свойствами понижать горючесть полимерных материалов
Ежегодно пожары
наносят экономике страны ущерб в сотни миллионов рублей. При сгорании
полимерных материалов выделяется большое количество токсичных газов, пагубно
действующих на человека и...
Объемные отношения газов при химических реакциях.
Цель: закрепить знания о газах, уметь вычислять объемные отношения газов, по химическим уравнениям используя закон объемных отношений, применять закон Авогадро и понятие молярного объёма при решении задач.
Оборудование: Карточки с задачами, на доске закон Авогадро.
Ход урока:
I Орг. момент
Повторение
1.Какие существуют вещества в газообразном состоянии?
(Н2, N2, О2, СН4, С2 Н6)
2.Какое понятие характерно для этих газов? («Объем»)
3.Какой ученый предположил, что в состав газов входят 2 атома и какие?
(А.Авогадро, Н2, О2, N2)
4. Какой закон был открыт Авогадро?
(В равных объемных различных газов при одинаковых условиях(t и давления) содержится одинаковое число молекул)
5. По закону Авогадро 1 моль любого газа занимает объем равен (22,4 л/моль)
6.Каким законом обозначается объем газа? (V м – объем молярный)
7. По каким формулам мы находим: V, Vм, количества вещества?
Vм = V v = V V = Vм ∙ v
v Vм
II. Изучение материала
Когда вступивший в реакцию реагент и полученный продукт находится в газообразном состоянии, то по уравнению реакции можно определить их объемные отношения.
Например, рассмотрим взаимодействие водорода с хлором. Например уравнение реакции:
Н2 + CI2 = 2НСI
1 моль 1 моль 2 моль
22,4 л/моли 22,4 л/моли 44,8 л/моли
Как видим, 1 моль водорода и 1 моль хлора, вступив в реакцию, образуют 2 моль хлороводорода. Если сократить эти числовые значения объемов на 22,4, то получим объемное отношения 1:1:2. Таким способом можно определить и объемные отношения газообразных веществ при нормальных условиях.
Закон Авогадро, играющий важную роль в химических расчетах газообразных веществ, формируется следующим образом:
В равных объемах при одинаковых внешних условиях (t и давление) содержится одинаковое число молекул.
Из этого закона вытекает следствие, что 1 моль любого газа при нормальных условиях всегда занимает один и тот же объем (молярный объем газа). Равный 22,4 л.
Коэффициенты в уравнениях реакции показывает число молей и число объемов газообразных веществ.
Пример: Рассчитайте, какой объем кислорода расходуется при взаимодействии с ним 10м³ водорода.
Запишим уравнение реакции
10 м³ х м³
2Н2 + О2 = 2Н2О
2 моль 1 моль
2 м³ 1 м³
По уравнению реакции известно, что водород и кислород вступают в реакцию в объемных отношениях 2:1.
Тогда 10:2 = Х:1, Х = 5 м³. Следовательно, чтобы 10м³ водорода вступили в реакцию необходимо 5 м³ кислорода.
Расчеты с применением закона Авогадро.
I тип задач.
Определение количества вещества по известному объему газа и вычисление объема газа (н.у.) по производству количеству вещества.
Пример 1. Вычислите количество молей кислорода, объем которого при н.у. занимает 89,6 л.
По формуле V = Vм ∙ v находим количество вещества v = V
Vм
v(O2) = _____89,6л___ = 4 моль
22,4 л/моль Ответ: v(O2) = 4 моль
Пример 2. Какой объем при нормальных условиях занимает 1,5 моль кислорода?
v(O2) = Vм ∙ v = 22,4 л/моль ∙ 1,5 моль = 33,6 л.
II тип задач.
Вычисление объема (н.у.) по массе газообразного вещества.
Пример. Вычислите, какой объем (при н.у.) занимают 96 г кислорода. Сначала находим молярную массу кислорода О2. Оно равно М (О2) = 32 г/моль.
Теперь по формуле m = M ∙ v находим.
v(O2) = m = 96 г____ = 3 моль.
М 32 г/моль
Вычислите объем, занимаемый 3 моль кислорода (н.у), по формуле V = Vм ∙ v: V(O2) = 22,4 л/моль ∙ 3 моль = 67,2 л.
Ответ: V(O2) = 67,2 л.
III. Закрепление урока
1. работа с упр. стр 80 (8,9)
2. д/з: параграф 29 стр. 80 упр. 10
Приложенные файлы
Объемные отношения газов при химических реакциях.
Цель: закрепить знания о газах, уметь вычислять объемные отношения газов, по химическим уравнениям используя закон объемных отношений, применять закон Авогадро и понятие молярного объёма при решении задач.
Оборудование: Карточки с задачами, на доске закон Авогадро.
Ход урока:
I Орг. момент
Повторение
1.Какие существуют вещества в газообразном состоянии?
(Н 2 , N 2 , О 2 , СН 4 , С 2 Н 6 )
2.Какое понятие характерно для этих газов? («Объем»)
3.Какой ученый предположил, что в состав газов входят 2 атома и какие?
(А.Авогадро, Н 2 , О 2 , N 2 )
4. Какой закон был открыт Авогадро?
(В равных объемных различных газов при одинаковых условиях(t и давления) содержится одинаковое число молекул)
5. По закону Авогадро 1 моль любого газа занимает объем равен (22,4 л/моль)
6.Каким законом обозначается объем газа? (V м – объем молярный)
7. По каким формулам мы находим: V , V м, количества вещества?
V м = V v = V V = V м ∙ v
v V м
II . Изучение материала
Когда вступивший в реакцию реагент и полученный продукт находится в газообразном состоянии, то по уравнению реакции можно определить их объемные отношения.
Например, рассмотрим взаимодействие водорода с хлором. Например уравнение реакции:
Н 2 + CI 2 = 2НС I
1 моль 1 моль 2 моль
22,4 л/моли 22,4 л/моли 44,8 л/моли
Как видим, 1 моль водорода и 1 моль хлора, вступив в реакцию, образуют 2 моль хлороводорода. Если сократить эти числовые значения объемов на 22,4, то получим объемное отношения 1:1:2. Таким способом можно определить и объемные отношения газообразных веществ при нормальных условиях.
Закон Авогадро, играющий важную роль в химических расчетах газообразных веществ, формируется следующим образом:
В равных объемах при одинаковых внешних условиях ( t и давление) содержится одинаковое число молекул.
Из этого закона вытекает следствие, что 1 моль любого газа при нормальных условиях всегда занимает один и тот же объем (молярный объем газа). Равный 22,4 л.
Коэффициенты в уравнениях реакции показывает число молей и число объемов газообразных веществ.
Пример: Рассчитайте, какой объем кислорода расходуется при взаимодействии с ним 10м³ водорода.
Запишим уравнение реакции
10 м³ х м³
2Н 2 + О 2 = 2Н2О
2 моль 1 моль
2 м³ 1 м³
По уравнению реакции известно, что водород и кислород вступают в реакцию в объемных отношениях 2:1.
Тогда 10:2 = Х:1, Х = 5 м³. Следовательно, чтобы 10м³ водорода вступили в реакцию необходимо 5 м³ кислорода.
Расчеты с применением закона Авогадро.
I тип задач.
Определение количества вещества по известному объему газа и вычисление объема газа (н.у.) по производству количеству вещества.
Пример 1. Вычислите количество молей кислорода, объем которого при н.у. занимает 89,6 л.
По формуле V = V м ∙ v находим количество вещества v = V
V м
v (O 2 ) = _____89,6л___ = 4 моль
22,4 л/моль Ответ: v (O 2 ) = 4 моль
Пример 2. Какой объем при нормальных условиях занимает 1,5 моль кислорода?
v (O 2 ) = V м ∙ v = 22,4 л/моль ∙ 1,5 моль = 33,6 л.
II тип задач.
Вычисление объема (н.у.) по массе газообразного вещества.
Пример. Вычислите, какой объем (при н.у.) занимают 96 г кислорода. Сначала находим молярную массу кислорода О 2 . Оно равно М (О 2 ) = 32 г/моль.
Теперь по формуле m = M ∙ v находим.
v (O 2 ) = m = 96 г____ = 3 моль.
М 32 г/моль
Вычислите объем, занимаемый 3 моль кислорода (н.у), по формуле V = V м ∙ v :
V (O 2 ) = 22,4 л/моль ∙ 3 моль = 67,2 л.
Ответ: V (O 2 ) = 67,2 л.
III . Закрепление урока
1. работа с упр. стр 80 (8,9)
2. д/з: параграф 29 стр. 80 упр. 10
Цели урока:
1) учебная: ознакомить учащихся с законом объемных отношений газов Гей-Люссака; научить решать расчетные задачи, применяя изученный закон;
2) воспитательная: воспитывать бережное отношение учащихся к окружающей человека воздушной среде; также воспитывать уверенность в своих силах, умение самостоятельно работать с учебным материалом;
3) развивающая: углубить представления учащихся о веществах в газообразном агрегатном состоянии; совершенствовать умение решать расчетные задачи, если в реакции принимают участие или образуются газообразные вещества.
Расчетная задача 2. Вычисление объемных отношений газов.
Тип урока: урок изучения и первичного закрепления новых знаний.
Формы работы: беседа по вопросам, рассказ учителя, работа учащихся в группах (парах), индивидуальная работа учащихся.
Ход урока.
І. Организация класса к уроку.
ІІ. Основная часть.
1. Взаимопроверка домашнего задания (с правого оборота доски):
Ответы упражнения 187 (с.134):
Ответы упражнения 199а* (с.145):
Одновременно с проверкой домашнего задания двое учащихся работают у доски по заданиям на карточках (приложение 2):
Учащийся 2. Составьте формулы веществ по их названиям:
а) 4 - метил - 2 - пентен;
б) 3 - метил - 1 - бутин.
2. Актуализация опорных знаний учащихся.
Беседа по вопросам:
1. В каких агрегатных состояниях могут находиться вещества?
Известно три агрегатных состояния, в которых могут находиться вещества: твердое, жидкое и газообразное.
2. Охарактеризуйте особенности газообразного состояния вещества.
Большие расстояния между молекулами или атомами вещества (около 1800-2000 размеров частицы), объем газообразных веществ не зависит от размера их молекул.
3. Назовите простые вещества-газы, укажите положение образующих их атомов в периодической системе химических элементов Д.И. Менделеева.
Простые вещества-газы: (водород), Гидроген №1; (азот), Нитроген №7; (кислород), Оксиген №8; (фтор), Флуор №9; (хлор), Хлор №17.
Запишите из технологической карты урока (приложение 1) в тетради формулы газообразных веществ, изучаемых в школьном курсе химии:
Формулы газообразных веществ:
1) простые вещества -
3) оксиды неметаллов -
3. Изучение нового материала.
В ходе химических реакций объем реагирующих веществ может изменяться.
Это происходит чаще всего тогда, когда в реакции принимают участие газообразные исходные вещества или образуются газообразные продукты реакции.
Объем любого газа при постоянных физических условиях (температуре и давлении) пропорционален массе этого газа.
Взвешивать газообразные вещества довольно проблематично, поэтому в практических расчетах массы газов удобнее заменить их объемами.
Анализируя результаты опытов с газообразными веществами, французский ученый Жозеф Луи Гей-Люссак в 1808 году сформулировал закон объемных отношений.
С.146, запишите в тетрадь из учебника (или технологической карты урока) формулировку закона объемных отношений:
4. Закрепление изученного материала. Решение расчетных задач (задачи 1 и 2 записаны на лицевой стороне правого разворота, остальные 3 задачи напечатаны на карточках и решаются на месте в группах).
1. У доски с пояснениями работает один учащийся, остальные работают на месте.
Задача 1. Какой объем водорода выделяется при разложении 7 литров метана?
Ответ: V() = 10,5 л
Три группы (пары) учащихся получают задание для выполнения на месте (приложение 3, раздать по одному на группу или пару), с отчетом у доски:
Напоминаю учащимся о том, что кислород для дыхания и сжигания топлива мы получаем из воздуха, а при этом выделяется углекислый газ, повышенное содержание которого в атмосфере приводит к «парниковому» эффекту.
2. У доски с пояснениями работает один учащийся, остальные работают на месте.
ІІІ. Заключение.
Подведение итогов занятия (рефлексия), домашнее задание.
Вопросы рефлексии: 1) На уроке я работал (как?)
2) Своей работой на уроке я (доволен, нет)
3) Урок для меня был (каким?)
4) На уроке я узнал (о чем?)
5) Материал урока был мне (понятен, непонятен)
6) Мое настроение после урока …
Мы изучили на сегодняшнем уроке закон объемных отношений Гей-Люссака и научились решать расчетные задачи, когда в реакции принимают участие газообразные исходные вещества или образуются газообразные продукты реакции.
Запишите домашнее задание (задание записано на обороте доски или в технологической карте урока):
§23(с.145-149), упр. 206, 207* (с.149)
Приложение 1
Технологическая карта урока.
Тема. Объемные отношения газов при химических реакциях.
1а. Проверка домашнего задания (с правого оборота доски)
Упражнение 187 (с.134),
Упражнение 199а* (с.145).
1б. Работа у доски с формулами (2 учащихся получают задания на карточках).
2. Запишите в тетрадь:
Формулы газообразных веществ:
1) простые вещества -
2) летучие водородные соединения -
3) оксиды неметаллов -
4) органические вещества -
3. Запишите в тетрадь:
с.146 Закон объемных отношений:
Объемы газов, вступающих в реакцию и образующихся в
результате реакции, соотносятся как небольшие целые числа.
Например: метан при высокой температуре разлагается на ацетилен и водород
4. Решение расчетных задач (задачи 1 и 2 на доске, остальные - в группах).
Задача 1. Какой объем водорода выделяется при разложении 7 литров метана C ?
Задача 2. Вычислите объемы кислорода и воздуха, необходимые для сжигания 8 литров этана.
Группа 1. Какой объем карбон (IY) оксида выделяется при полном сгорании 2,75 литров этилена.
Группа 2. Вычислите объемы кислорода и воздуха, необходимые для сжигания 4,5 литров бутена.
Группа 3. Какой объем кислорода необходим для полного сжигания 12 литров бутана.
5. Домашнее задание: §23(с.145-149), упр.206, 207*(с.149).
Приложение 2
Учащийся 1.
Назовите вещества по их формулам:
Учащийся 2.
Составьте формулы веществ по их названиям:
а) 4 - метил - 2 - пентен;
б) 3 - метил - 1 - бутин.
Приложение 3
Какой объем карбон (IY) оксида выделяется при полном сгорании 2,75 литров этилена.
Вычислите объемы кислорода и воздуха, необходимые для сжигания 4,5 литров бутена.
Какой объем кислорода необходим для полного сжигания 12 литров бутана.
В данном разделе использованы материалы методического пособия "Обучение решению задач по химии". Авторы - составители: учитель химии высшей категории, методист Учреждения образования «Гимназии №1 г. Гродно» Толкач Л.Я.; методист учебно-методического отдела Учреждения образования «Гродненский ОИПК и ПРР и СО» Коробова Н.П.
Вычисления с использованием молярного объема газов.
Вычисление относительной плотности газов.
Объемные отношения газов
Один моль любого газа при одинаковых условиях занимает один и тот же объем. Так, при нормальных условиях(н.у.), т.е. при температуре 0 °С и нормальном атмосферном давлении, равном 101,3 кПа, один моль любого газа занимает объем 22,4 дм 3 .
Отношение объема газа к соответствующему химическому количеству вещества есть величина, называемая молярным объемом газа (V m ):
V m = V / n дм 3 , откуда V = V m · n
Для того чтобы определить: легче или тяжелее газ относительно другого газа, достаточно сравнить их плотности:
r 1 / r 2 = M 1 ·V 1 /M 2 ·V 2 = M 1 /M 2 = D 2 .Из выше приведенного выражения видно: для того, чтобы сравнить плотности газов, достаточно сравнить их молярные массы.
Отношение молярной массы одного газа к молярной массе другого газа есть величина, называемая
относительной плотностью ( D 2 ) одного газа по другому газу.Зная относительную плотность одного газа по другому, можно определить его молярную массу:
M
1 = M 2 · D 2 .Воздух является смесью газов, поэтому его «молярная масса» представляет собой массу воздуха объемом 22,4 л. Эта величина численно равна:
М возд = 29 г/моль
Согласно закону Авогадро одинаковое число молекул разных газов при одних и тех же условиях занимает одинаковый объем.
Из этого вытекает второе следствие.
При неизменных температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
Эта закономерность была сформулирована Гей-Люссаком в виде закона объемных отношений газов. Таким образом, если в химической реакции участвуют или получаются газообразные вещества, то по уравнению реакции можно установить их объемные отношения.
Объемы реагирующих и получающихся газов пропорциональны химическим количествам этих веществ:
V 1 / V 2 = n 1 / n 2 т.е. V 1 и V 2
численно равны коэффициентам в уравнении реакции.Пример 1. Баллон вмещает 0,5 кг сжатого водорода. Какой объем займет такое количество водорода? Условия нормальные.
Решение:
1. Вычисляем химическое количество
водорода, содержащееся в баллоне:N
(Н 2 ) = 500/2 = 250 (моль), где М(Н 2 ) = 2 г/моль.2.Так как при нормальных условиях 1 моль любого газа занимает объем 22,4
дм 3 , тоV = V m · n , V ( H 2 ) = 22,4 * 250 = 5600 (дм 3 )
Ответ: 5600 дм 3
Пример2. Каков состав (в %) алюминиево-медного сплава, если при обработке 1 г его избытком соляной кислоты выделилось 1,18 л водорода?
Решение:
1.Так как в реакцию с кислотой вступит только алюминий, то записываем уравнение:
2А1 + 6НС1 = 2А1С1 3 + 3 H 2
2моль 3 моль
2.Вычисляем химическое количество водорода:
n (Н 2 ) = 1.18/22.4= 0,05 (моль)
3.По уравнению реакции вычисляем массу алюминия, содержащегося в сплаве:
3 моль 2 моль алюминия
0,05 моль водорода выделится, если прореагирует x моль алюминия
х = 0.05·2/3 = 0,033 (моль),
m ( Al ) = 0,035·27 = 0,9 (г), где М(А l ) = 27 г/моль
5. Вычисляем массовую долю алюминия в сплаве:
w (А l ) = m ( Al ) / m (сплава) , w ( А1 ) = 0,9/1= 0,9 или 90%.
Тогда массовая доля меди в сплаве 10%
Ответ: 90% алюминия, 10% меди
Пример 3. Определить относительную плотность: а) кислорода по воздуху, б) углекислого газа по водороду.
Решение:
1. Находим относительную плотность кислорода по воздуху:
D возд (О 2 ) = M (О 2 )/ M (возд.) = 32/29= 1,1.
2.Определяем относительную плотность углекислого газа по водороду
D Н2 (СО 2 ) = M (СО 2 )/ M (Н 2 ) = 44/2 = 22.
Ответ: 1,1; 22
Пример 4. Определите объем смеси газов, состоящей из 0,5 моль кислорода, 0,5 моль водорода и 0,5 моль углекислого газа.
Решение:
1. Находим химическое количество смеси газов:
n (смеси) = 0,5 + 0,5 + 0,5 = 1,5(моль).
2. Вычисляем объем смеси газов:
V (смеси) = 22,4 · 1,5 = 33,6(дм 3 ).
Ответ: 33,6 дм 3 смеси
Пример 5. Рассчитайте объем углекислого газа, который получится при сжигании 11,2 м 3 метана СН 4 .
Решение:
1. Записываем уравнение химической реакции горения метана:
CH 4 + 2O 2 = CO 2 + 2H 2 O
1 моль 1 моль
1 м 3 1 м 3
2. Для вычисления объема углекислого газа составляем и решаем пропорцию:
при сжигании 1 м 3 СН 4 получится 1 м 3 СО 2
при сжигании 11,2 м 3 СН 4 получится х м 3 СО 2
х = 11,2·1/1= 11,2 (м 3 )
Ответ : 11,2 м 3 углекислого газа
Пример 6. Стальной баллон для хранения сжатых газов наполнили жидким кислородом массой 8 кг.
Какой объем займет кислород в газообразном состоянии (н.у.) ?
Решение:
1. Вычисляем химическое количество жидкого кислорода:
n ( O 2 ) = 8000/32 = 250 (моль).
2. Вычисляем объем газообразного кислорода:
V ( O 2 ) = 22, 4 · 250 = 5600 дм 3 .
Ответ: 5600 дм 3
Пример 7. Вычислите массу воздуха объемом 1 м 3 (н.у.), если в нем 78 объемных долей азота, 21 - кислорода, 1 - аргона (не считая других газов).
Решение:
1. Исходя из условия задачи, объемы газов в воздухе соответственно равны:
V ( N 2 ) = 1 · 0,78 = 0,78 м 3 ;
V (О 2 ) = 1 · 0,21 = 0,21 м 3 ,
V (А r ) = 1 · 0,01 = 0,01 м 3 .
2. Вычисляем химическое количество каждого газа:
n ( N 2 ) = 0,78/22,4·10 -3 = 34,8 (моль),
n (О 2 ) = 0,21/22,4·10 -3 = 9,4 (моль),
n (А r ) = 0,01/22,4·10 -3 = 0,45 (моль).
3. Вычисляем массы газов:
m (N 2 ) = 34,8 · 28 = 974(г),
m (О 2 ) = 9,4 · 32 = 30(г),
m (А r ) = 0,45 · 40 = 18(г).
4. Вычисляем массу воздуха:
m (воздуха) = 974 + 301 + 18 = 1293 (г) или 1,293 кг.
Ответ: 1,293 кг воздуха
Пример 8. При поджигании в эвдиометре смеси кислорода и водорода объемом 0,1 м 3 объем смеси уменьшился на 0,09 м 3 .
Какие объемы водорода и кислорода были в исходной смеси, если оставшийся газ горит (н.у.) ?
Решение:
1. Записываем уравнение реакции:
2Н 2 + О 2 = 2Н 2 О
2 моль 1моль 2моль
2. Определяем объемы газов, вступивших в реакцию.
Объем газовой смеси сократился за счет образования жидкой воды, поэтому объем газов, вступивших в реакцию, равен 0,09 м 3 .
Т.к. газы вступают в реакцию в отношении 2:1, то из 0,09 м 3 две части
приходятся на водород, а одна – на кислород. Следовательно, в реакцию
вступило 0,06 м 3 водорода и 0,03 м 3 кислорода.
3. Вычисляем объемы газов в исходной смеси.
Т.к. оставшийся газ горит, то это водород – 0,01 м 3 .
V (Н 2 ) = 0,01 + 0,06 = 0,07 (м 3 ) или 70 л,
V (О 2 ) = 0,1 – 0,07 = 0,03 (м 3 ) или 30 л.
Ответ: 70 л водорода, 30 л кислорода
Пример 9. Определите плотность по водороду газовой смеси, состоящей из 56л аргона и 28 л азота (н.у.) ?
Решение:
1. Исходя из определения относительной плотности газов,
D H 2 = M (смеси) / M (H 2 ).
2. Вычисляем химическое количество и массу смеси газов:
n (Ar ) = 5.6/22.4= 2,5 (моль);
n (N 2 ) = 28/22.4= 1,25 (моль);
n (смеси) = 2,5 + 1,25 = 3,75 (моль).
m (Ar ) = 2,5 · 40 = 100 (г),
m (N 2 ) = 1,25 · 28 = 35 (г),
m (смеси) = 100 + 35 = 135 (г), т. к.
М (А r ) = 40 г/моль, М (N 2 ) = 28 г/моль.
3. Вычисляем молярную массу смеси:
М(смеси) = m (смеси) / n (смеси) ;
М(смеси) = 135/3,75= 36 (г/моль)
4. Вычисляем относительную плотность смеси газов по водороду:
D H 2 = 36/2 = 18.
Ответ: 18
Пример 10. Можно ли полностью сжечь 3 г древесного угля в трехлитровой банке, наполненной кислородом (н.у.)?
Решение:
1. Записываем уравнение реакции горения угля:
С + О 2 = СО 2
1моль 1моль
2. Вычисляем химическое количество угля:
n (С) = 3/12 = 0,25 (моль), т. к. М (С) = 12 г/моль.
Химическое количество кислорода, необходимого для реакции, будет тоже равно 0,25 моль (исходя из уравнения реакции).
3. Вычисляем объем кислорода, необходимый для сжигания 3 г угля:
V (O 2 ) = 0,25 · 22,4 = 5,6 (л).
4. Поскольку газ занимает объем сосуда, в котором он находится, то имеется 3 л кислорода. Следовательно, этого количества не хватит для сжигания 3 г угля.
Ответ: не хватит
Пример 11. Во сколько раз увеличится объем жидкой воды в результате превращения ее в пар при н.у.?