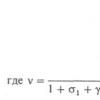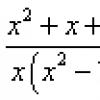Теоретическое введение. различают три вида спектров излучения — линейчатые, полосатые и сплошные. Спектры испускания и поглощения атомов Для каких тел характерны полосатые спектры поглощения
Различают три вида спектров излучения - линейчатые, полосатые и сплошные. Линейчатые спектры наблюдаются в тех случаях, когда излучают отдельные атомы или ионы. Они состоят из ряда характерных для данного вещества линий, разделенных темными промежутками. Каждой линии соответствует определенная длина волны, называемая монохроматической. Линейчатые спектры характеризуют явления, происходящие внутри атома.
Полосатые спектры испускаются молекулами. Полоса представляет собой ряд близко расположенных спектральных линий. Излучение полосатых спектров свидетельствует об усложнении энергетических состояний молекулы по сравнению с состояниями изолированного атома, вследствие колебательного и вращательного движений составляющих ее ядер.
Сплошные спектры испускаются твердыми телами. Непрерывный характер этих спектров является следствием сильного взаимодействия частиц, составляющих твердое тело.
Вид линейчатого спектра зависит от строения атома соответствующего химического элемента, поэтому всем химическим элементам присущи строго определенные линейчатые спектры, отличающиеся друг от друга как числом линий, так и их длинами волн. Наиболее простой линейчатый спектр дает атом водорода, имеющий самое простое строение. Поиск объяснений закономерностей, присущих этому спектру, привело к созданию квантовомеханической теории атома.
Прежде всего следует отметить, что линии в спектре излучения любого атома, в том числе и атома водорода, расположены не беспорядочно, а могут быть объединены в группы, называемые сериями. Расположение линий в этих сериях подчинено определенным закономерностям. В видимой части спектра атома водорода это серия Бальмера, в ультрафиолетовой - серия Лаймана, в ближней инфракрасной - серия Пашена и т.д. Найденная опытным путем формула для длин волн l линий в каждой из этих серий имеет вид:
Ее называют обобщенной формулой Бальмера. В этой формуле R = 1,097×10 7 м -1 - постоянная Ридберга, n и m целые числа. При заданном n число m принимает все целочисленные значения, начиная с n + 1 . Если n = 1 формула (1) описывает серию Лаймана, n = 2 серию Бальмера, n = 3 - серию Пашена.
Физический смысл этой формулы вытекает из теории строения атома водорода и водородоподобных атомов, созданной Бором на основе квантовой гипотезы Планка и классической планетарной модели атома Резерфорда. Основные положения развитой им теории Бор постулировал.
Первый постулат: в атоме существует ряд дискретных стационарных состояний, которым соответствуют определенные значения энергии атома: Е 1 , Е 2 , Е 3 , … . В стационарном состоянии атом не излучает и не поглощает энергии.
Второй постулат: испускание и поглощение энергии происходит при переходе из одного стационарного состояния в другое. При этом испускается или поглощается квант энергии hn , равный разности энергий двух стационарных состояний:
hn = E m - E n (2)
где h - постоянная Планка. Выражение (2) определяет частоту n монохроматического излучения, испускаемого или поглощаемого атомом при переходе из состояния m в состояние n (условие частот Бора).
Дискретные стационарные состояния в теории Бора отбирались с помощью специального правила квантования орбит, которое формулировалось следующим образом: из всех возможных согласно классической механике орбит осуществляются только такие, на которых момент импульса электрона кратен величине (третий постулат):
В формуле (3) m – масса электрона; V n - скорость электрона на n -й стационарной орбите; r n - радиус этой орбиты; n - целое число: 1, 2, 3, ....
Следуя Бору, рассмотрим атомную систему, состоящую из ядра с зарядом Ze и одного электрона с зарядом - e.
При Z = 1 такая система соответствует атому водорода, при иных Z - водородоподобному атому, т.е. атому с порядковым номером Z, из которого удалены все электроны, кроме одного. Для упрощения расчетов предположим, что электрон вращается по круговой орбите, и масса ядра бесконечно велика по сравнению с массой электрона, а ядро неподвижно.
Центростремительная сила, удерживающая электрон на n-ой стационарной орбите, создается силой кулоновского притяжения к ядру.
Отсюда: , (4)
т.е. при движении электрона по орбите его кинетическая энергия и потенциальная энергия связаны отношением 2T = -U (5)
Разделив уравнение (4) на уравнение (3), получим выражение для скорости электрона на n-й стационарной орбите
Полная энергия (Е) электрона на n-й стационарной орбите складывается из кинетической и потенциальной энергий и, с учетом формулы (5), равна:
Подставляя в эту формулу значение скорости (6), получим для энергий стационарных состояний атома следующее выражение:
При переходе электрона с орбиты m на орбиту n излучается в соответствии с формулой (3) квант энергии
Отсюда частота спектральной линии
В спектроскопии обычно пользуются волновыми числами . Тогда
Для водорода (Z = 1) формула (7) принимает вид:
и совпадает с обобщенной формулой Бальмера (1), которая была найдена для волновых чисел спектральных линий атома водорода эмпирическим путем. Из формул (1) и (8) следует, что
Это значение совпадает с экспериментально определённым значением постоянной Ридберга.
На рис.1 показана схема энергетических уровней и три серии спектральных линий атома водорода.
Переходы с высших уровней на уровень n = 1 соответствуют излучению ультрафиолетовой серии Лаймана (I), для которой из формулы (8) получаем:
Где m = 2, 3, 4, ...
Переходы с высших уровней на уровень n = 2 соответствуют излучению видимой серии Бальмера (II):
Где m = 3, 4, 5, ...
Переходы с высших уровней на уровень n = 3 соответствуют излучению инфракрасной серии Пашена (III):
Где m = 4, 5, 6, .…
При поглощении света атомом электроны переходят с низших уровней на высшие. При этом атом переходит из основного состояния в возбужденное.
Теории Бора была свойственна внутренняя логическая противоречивость, поэтому она не могла стать последовательной полной теорией атомных явлений. В настоящее время спектры атомов и молекул объясняются в рамках квантовой механики.
Подход к описанию состояния микрочастиц в квантовой механике принципиально отличается от классического. Он не позволяет определить однозначно положение рассматриваемой частицы в пространстве и ее траекторию, как это делается в классической механике, так как в микромире эти понятия теряют смысл, а лишь предсказывает: с какой вероятностью можно обнаружить эту частицу в различных точках пространства. Поэтому квантовая механика имеет статистический характер.
Основу математического аппарата квантовой механики составляет утверждение, что описание состояния системы осуществляется определенной функцией координат и времени Y, характеризующей это состояние. Эту функцию называют волновой. Физический смысл имеет не сама волновая функция, а квадрат ее модуля, который определяет вероятность dw обнаружения объекта (микрочастицы) в элементе объема dV. Если Y-функция нормирована, то dw = |Y| 2 dV (9)
Выясним свойства волновой функции. В силу сказанного выше о физическом смысле |Y| 2 волновая функция, Y должна быть:
1. конечной, т.к. вероятность не может быть больше единицы;
2. однозначной;
3. непрерывной, т.к. вероятность не может изменяться скачкообразно.
Таким образом, для описания состояния системы в квантовой механике необходимо знать волновую функцию этой системы. Она находится из уравнения Шредингера, являющегося основным уравнением в нерелятивистской квантовой механике. Уравнение это не выводится, а постулируется, исходя из общих соображений. Справедливость его доказывается совпадением полученных из него теоретических результатов с опытными фактами. В общем случае уравнение Шредингера имеет следующий вид:
здесь m - масса частицы, U - функция координат и времени, равная взятому с обратным знаком потенциалу силового поля, i - мнимая единица, - оператор Лапласа, .
Если силовое поле, в котором находится частица, стационарно (не зависит от времени), то потенциал U от времени не зависит и приобретает смысл потенциальной энергии рассматриваемой частицы во внешнем силовом поле. В этом случае Y можно представить в виде произведения двух функций, одна из которых зависит только от координат, а другая только от времени
здесь Е - полная энергия частицы, которая в случае стационарного поля с течением времени не меняется.
После подстановки этого выражения в уравнение (10) для функции y(x,y,z) получается следующее уравнение:
которое называют уравнением Шредингера для стационарных состояний.
Рассмотрим атом водорода с точки зрения квантовой механики. Подставим в стационарное уравнение Шредингера значение потенциальной энергии электрона в поле ядра:
Уравнение (11) в этом случае принимает вид:
Так как поле ядра атома водорода обладает сферической симметрией, то данное уравнение целесообразно решать в сферической системе координат (r, j, Q) . Решение проводят методом разделения переменных, представляя волновую функцию в виде произведения двух функций, одна из которых зависит только от r , а вторая только от угловых координат j , Q.
y(r,Q,j) = R(r)×Y(Q,j)
При таком представлении вероятность частицы иметь значения координаты в интервале от r до r+dr определяется квадратом |rR| 2 .
Решение уравнения Шредингера (12) приводит к следующим основным результатам.
1. Электрон водорода обладает дискретным энергетическим спектром. Собственные значения энергии определяются выражением:
где n - главное квантовое число, принимающее любое целое положительное значение (n = 1, 2, 3, ...).
2. Орбитальный момент импульса электрона L может принимать лишь следующий дискретный ряд значений:
где l - орбитальное (азимутальное) квантовое число. Оно может принимать любое значение из ряда: l = 0, 1, 2, 3, ..., (n-1) - всего n значений. Состояние с l = 0 принято называть s - состоянием, с l = 1 – р - состоянием, c l = 2 – d-состоянием, с l = 3 – f - состоянием и т.д.
3. Орбитальный момент импульса может ориентироваться относительно физически выделенного направления в пространстве (z) лишь таким образом, что проекция его на это направление кратна , поэтому
m - называется магнитным квантовым числом. Оно может принимать значения:
m =0, ±1, ±2, … , ±l – всего (2 l + 1) значений.
Таким образом, состояние электрона в атоме водорода определяется тремя квантовыми числами - главным n , определяющим энергию состояния E n ; азимутальным l , характеризующим момент импульса электрона L , и магнитным m , определяющим ориентацию L относительно выделенного направления в пространстве. Состояния описываются собственными волновыми функциями Y n , l , m являющимися решениями уравнения Шредингера (18) .
Уравнение Шредингepa является нерелятивистским. Учет релятивистских эффектов (уравнение Дирака) приводит к существованию у электрона собственного момента количества движения - спина, определяемого квантовым числом s , равным 1/2:
Проекция спина на выделенное направление z может принимать 2s + 1= 2 различных значений:
где - квантовое число проекции спина электрона. С учетом спина состояние электрона в атоме характеризуется четырьмя квантовыми числами: к квантовым числам n, l, m следует добавить спиновое квантовое число m s .
Отметим, что дискретность физических величин, характерная для явлений атомного мира, в квантовой механике естественным образом вытекает из решения уравнения Шредингера (Дирака), в то время как в теории Бора ее приходилось вводить с помощью дополнительных условий существенно неклассического характера.
Часть А. Выберите правильный ответ:
А) Лампа дневного света
Б) Экран телевизора
В) Инфракрасный лазер
Г) Лампа накаливания
А) Для нагретых твердых тел
Б) Для нагретых жидкостей
А) Для нагретых твердых тел
Б) Для нагретых жидкостей
Г) Для нагретых атомарных газов
Часть В . Для каждой
А) Сплошной спектр
Б) Линейчатый спектр
В) Полосатый спектр
Г) Спектры поглощения
Физика 11 Тест « Виды излучения и спектров»
Часть А. Выберите правильный ответ:
А1. Излучение какого тела является тепловым?
А) Лампа дневного света
Б) Экран телевизора
В) Инфракрасный лазер
Г) Лампа накаливания
А2. Для каких тел характерны полосатые спектры поглощения и испускания?
А) Для нагретых твердых тел
Б) Для нагретых жидкостей
В) Для любых перечисленных выше тел
Г) Для нагретых атомарных газов
Д) Для разреженных молекулярных газов
А3. Для каких тел характерны линейчатые спектры поглощения и испускания?
А) Для нагретых твердых тел
Б) Для нагретых жидкостей
В) Для разреженных молекулярных газов
Г) Для нагретых атомарных газов
Д) Для любых перечисленных выше тел
Часть В . Для каждой характеристики выберите соответствующий вид спектра
- Спектры получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы которого находятся в невозбужденном состоянии
- Состоит из отдельных линий разного или одного цвета, имеющих разные расположения
- Излучают нагретые твердые и жидкие вещества, газы, нагретые под большим давлением.
- Дают вещества, находящиеся в молекулярном состоянии
- Испускается газами, парами малой плотности в атомарном состоянии
- Состоит из большого числа тесно расположенных линий
- Одинаковы для разных веществ, поэтому их нельзя использовать для определения состава вещества
- Это совокупность частот, поглощаемых данным веществом. Вещество поглощает те линии спектра, которые и испускает, являясь источником света
- Это спектры, содержащие все длины волны определенного диапазона.
- Позволяет по спектральным линиям судить о химическом составе источника света
А) Сплошной спектр
Темы кодификатора ЕГЭ : линейчатые спектры.
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то возникнет хорошо известный вам непрерывный спектр (рис. 1 )(Изображения на рис. 1 , 2 и 3 взяты с сайта www.nanospectrum.ru):
Рис. 1. Непрерывный спектр
Спектр называется непрерывным потому, что в нём присутствуют все длины волн видимого диапазона - от красной границы до фиолетовой. Мы наблюдаем непрерывный спектр в виде сплошной полосы, состоящей из разных цветов.
Непрерывным спектром обладает не только солнечный свет, но и, например, свет электрической лампочки. Вообще, оказывается, что любые твёрдые и жидкие тела (а также весьма плотные газы), нагретые до высокой температуры, дают излучение с непрерывным спектром.
Ситуация качественно меняется, когда мы наблюдаем свечение разреженных газов. Спектр перестаёт быть непрерывным: в нём появляются разрывы, увеличивающиеся по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым - состоящим из отдельных достаточно тонких линий.
Мы рассмотрим два типа линейчатых спектров: спектр испускания и спектр поглощения.
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до достаточно высокой температуры), мы увидим примерно следующую картину (рис. 2 ):
Рис. 2. Линейчатый спектр испускания
Этот линейчатый спектр, образованный тонкими изолированными разноцветными линиями, называется спектром испускания .
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Более того, для каждого химического элемента спектр испускания оказывается уникальным, играя роль «удостоверения личности» этого элемента. По набору линий спектра испускания можно однозначно сказать, с каким химическим элементом мы имеем дело.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем заключить, что свет излучают атомы сами по себе . Таким образом, атом характеризуется дискретным, строго определённым набором длин волн излучаемого света . У каждого химического элемента, как мы уже сказали, этот набор свой.
Спектр поглощения
Атомы излучают свет, переходя из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. Атом, поглощая свет, совершает обратный процесс - переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но на сей раз в холодном состоянии (при достаточно низкой температуре). Свечения газа мы не увидим; не будучи нагретым, газ не излучает - атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь наш холодный газ пропустить свет с непрерывным спектром, то можно увидеть что-то вроде этого (рис. 3 ):
Рис. 3. Линейчатый спектр поглощения
На фоне непрерывного спектра падающего света появляются тёмные линии, которые образуют так называемый спектр поглощения . Откуда берутся эти линии?
Под действием падающего света атомы газа переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов годятся не любые длины волн, а лишь некоторые, строго определённые для данного сорта газа. Вот именно эти длины волн газ и «забирает себе» из проходящего света.
Более того, газ изымает из непрерывного спектра ровно те самые длины волн, которые излучает сам! Тёмные линии в спектре поглощения газа в точности соответствуют ярким линиям его спектра испускания. На рис. 4 сопоставлены спектры испускания и поглощения разреженных паров натрия (изображение с сайта www.nt.ntnu.no):

Рис. 4. Спектры поглощения и испускания для натрия
Впечатляющее совпадение линий, не правда ли?
Глядя на спектры испускания и поглощения, физики XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. В самом деле, что-то ведь внутри атома должно обеспечивать механизм излучения и поглощения света!
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов; стало быть, атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Строению атома будет посвящён следующий листок.
Спектральный анализ
Использование линейчатых спектров в качестве уникальных «паспортов» химических элементов лежит в основе спектрального анализа
- метода исследования химического состава вещества по его спектру.
Идея спектрального анализа проста: спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов, после чего делается вывод о присутствии или отсутствии того или иного химического элемента в данном веществе. При определённых условиях методом спектрального анализа можно определить химический состав не только качественно, но и количественно.
В результате наблюдения различных спектров были открыты новые химические элементы.
Первыми из таких элементов были цезий и рубидий; они получили название по цвету линий своего спектра (В спектре цезия наиболее выражены две линии небесно-синего цвета, по-латыни называемого caesius. Рубидий же даёт две характерные линии рубинового цвета).
В 1868 году в спектре Солнца были обнаружены линии, не соответствующие ни одному из известных химических элементов. Новый элемент был назван гелием (от греческого гелиос - солнце). Впоследствии гелий был обнаружен в атмосфере Земли.
Вообще, спектральный анализ излучения Солнца и звёзд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же «набора кирпичиков».
В семнадцатом веке, обозначающее совокупность всех значений какой-либо физической величины. Энергии, массы, оптического излучения. Именно последнее зачастую имеется в виду, когда мы говорим о спектре света. Конкретно спектр света представляет собой совокупность полос оптического излучения разной частоты, часть из которых мы можем видеть повседневно в окружающем мире, часть же их недоступна для невооруженного глаза. В зависимости от возможности восприятия человеческим глазом, спектр света разделяют на видимую часть и невидимую. Последнюю, в свою очередь, - на инфракрасный и ультрафиолетовый свет.
Виды спектров
Существуют также разные виды спектров. Таких выделяют три, в зависимости от спектральной плотности интенсивности излучения. Спектры могут быть непрерывные, линейчатые и полосатые. Виды спектров определяют с помощью
Непрерывный спектр
Непрерывный спектр образуется нагретыми до высокой температуры твердыми телами или газами высокой плотности. Всем известная радуга семи цветов является прямым примером непрерывного спектра.
Линейчатый спектр
Также представляет виды спектров и исходит от любого вещества, находящегося в газообразном атомарном состоянии. Здесь важно отметить, что именно в атомарном, а не молекулярном. Такой спектр обеспечивает крайне низкое взаимодействие атомов друг с другом. Поскольку взаимодействия нет, атомы излучают волны перманентно одинаковой длины. Примером такого спектра является свечение газов, нагретых до высокой температуры.

Полосатый спектр
Полосатый спектр визуально представляет собой отдельные полосы, четко разграниченные достаточно темными промежутками. При этом каждая из этих полос не является излучением строго определенной частоты, а состоит из большого количества близко расположенных друг к другу световых линий. Примером таких спектров, как и в случае с линейчатым, является свечение паров при высокой температуре. Однако они создаются уже не атомами, а имеющими крайне тесную общую связь молекулами, что и обуславливает подобное свечение.
Спектр поглощения
Однако на этом виды спектров все-таки не заканчиваются. Дополнительно выделяют еще такой вид, как спектр поглощения. При спектральном анализе спектр поглощения - это темные линии на фоне непрерывного спектра и, по существу, спектр поглощения - это выражение зависимости от показателя поглощения вещества, который может быть более или менее высоким.

Хотя существует широкий диапазон экспериментальных подходов к измерению спектров поглощения. Наиболее распространенным является эксперимент, когда генерируемый пучок излучения пропускается через охлажденный (для отсутствия взаимодействия частиц и, следовательно, свечения) газ, после чего определяется интенсивность излучения, проходящего через него. Переданная энергия вполне может быть использована для вычисления поглощения.