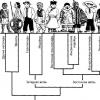
Особые названия соединений элементов 3 главной группы. Общая характеристика. Свойства. Раздел: Главные переходные металлы
К р-элементам III группы периодической системы Д. И. Менделеева относятся: бор В, алюминий Аl, галлий Ga, индий In и таллий Тl. Электронная конфигурация атомов ns 2 np 1 .
Ниже сопоставлены некоторые константы, характеризующие свойства атомов p-элементов рассматриваемой группы и соответствующих металлических веществ:
На свойствах р-элементов III группы сказывается d-сжатие (Аl располагается в периодической системе в малом III периоде, a Ga, In и Тl в больших периодах непосредственно после d-элементов). Так, от Аl к Ga атомный радиус несколько уменьшается, а первый ионизационный потенциал возрастает. На свойствах атомов таллия, кроме того, сказывается и f-сжатие. Именно поэтому радиус атома Тl близок радиусу атома In, а энергия ионизации несколько выше.
Бор. В соответствии с электронной структурой атома (1s 2 2s 2 2p 1) бор может быть одновалентным (один неспаренный электрон на энергетическом 2р-подуровне). Однако для бора наиболее характерны соединения, в которых он трехвалентен (при возбуждении атома три неспаренных электрона в энергетических 2s- и 2р-подуровнях).
Свободная 2р-орбиталь в возбужденном атоме бора обусловливает акцепторные свойства многих его соединений, в которых три ковалентные связи образованы по обменному кова-лентному механизму (например, ВВг 3). Эти соединения склонны к присоединению частиц с электронно-донорными свойствами, т. е. к образованию еще одной ковалентной связи по донорно-акцепторному механизму. Например:
BBr 3 + Br - = [ВВr 4 ] -
Известны два изотопа бора: 105 В (19,6%) и 11 5 B (80,4%). Ядра атомов изотопа (105 В) легко поглощают нейтроны:
105 В + 1 0 n = 4 2 He + 7 5 Li
Способность бора поглощать нейтроны обусловливает его применение в ядерной энергетике: из борсодержащих материалов делают регулирующие стержни ядерных реакторов.
Кристаллы бора черного цвета; они тугоплавки (т. пл. 2300 °С), диамагнитны, обладают полупроводниковыми свойствами (ширина запрещенной зоны ΔE=1,55 эВ). Электрическая проводимость бора, как и других металлов, мала и несколько возрастает при повышении температуры.
При комнатной температуре бор химически инертен и взаимодействует непосредственно только с фтором; при нагревании бор окисляется хлором, кислородом и некоторыми другими неметаллами. Например:
4В + 3O 2 = 2В 2 O 3
2В + ЗСl 2 = 2ВСl 3
В соединениях с неметаллами степень окисления бора +3; все эти соединения ковалентны.
Триоксид бора В 2 O 3 - кристаллическое вещество (т. пл. 450 °С, т. кип. 2250 °С), характеризующееся высокими значениями энтальпии и энергии Гиббса образования. При взаимодействии с водой В 2 O 3 переходит в борную кислоту:
В 2 O 3 + ЗН 2 O = 2Н 3 ВO 3
Н 3 ВО 3 - очень слабая (K д ≈ 10 -9) одноосновная кислота. Электролитическая диссоциация Н 3 ВО 3 с отщеплением только одного иона Н + объясняется уже описанными ранее акцепторными свойствами бора: свободная 2р-орбиталь атома бора предоставляется электронному донору ОН - , образующемуся при диссоциации молекул Н 2 O. Процесс протекает по схеме
Н 3 ВО 3 + Н 2 O = Н[В(ОН) 4 ] = Н + + [В(ОН)4] -
Комплексный анион [В(ОН) 4 ] - имеет тетраэдрическую структуру (sp 3 -гибридизация электронных орбиталей). Акцепторные свойства бора в соединениях со степенью окисления + 3 проявляются и в химии его галогенидов. Так, например, легко осуществимы реакции
BF 3 + F - = -
BF 3 + NH 3 =
в которых химическая связь между BF и F - или NH 3 образуется по донорно-акцепторному механизму. Свойство галогенидов бора быть акцепторами электронов обусловливает их широкое применение как катализаторов в реакциях синтеза органических соединений.
Непосредственно с водородом бор не взаимодействует, а с металлами образует бор иды - обычно нестехиометрические соединения Ме 4 В, Ме 2 В, МеВ, Ме 3 В 4 , МеВ 2 и МеВ 6 .
Гидриды бора (бораны) очень ядовиты и имеют весьма неприятный запах. Их получают косвенным путем, чаще всего
при взаимодействии химически активных боридов с кислотами или галогенидов бора с гидридами щелочных металлов:
6MgB 2 + 12НСl = Н 2 + 8В + В 4 Н 10 + 6MgCl 2
8BF 3 + 6LiH = В 2 Н 6 + 6LiBF 4
Простейшее соединение бора с водородом ВН 3 в обычных условиях не существует, sp 2 -Гибридизация электронных орби-талей в атоме бора приводит к координационной ненасыщенности частицы ВНз, вследствие чего происходит объединение двух таких частиц в молекулу диборана: 2ВНз = В 2 Н 6 (ΔG 0 298 = -127 кДж/моль).
В диборане В 2 Н 6 бор находится в состоянии 5р 3 -гибридизации, причем у каждого атома бора одна из четырех гибридных орбиталей пуста, а три другие перекрыты s-орбиталями атомов водорода. Связи между группами ВНз в молекуле В 2 Н 6 образуются по типу водородной связи за счет смещения электронной плотности от одного атома водорода группы ВНз к пустой орбитали другой группы ВНз. Известны и другие бораны, которые можно представить двумя рядами B n H n+4 и B n H n+6 .
Бориды s-металлов химически активны и часто используются для получения смеси боранов при обработке кислотами. Большинство боридов d- и f-металлов жаростойки, очень тверды, химически устойчивы. Их широко используют непосредственно в виде сплавов для изготовления деталей реактивных двигателей, лопаток газовых турбин. Некоторые бориды применяют для изготовления катодов электронных приборов.
Алюминий. Электронная конфигурация атома алюминия выражается формулой 1s 2 2s 2 2p 6 3s 2 3p 1 . На внешнем электронном слое атома есть один неспаренный электрон:
Поэтому алюминий может проявлять валентность, равную единице. Однако эта валентность для алюминия не характерна. Во всех устойчивых соединениях степень окисления алюминия равна +3. Валентность, равная трем, отвечает возбужденному состоянию атома Аl:
По своей распространенности алюминий занимает четвертое место среди всех элементов (после О, Н и Si) и является самым распространенным в природе металлом. Основная масса алюминия сосредоточена в алюмосиликатах: полевых шпатах, слюдах и др.
Алюминий - серебристо-белый легкий и чрезвычайно пластичный металл, обладающий высокой теплопроводностью и электрической проводимостью.
Алюминий химически активен; с хлором и бромом он реагирует при комнатной температуре, а с иодом - при нагревании или в присутствии воды как катализатора. При 800 °С алюминий взаимодействует с азотом, а при 2000 °С - с углеродом. Алюминий проявляет высокое химическое сродство к кислороду (ΔG 0 298 = -1582 кДж/моль):
2Аl + 0,50 2 = Аl 2 O 3 , ΔH 0 298 = -1650 кДж/моль
На воздухе алюминий покрывается очень прочной тончайшей (10 -8 м) оксидной пленкой, которая несколько ослабляет металлический блеск алюминия. Благодаря оксидной пленке поверхность алюминия приобретает высокую коррозионную стойкость. Это прежде всего проявляется в индифферентности алюминия к воде и водяному пару. Вследствие образования защитной пленки алюминий устойчив по отношению к концентрированным азотной и серной кислотам. Эти кислоты на холоду пассивируют алюминий. Склонность к пассивированию позволяет повышать коррозионную стойкость алюминия путем обработки его поверхности сильными окислителями (например, К 2 Сr 2 О 7) или с помощью анодного окисления. При этом толщина оксидной пленки возрастает до 3·10 -5 м. При высоких температурах прочность защитной пленки резко снижается. Если механическим воздействием снять оксидную пленку, алюминий становится крайне реакционноспособным. Он энергично взаимодействует с водой и водными растворами кислот и щелочей, вытесняя водород и образуя катионы или анионы. Взаимодействие алюминия с растворами кислот протекает по уравнению реакции
Аl + 6Н 2 O + ЗН + = [Аl(Н 2 O) 6 ] 3+ + 0,5Н 2
а с растворами щелочей
Аl + ЗН 2 O + ОН - = [Аl(ОН) 4 ] - + 0,5Н 2
Катионы и анионы алюминия легко переходят друг в друга при изменении рН раствора:
[Аl(Н 2 O) 6 ] 3+ + 4OH - = [Аl(ОН) 4 ] - + 6Н 2 O
[Аl(ОН) 4 ] - + 4Н + + 2Н 2 O = [Аl(Н 2 O) 6 ] 3+
В растворе могут образовываться и смешанные соединения, например [Аl(Н 2 O) 5 (ОН)] 2+ ,[Аl(Н 2 O) 4 (ОН) 2 ] + , [Аl(Н 2 O) 3 (ОН) 3 ]. Последнее легко (особенно при нагревании) дегидратируется и переходит в гидроксид А1(ОН)з:
[Аl(Н 2 O) 3 (ОН) 3 ] = Аl(ОН) 3 + ЗН 2 O
Широчайшее применение алюминия в технике основано на его ценных физических и химических свойствах и большой распространенности в земной коре. Вследствие высокой электрической проводимости (4·10 -5 Ом -1 ·см -1) и малой плотности он используется для изготовления электрических проводов. Высокая пластичность алюминия позволяет изготовлять из него тончайшую фольгу, которую применяют в конденсаторах и заменяют алюминием свинец в оболочках кабелей. Из-за ненамагничиваемости сплавы алюминия применяются в радиотехнике.
Основная масса алюминия используется для получения легких сплавов - дуралюмина (94% Аl, остальное Сu, Mg, Мn, Fe и Si), силумина (85-90 % Аl, 10-14 % Si, остальное Na) и др. Алюминий применяется, кроме того, как легирующая добавка к сплавам для придания им жаростойкости. Алюминий и его сплавы занимают одно из главных мест как конструкционные материалы в самолетостроении, ракетостроении, машиностроении и т. п. Коррозионная стойкость алюминия (особенно анодированного) значительно превосходит коррозионную стойкость стали. Поэтому его сплавы используются как конструкционные материалы и в судостроении. С d-элеметами алюминий образует химические соединения - интерметаллиды (алюминиды): NiAl, Ni 3 Аl, CoAl и др., которые используются в качестве жаропрочных материалов. Алюминий применяется в алюминотермии для получения ряда металлов и для сварки термитным методом. Алюминотермия основана на высоком сродстве алюминия к кислороду. Например, в реакции, протекающей по уравнению
8Аl + 3Fe 3 O 4 = 4Аl 2 O 3 + 9Fe
выделяется около 3500 кДж теплоты и развивается температура до 3000 °С.
Оксид алюминия известен в виде нескольких модификаций. Наиболее устойчивой является α-Аl 2 O 3 . Эта модификация встречается в земной коре в виде минерала корунда, из которого готовят шлифовальные диски и наждачные порошки. Применение корунда в качестве абразивного материала основано на его высокой твердости, уступающей лишь твердости алмаза, карборунда SiC и боразона BN. Сплавлением Аl 2 O 3 с Сг 2 O 3 получают искусственные рубины. Из них изготовляют опорные камни в точных механизмах. В последнее время искусственные рубины применяют в квантовых генераторах (лазерах). Изделия из Аl 2 O 3 используют как огнеупоры и диэлектрики.
Гидроксид алюминия Аl(ОН) 3 - полимерное соединение. Он имеет слоистую кристаллическую решетку. Каждый слой состоит из октаэдров Аl(ОН) 6 (рис. 1); между слоями действует водородная связь. Получаемый по обменной реакции гидроксид алюминия - студенистый белый осадок, хорошо растворимый в кислотах и щелочах. При стоянии осадок «стареет» и теряет свою химическую активность. При прокаливании гидроксид теряет воду и переходит в оксид Аl 2 O 3 . Одна из форм дегидратированного гидроксида - алюмогель используется в технике в качестве адсорбента.
Чрезвычайно большой интерес представляют соединения алюминия - цеолиты, относящиеся к алюмосиликатам. Их состав может быть выражен общей формулой Ме х Э у O 2y ·nН 2 О, где Me-Са или Na (реже Ва, Sr, К); Э - Si и Аl в переменном соотношении. В кристаллах цеолитов имеются каналы, в которые могут внедряться молекулы Н 2 О. Содержание воды в цеолитах колеблется в широких пределах в зависимости от давления водяного пара. Цеолиты способны обменивать со- держащуюся в них воду на другие жидкости (спирт и т. п.). При осторожном нагревании вода из цеолитов постепенно удаляется. Но даже полное обезвоживание не приводит к разрушению кристаллов цеолитов. Катионы Са 2+ или Na + в цеолитах образуют диффузионный слой; они не закреплены в кристаллической решетке, а вместе с водой располагаются в пустотах кристалла. Это объясняет наличие у цеолитов важных для технических целей катионообменных свойств. Возможность замены одних катионов другими позволяет применять цеолиты в качестве ионообменников.
Рис. 1. Структура слоя, образованного октаэдрическимим структурными единицами АВ 6 , соединением АВ 3
Ряд искусственных цеолитов используется в качестве так называемых молекулярных сит. Кристаллы последних характеризуются наличием узких каналов диаметром от 3·10 -10 до 13·10 -10 м. Молекулярные сита поглощают вещества, молекулы которых могут войти в эти отверстия.
Например, молекулярное сито с диаметром отверстия 3,5·10 -10 м может поглощать молекулы Н 2 , O 2 , N 2 , но не поглощает более крупные молекулы СН 4 или Аr. С помощью молекулярных сит можно разделять углеводороды, производить осушку газов и т. п.
Галлий, индий и таллий в виде простых веществ - легкоплавкие серебристо-белые металлы. Физические и химические свойства Ga, In и Тl заметно отличаются от свойств Аl, несмотря на сходство электронной структуры внешнего энергетического уровня атомов рассматриваемых элементов.
Здесь, видимо, сказывается разница в электронной структуре предвнешнего энергетического уровня атомов Аl: (n-1)s 2 (n-1)p 6 с одной стороны и атомов Ga, In и Тl - с другой: (n-1)s 2 (n-1)р 6 (n-1)d 10 .
Степень окисления галлия и индия в устойчивых соединениях равна +3. Для таллия более характерна степень окисления + 1. Cоединения таллия, в которых степень окисления металла равна +3, являются сильными окислителями.
Галлий имеет широкий температурный интервал существования жидкого состояния. Низкая температура плавления (около 30 °С).
Индий равномерно отражает световые волны всех длин и поэтому используется в точном приборостроении для изготовления зеркал. Кроме того, In входит в состав некоторых легкоплавких сплавов.
Таллий также вводится в некоторые сплавы, главным образом это сплавы с оловом и свинцом (кислотоупорные, подшипниковые).
Оксиды Ga 2 O 3 , In 2 O 3 и Тl 2 O 3 в воде практически нерастворимы. Заметное усиление основных свойств в ряду Ga 2 O 3 - In 2 O 3 - Тl 2 O 3 проявляется в возрастающей растворимости оксидов в кислотах.
Гидроксиды Ga(OH) 3 , In(OH) 3 , Тl(ОН) 3 в воде так же нерастворимы, как и оксиды. Белый осадок Ga(OH) 3 растворим в равной мере и в кислотах, и в щелочах, а красно-коричневый Тl(ОН) 3 - только в кислотах.
Галлий и индий образуют с р-элементами V группы периодической системы бинарные соединения типа A III B V (например, GaP, GaAs, InSb и др.). В преобладающем большинстве соединений типа A III B V электронные орбитали sр 3 -гибридизованны; кристаллические решетки этих соединений имеют структуру, характеризующуюся тетраэдрическим расположением химических связей. Многие из этих алмазоподобных соединений - полупроводники. Их используют как материал для выпрямителей переменного тока, датчиков, термоэлектрических генераторов и др.
4. К d-элементам относят те элементы, атомы которых содержат валентные электроны на (n – 1)d ns-уровнях и составляют побочные (IIIВ–VIIВ, IВ, IIВ) подгруппы, занимая промежуточное положение между типичными s-металлами (IА, IIА) и p-элементами. Из 109 элементов периодической системы 37 относятся к d-элементам; из них последние 7 радиоактивны и входят в незавершенный седьмой период. Электронное строение атомов d-элементов определяет их химические свойства. 3d-Элементы по химическим свойствам существенно отличаются от 4d- и 5d-элементов. При этом элементы IVВ–VIIВ подгрупп очень схожи по многим химическим свойствам. Это сходство обусловлено лантаноидным сжатием, которое из-за монотонного уменьшения радиусов при заполнении 4f-орбиталей приводит к практическому совпадению радиусов циркония и гафния, ниобия и тантала, молибдена и вольфрама, технеция и рения. Элементы этих пар очень близки по физическим и особенно по химическим свойствам; первые шесть элементов встречаются в одних рудных месторождениях, трудно разделяются; их иногда называют элементами-близнецами.
Атомы d-элементов характеризуются общей электронной формулой (n – 1)d 1–10 ns 0–2 . Некоторые из тяжелых d-элементов не являются полными электронными аналогами. В табл. 8.10 приведены электронные формулы всех d-элементов и возможные степени окисления, проявляемые ими. Увеличение числа электронов иногда сопровождается немонотонностью заселения d-орбиталей. Это обусловлено сближением энергий (n – 1)d- и ns-орбиталей и усилением межэлектронного взаимодействия к концу периода.
У d-элементов лишь небольшая часть валентных электронов делокализована по всему кристаллу (тогда как у щелочных и щелочноземельных металлов валентные электроны полностью отданы в коллективное пользование). Остальные d-электроны участвуют в образовании направленных ковалентных связей между соседними атомами. Таким образом, эти элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все они твердые (кроме Hg) и тугоплавкие (за исключением Zn, Cd) металлы
Вследствие незаполненности d-оболочек и наличия близких по энергии незаполненных ns- и np-уровней, d-элементы склонны к комплексообразованию; их комплексные соединения, как правило, окрашены и парамагнитны.
d-Элементы чаще, чем элементы главных подгрупп, образуют соединения переменного состава (оксиды, гидриды, карбиды, силициды, нитриды, бориды). Кроме того, они образуют сплавы между собой и с другими металлами, а также интерметаллические соединения.
Для d-элементов характерен большой набор валентных состояний (табл. 8.10) и, как следствие этого, изменение кислотно-основных и окислительно-восстановительных свойств в широких пределах.
Сходство d-элементов с элементами главных подгрупп Э(0) в полной мере проявляется у элементов третьей группы ns 2 np 1 и (n – 1)d 1 ns 2 . С возрастанием номера группы оно уменьшается; элементы VIIIА подгруппы – газы, VIIIВ – металлы. В первой группе снова появляется отдаленное сходство (все элементы – металлы), а элементы IВ подгруппы – хорошие проводники; это сходство усиливается во второй группе, так как d-элементы Zn, Cd и Hg не участвуют в образовании химической связи.
d-элементы IIIВ–VIIВ подгрупп в высших степенях окисления по свойствам подобны соответствующим p-элементам. Так, в высших степенях окисления Mn (VII) и Cl (VII) являются электронными аналогами. Подобие электронных конфигураций (s 2 p 6) приводит к подобию свойств соединений семивалентных марганца и хлора. Mn 2 O 7 и Cl 2 O 7 в обычных условиях малоустойчивые жидкости, являющиеся ангидридами сильных кислот с общей формулой НЭО 4 . В низших степенях окисления марганец и хлор имеют различное электронное строение, что обусловливает резкое отличие свойств их соединений. Например, низший оксид хлора Cl 2 O (s 2 p 4) – газообразное вещество, являющееся ангидридом хлорноватистой кислоты (HClO), тогда как низший оксид марганца MnO (d 5) представляет собой твердое кристаллическое вещество основного характера.
Как известно, восстановительная способность металла определяется не только его энергией ионизации (М – ne – → М n+ ; +∆H иониз), но и энтальпией гидратации образовавшегося катиона (М n+ + mH 2 O → М n+ ·mH 2 O; –∆H гидр). Энергии ионизации d-элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d-элементов отрицательны.
В периоде с ростом Z восстановительные свойства металлов уменьшаются, достигая минимума у элементов IВ группы. Тяжелые металлы VIIIВ и IВ групп за свою инертность названы благородными.
Окислительно-восстановительные тенденции соединений d-элементов определяются изменением устойчивости высших и низших степеней окисления в зависимости от положения их в периодической системе. Соединения с максимальной степенью окисления элемента проявляют исключительно окислительные свойства, а с низшей – восстановительные. Mn(OH) 2 легко окисляется на воздухе Mn(OH) 2 + 1/2O 2 = MnO 2 + H 2 O. Соединения Mn(IV) легко восстанавливаются до Mn (II): MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O, но сильными окислителями окисляется до Mn (VII). Перманганат-ион MnO 4 – может быть только окислителем.
Поскольку для d-элементов в пределах подгруппы устойчивость высших степеней окисления сверху вниз растет, то окислительные свойства соединений высшей степени окисления резко падают. Так, соединения хрома (VI) (CrO 3 , K 2 CrO 4 , K 2 Cr 2 O 7) и марганца(VII) (Mn 2 O 7 , KMnO 4) – сильные окислители, а WO 3 , Re 2 O 7 и соли соответствующих им кислот (H 2 WO 4 , HReO 4) восстанавливаются с трудом.
На кислотно-основные свойства гидроксидов d-элементов влияют те же факторы (величина ионного радиуса и заряд иона), что и на гидроксиды p-элементов.
Гидроксиды низших степеней окисления d-элементов обычно проявляют основные свойства, а отвечающие высшим степеням окисления – кислотные. В промежуточных степенях окисления гидроксиды амфотерны. Особенно отчетливо изменение кислотно-основных свойств гидроксидов при изменении степени окисления проявляется в соединенинях марганца. В ряду Mn(OH) 2 – Mn(OH) 3 – Mn(OH) 4 – H 2 MnO 4 – HMnO 4 свойства гидроксидов меняются от слабого основания Mn(OH) 2 через амфотерные Mn(OH) 3 и Mn(OH) 4 к сильным кислотам H 2 MnO 4 и HMnO 4 .
В пределах одной подгруппы гидроксиды d-элементов одинаковой степени окисления характеризуются увеличением основных свойств при движении сверху вниз. Например, в IIIВ группе Sc(OH) 3 – слабое, а La(OH) 3 – сильное основание. Элементы IVВ группы Ti, Zn, Hf образуют амфотерные гидроксиды Э(OH) 4 , но кислотные свойства их ослабевают при переходе от Ti к Hf.
Отличительной особенностью переходных элементов является образование фаз переменного состава. Это, во-первых, твердые растворы внедрения и замещения и, во-вторых, соединения переменного состава. Твердые растворы образуются элементами с близкими электроотрицательностями, атомными радиусами и одинаковыми кристаллическими решетками. Чем больше отличаются элементы по своей природе, тем менее они растворяются друг в друге и тем более склонны к образованию химических соединений. Такие соединения могут иметь как постоянный, так и переменный состав. В отличие от твердых растворов, в которых сохраняется решетка одного из компонентов, для соединений характерно образование новой решетки и новых химических связей. Другими словами, к химическим соединениям относят лишь те фазы переменного состава, которые резко отличаются по строению и свойствам от исходных.
Для соединений переменного состава характерны следующие особенности:
а) Состав этих соединений зависит от способа получения. Так, в зависимости от условий синтеза оксиды титана имеют состав TiO 1,2–1,5 и TiO 1,9–2,0 ; карбиды титана и ванадия – TiC 0,6–1,0 и VС 0,58–1,09 , нитрид титана TiN 0,45–1,00 .
б) Соединения сохраняют свою кристаллическую решетку при значительных колебаниях количественного состава, то есть имеют широкую область гомогенности. Так, TiC 0,6–1,0 , как следует из формулы, сохраняет решетку карбида титана при недостатке в ней до 40 % атомов углерода.
в) Природа связи в таких соединениях определяется степенью заполнения d-орбиталей металла. Электроны внедренного неметалла заселяют вакантные d-орбитали, что приводит к усилению ковалентности связей. Именно поэтому доля металлической связи в соединениях начальных элементов d-рядов (IV–V групп) понижена.
Наличие ковалентной связи в них подтверждается большими положительными энтальпиями образования соединений, более высокими твердостью и температурой плавления, меньшей электропроводностью по сравнению с образующими их металлами.
Похожая информация.
Известно 30 р - элементов в периодической системе, это элементы, расположенные в III-A - VIII-A группах. У р - элементов заполняется электронами р- подуровень внешнего электронного уровня.
III-A группа – B, Al, Ga, In, Tl – характеризуются наличием 3-х электронов в наружном электронном слое атома, причем у бора на предвнешнем слое атома – 2 электрона, у алюминия – 8 электронов, Ga, In, Tl – 18 электронов. III группа самая элементоемкая – содержит 37 элементов, включая лантаноиды и актиноиды. Все элементы металлы, за исключением бора.
При переходе от Al к Ga радиус атома уменьшается. Это связано с тем, что у Ga заполнение р - подуровня начинается после того, как заполняется 3d 10 электронная оболочка. Под действием 3d 10 - электронов электронная оболочка всего атома сжимается и размер атома уменьшается (эффект d - сжатия).
Монотонного (последовательного) изменения металлических свойств не наблюдается. Металлические свойства резко усиливаются при переходе от бора к алюминию, несколько ослабевают у галлия, и вновь постепенно растут при переходе к таллию. Обусловлено это тем, что атома Ga происходит сжатие электронной оболочки за счет d –электронов (эффект d – сжатия) , In, Tl (в отличие от B и Al) содержат по 18 электронов на предпоследнем слое. Поэтому нарушается линейное изменение свойств (rат, Тпл и т.п.) от Al к Ga.
Температура кипения закономерно уменьшается от B к Tl. Температура плавления незакономерно из-за особенностей строения кристаллической решетки.
Самый легкоплавкий металл – Ga (Тпл = 29,8˚С).
В невозбужденном состоянии конфигурация внешнего уровня ns 2 np 1 , в возбужденном состоянии - ns 1 np 2 .
В невозбужденном состоянии имеется 1 неспаренный электрон, однако соединения большинства этих элементов, в которых их степень окисления +1, очень неустойчивы и наиболее характерна для них степень окисления +3 в возбужденном состоянии, т.к. на перевод электрона из s-состояния в р - надо немного энергии.
B – неметал, Al – еще не типичный металл, Ga, In, Tl –типичные металлы. Соединения: ЭН 3 , Э 2 О 3 , Э(ОН) 3 .
B 2s 2 2p 1 В 2 Н 6
A
растет
восстановительная способность,
устойчивость
Ga [ Ar ]4 s 2 4 p 1 (GaH 3 ) n
In [ Kr ]5 s 2 5 p 1 (InH 3 ) n
Tl [ Xe ]6 s 2 6 p 1 TlH 3
Э 2 О 3
B 2 O 3 кислотный оксид
Al 2 O 3 амфотерный оксид
Ga 2 O 3
In 2 O 3 амфотерный оксид (с преобладанием основных свойств)
Tl 2 O (Tl 2 O 3) основной оксид
Э(ОН) 3
H
нарастают основные свойства
Al (OH ) 3 амфотерный гидроксид
Ga (OH ) 3 амфотерный гидроксид
In (OH ) 3 амфотерный гидроксид TlOH основной гидроксид
Образуют соединения с галогенами ЭГ 3 , серой Э 2 S 3 , азотом ЭN.
Много общего имеет химия кислородных соединений бора и кремния: кислотная природа оксидов и гидроксидов, способность образовывать многочисленные полимерные структуры, стеклообразование оксидов.
Элементы 13-й группы: бор 5 В, алюминий 13 Аl, галлий 31 Ga, индий 49 In и таллий 81 Тl - имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация основного состояния ns 2 np 1 характеризуется наличием единственного неспаренного электрона. В возбужденном состоянии они содержат три неспаренных электрона, которые, находясь в sp 2 -гибридизации, участвуют в образовании трех ковалентных связей. При этом у атомов элементов 13-й группы остается одна незанятая орбиталь, и число валентных электронов оказывается меньше числа доступных по энергии орбиталей. Поэтому многие ковалентные соединения элементов 13-й группы являются кислотами Льюиса - акцепторами электронной пары, приобретая которую, они не только повышают координационное число до четырех, но и изменяют геометрию своего окружения - она из плоской становится тетраэдрической (состояние sp 3 -гибридизации).
Бор сильно отличается по свойствам от других элементов 13-й группы. Он - единственный неметалл, химически инертен и образует ковалентные связи В-F, В-N, В-С и т.д., кратность которых часто повышена за счет рπ-рπ - связывания. Химия бора более близка химии кремния, в этом проявляется диагональное сходство.
У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома, поэтому координационное число увеличивается до шести (и более).
Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-ряду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия.
Энергия ионизации атомов элементов 3-й (13-й) группы главной подгруппы более высокая, чем элементов 3-й(13-й) группы побочной подгруппы, что связано с усилением взаимодействия ns- и nр-электронов с ядром за счет заполнения d- и f-оболочек электронами, слабо экранирующими заряд ядра.
Для соединений элементов 13-й группы наиболее характерна степень окисления +3. В ряду В-AI-Ga-In-Тl устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М-Г в галогенидах при переходе от легких к более тяжелым элементам уменьшается, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga 2 0, Ga 2 S, InCl, In и др.) в водных растворах диспропорционируют: 3lnСl = InС1 3 + 2 In. Для таллия состояние +1, напротив, является наиболее устойчивым вследствие инертности электронной пары 6s 2 .
Бор сравнительно мало распространен в земной коре (9 10 -4 мас. %), где он встречается в виде кислородных соединений: боратов и боросиликатов. От названия одного из них - буры Na 2 B 4 0 7 . Н 2 О (лат. borax) - и происходит название элемента.
Алюминий по содержанию в земной коре (8,3 мас.%) занимает третье место, уступая только кислороду (45,5 мас.%) и кремнию (25,7 мас.%). Алюминий - наиболее распространенный металл, его важнейшими рудами и минералами являются бокситы А1 2 О 3 . 2Н 2 О корунд А1 2 О 3 и нефелин Na 3 K 4 , также он входит в состав полевых шпатов, слюд, глин и др.
Галлий (4,6 10 -4 мас.%), индий (2 10 -6 мас.%) и таллий (8 10 -7 мас.%) относятся к редким элементам. Вследствие близости ионных радиусов галлий сопутствует алюминию в бокситах, а таллий - калию в алюмосиликатах.
Бор - тугоплавкий диамагнитный порошок черного (кристаллический) или бурого (аморфный) цвета, плохой проводник тепла и электричества. Алюминий, галлий, индий и таллий - серебристые металлы с характерным блеском и высокой электро- и теплопроводностью. При хранении на воздухе таллий быстро темнеет, так как покрывается пленкой оксида.
Кристаллический бор химически инертен. С кислородом он реагирует лишь около 750 °С с образованием оксида В 2 0 3 . Кипящие концентрированные растворы HF, НС1 и NaOH на него не действуют. Аморфный бор химически более активен и медленно окисляется горячими концентрированными HN0 3 , H 2 S0 4 , хромовой смесью, концентрированными растворами Н 2 0 2 и (NH 4) 2 S 2 О8:
В + 3HN0 3 = Н3ВО3 + 3N0 2
Реагирует с расплавленными Na 2 0 2 и KNО 3 /Na 2 CО 3 , а в присутствии окислителя - и с щелочами:
4В + 4NaOH + 30 2 = 4NaB0 2 + 2Н 2 0
Смеси аморфного бора с КМn0 4 и РЬ0 2 при растирании загораются, а смеси с НIO 3 взрываются. При высоких температурах бор реагирует с большинством простых веществ, за исключением Н 2 , Ge, Те, инертных газов и ртути.
Алюминий, галлий и индий взаимодействуют с неметаллами (0 2 , N 2 , S, галогенами Х 2 и др.), образуя соответствующие оксиды М 2 0 3 , нитриды MN, сульфиды M 2 S 3 , галогениды МХ 3 . В избытке металла могут быть получены низшие сульфиды (GaS, InS) и галогениды (InBr, In). Таллий в этих условиях образует соединения со степенью окисления +1.
Реакция окисления алюминия кислородом сопровождается выделением большого количества теплоты и используется для восстановления многих металлов из их оксидов, например:
2Аl + Fe 2 0 3 = Аl 2 0 3 + 2Fe
Со многими металлами алюминий и его аналоги образуют химические соединения - интерметаллиды, например CuA1 2 , Al 2 CuMg и др.
Металлы Аl, Ga, In, Тl располагаются левее водорода в ряду напряжений, и их окисление водой и кислотами-неокислителями термодинамически возможно:
2А1 + 6Н + + 12Н 2 0 = 2[Аl(Н 2 0) 6 ] 3+ + ЗН 2
Индий и таллий также растворяются в кислотах, но таллий (из-за понижения устойчивости соединений Тl(III) при взаимодействии с кислотами-неокис- лителями образует соли Т1(1). Реакция таллия с галогеноводородными кислотами НХ (X = Cl, Br, I) тормозится вследствие низкой растворимости галогенидов. Производные Tl(III) образуются при действии на Tl «царской водки» (три объема НСl(конц.) + один объем HNO3(конц.)) и других сильных окислителей.
Основные свойства соединений возрастают в ряду Аl - Ga- In-Тl, а кислотные свойства убывают. Алюминий и галлий подобно некоторым типичным неметаллам реагируют со щелочами, которые растворяют защитный оксидный слой:
2А1 + 2NaOH + 10Н 2 0 = 2Na + ЗН 2
Бор. Причина преобладания у бора неметаллических свойств. Получение бора, его физические и химические свойства. Соединения бора с металлами и неметаллами. Карбид бора; нитрид бора гексагональный и кубический (боразон). Галогениды бора. Неорганические полимеры на основе соединений бора. Тетрафтороборная кислота, ее соли. Боразол – аналог бензола.
Бор - элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 5. Бор - тугоплавкий диамагнитный порошок черного (кристаллический) или бурого (аморфный) цвета, плохой проводник тепла и электричества. Известно более 10 аллотропных модификаций бора. Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3. Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). В природе бор находится в виде двух изотопов 10 В (20 %) и 11 В (80 %).
10 В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10 В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности.
Химические свойства.
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором - фосфид BP, с углеродом - карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты.
Оксид бора - типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты - бораты (содержащие анион BO3 3−), а тетрабораты, например:
Получение.
Аморфный бор, сильно загрязненный боридами металлов, получают металлотермическим восстановлением оксида или обезвоженной буры:
В 2 0 3 + 3Mg = 2В + 3MgO
Более чистый продукт образуется при восстановлении летучих соединений бора водородом на нагретой до 1150 °С танталовой проволоке:
2BBr 3 + ЗН 2 = 2В + 6НВr или при их термическом разложении:
2BI 3 +2H 2 = 2В + 3I 2
Соединения бора.
Сульфид бора (B2S3) образуется в виде бесцветной стекловидной массы при накаливании бора в парах серы. Водой он полностью разлагается на борную кислоту и H2 S.
С азотом бор соединяется только выше 1200 °С. Нитрид бора (BN) представляет собой белый порошок, плавящийся лишь около 3000 °С (под давлением). По кристаллической структуре BN сходен с графитом.
Карбид бора (В4С) образуется в виде черных блестящих кристаллов принакаливании смеси бора (или В2 О3) с углем в электрической печи. Он отличается тугоплавкостью (т. пл. 2550 °С) и чрезвычайной твердостью (близкой к твердости алмаза). И нитрид и карбид бора характеризуются большой устойчивостью по отношению к различным химическим воздействиям.
БОРА НИТРИД , BN, кристаллический, имеет три модификации: гексагональную a-BN , кубическую b-BN (боразон) и ромбоэдрическую g-BN.
Гексагональный нитрид бора альфа-BN.
Кристаллическая структура a-BN состоит из графитоподобных сеток, расположенных, в отличие от структуры графита точно одна под другой с чередованием атомов бора и азота. Белый, похожий на тальк порошок a-BN, получают из элементов при температурах выше 2000 °С. Нитрид бора может быть получен также прокаливанием бора (или B2O3) в атмосфере аммиака или при нагревании смеси B2O3 с восстановителями (углем, магнием) в атмосфере аммиака. По смазочным свойствам a-BN превосходит графит. В спрессованном состоянии нитрид бора обладает полупроводниковыми свойствами, а при наличии небольшого количества примесей обладает люминесцентными свойствами. Нитрид бора при комнатной температуре химически инертен, не реагирует с кислородом или хлором, кислотами или щелочами. Кислород и хлор начинают действовать на него при температурах выше 700 °С. Реагирует с фтором (образуя BF3 и N2) и с HF (образуя NH4BF4); горячие растворы щелочей разлагают его с выделением NH3.
При температуре выше 1000°С начинает разлагаться на элементы.
Алмазоподобная форма бета-BN (боразон).
При давлении выше 62 тыс атм и температурах выше 1350 °С происходит полиморфное превращение графитоподобной гексагональной b-BN модификации в кубическую алмазоподобную b-BN структуру. Хорошими катализаторами такого превращения являются щелочные и щелочноземельные металлы. Как и в случае перехода графит-алмаз, полиморфное превращение сопровождается резким изменением свойств нитрида бора.
Кристаллы боразона, полученные при аллотропическом переходе BN (гекс.) - BN (куб.) при высоких давлениях, имеют вид полиэдров, обычно тетраэдров или октаэдров. Они прозрачны, а их цвет зависит от наличия и типа примесей. Размер образующихся кристаллов боразона зависит от давления и температуры процесса. Избыток бора в реакционной смеси придавал полученным кристаллам боразона коричневый или черный цвет, бериллий - синий, сера - желтый.
Твердость его при оценке по шкале Мооса соизмерима с твердостью алмаза (около 10 баллов), однако боразон сильно превосходит алмаз по термостойкости (до 2000 °С) и ударной прочности.
Химическая стойкость боразона значительно выше, чем обычной формы нитрида бора.
Ромбоэдрический гамма-BN.
Ромбоэдрическая модификация g-BN обнаружена наряду с гексагональной при получении нитрида бора взаимодействием бората натрия с цианистым калием.
Нитрид бора и материалы на его основе занимают заметное место в ряду важнейших инструментальных материалов и являются основой многих современных технологий. Он нашел широкое применение в реакциях промышленного органического синтеза и при крекинге нефти, в изделиях высокотемпературной техники, в производстве полупроводников, получении высокочистых металлов, газовых диэлектриков, как средство для тушения возгораний. Из нитрида бора изготовляют высокоогнеупорные материалы, проявляющие как полупроводниковые, так и диэлектрические свойства.
Основанием для широкого применения боразона в инструментах, послужила наибольшая твёрдость, приближающаяся к твёрдости алмаза. Из боразона изготавливают изделия, применяемые в высокотемпературной технике (тигли, изоляторы, тигли для получения полупроводниковых кристаллов, детали электровакуумных приборов); он применяется для производства полупроводниковых приборов и интегральных схем (твердотельные планарные источники примеси бора, диэлектрические прокладки конденсаторов), деталей электровакуумных приборов (окон выводов энергии, стержней теплоотводов).
Галогениды бора по строению и свойствам существенно отличаются от галогенидов других элементов 13-й группы.
Известны четыре высших галогенида бора. Все они состоят из молекул ВХ 3 , имеющих форму правильного треугольника, в центре которого расположен атом бора в состоянии sp2-гибридизации. Связи В-X оказываются короче рассчитанных для одинарной сигма-связи.
С увеличением размера атомов галогенов прочность связей В-X и устойчивость молекул ВХ 3 падают.

В ряду галогенидов бора от фторида к иодиду межмолекулярные взаимодействия усиливаются, благодаря чему растут температуры плавления и кипения (см. табл. 4.4). При обычных условиях BF 3 и ВС1 3 - газы, ВВг 3 - жидкость, а ВI 3 - летучее твердое вещество.
Трифторид BF 3 получают фторированием боратов:
6CaF 2 + Na 2 B 4 0 7 + 8H 2 S0 4 (конц.)= 4BF 3 t + 2NaHS0 4 + 6CaS0 4 + 7H 2 0
борной кислоты или ее ангидрида:
В 2 0 3 + 6NaBF 4 + 3H 2 S0 4 (конц.)= 8BF 3 + 3Na 2 S0 4 + 3H 2 0
a BCl 3 и BBr 3 - прямым синтезом, галогенированием смеси оксида бора с углеродной сажей:
700 °С
В 2 0 3 + ЗС + ЗС1 2 (Br 2)= ЗСО + 2ВС1 3 (ВВг 3)
или пропусканием трифторида бора над галогенидом алюминия:
А1Вг 3 + BF 3 = BBr 3 + A1F 3
Трииодид ВI 3 образуется при взаимодействии борогидрида лития LiBH 4 с иодом при -78 °С:
LiBH 4 + 4I 2 = BI 3 + 4HI + LiI
Тригалогениды бора - сильные кислоты Льюиса (акцепторы электронов) и легко взаимодействуют с молекулами - донорами электронов, т. е. основаниями Льюиса:
BF 3 + NH 3 = F 3 B:NH 3
BF 3 + 0(C 2 H 5) 2 =F 3 B:0(C 2 H 5) 2
при этом sp2-гибридизация орбиталей переходит в sp3-гибридизацию, плоская молекула приобретает пирамидальную конфигурацию, и координационное число атома бора повышается до четырех.
Кислотность соединений ВХ 3 проявляется и в их склонности к гидролизу. Хлорид, бромид и иодид дымят на влажном воздухе, а водой мгновенно разлагаются:
ВХ 3 + 3H 2 O = Н 3 В0 3 + ЗНХ (X = Сl, Вг, I)
Фторид медленно взаимодействует с водой:
4BF 3 + ЗН 2 0 = Н 3 В0 3 + 3HBF 4
При пропускании BF 3 через ледяную воду может быть выделен гидрат BF 3 . 2H 2 0, имеющий ионное строение: H 3 0 + - .
Тетрафтороборная кислота HBF 4 , образующаяся при гидролизе BF 3 , гораздо сильнее плавиковой (рKa равна-0,2) и подобно ей ядовита. Она существует только в растворах, которые готовят, растворяя борную кислоту в 40 %-м растворе HF:
Н 3 В0 3 + 4HF = HBF 4 + ЗН 2 0
Нейтрализацией растворов тетрафтороборной кислоты получают ее соли - тетрафторобораты. Они более устойчивы, чем кислота, и плавятся без разложения. Na удобно получать фторированием буры:
14HF + Na 2 B 4 0 7 + 2NaF = 4NaBF 4 + 7Н 2 О
Свежеприготовленные растворы тетрафтороборатов щелочных металлов имеют нейтральную среду, однако при хранении они постепенно подщелачиваются за счет слабого гидролиза.
Кислоту HBF 4 и ее соли используют в качестве компонентов антикоррозионных покрытий, для нанесения защитных металлических пленок, в производстве ионообменных и ионоселективных мембран, в металлургии для получения сплавов Аl - В и нержавеющей стали. Некоторые тетрафторобораты активны в качестве катализаторов органических реакций.
Боразол.
Боразол (боразин, триборинтриимид) - химическое вещество с химической формулой B3H6N3, бесцветная жидкость. Молекула представляет собой шестичленное плоское кольцо, в котором чередуются атомы бора и азота, каждый из них соединён с одним атомом водорода.
Являясь неорганическим аналогом бензола, боразол напоминает бензол по своим физическим свойствам (агрегатное состояние, интервал кипения, плотность и т. п.); в то же время, химические свойства боразола и бензола резко различаются.
Реакционная способность боразола выше, чем у бензола, вследствие полярности связей (три атома азота поставляют свои неподеленные электронные пары на свободные орбитали атомов бора). Так, он окисляется на воздухе, растворим в воде, с которой постепенно реагирует с образованием В(ОН)3, NH3 и Н2, и менее термически устойчив, чем бензол.
Атомы Н, связанные с атомами B, способны замещаться без разрушения цикла. Так, при действии BCl3 или BBr3 на боразол при нагревании, образуются твердые устойчивые соединения - тригалогенборазолы B3N3H3Hal3.
Атомы H при N неспособны вступать в реакции замещения.
Получение.
Боразол можно получить нагреванием тетрагидробората лития и хлорида аммония:
По реакции диборана с аммиаком, которая также проводится при нагревании:
Реакцией трихлорида бора с хлоридом аммония. Реакция идет в две стадии:
Боразол используют для получения BN, его орг. производные - для синтеза термостойких полимеров. Напр., при пиролизе N-трифенилборазола образуется полимер состава [-(C6H5)3N3B3H-] 23 , в котором боразольные циклы связаны через атомы бора.
28. Получение, строение, свойства диборана (трехцентровая двухэлектронная связь). Гомологические ряды гидридов бора: В n H n+4 и В n H n+6 . Бориды металлов.
Гидриды бора (или бораны) - один из самых необычных классов неорганических соединений с особыми структурными принципами организации химических связей, сложной стехиометрией, большим разнообразием химических реакций.
Бораны - ядовитые, неустойчивые молекулярные соединения с крайне неприятным запахом, хорошо растворимые в органических растворителях. С увеличением молекулярной массы растут их температуры плавления и кипения: при комнатной температуре диборан B 2 H 6 - газ, пентаборан В 5 Н 9 - жидкость, а декаборан В 10 Н 14 - твердое вещество. Бораны химически активны, легко окисляются на воздухе и разлагаются водой.
Моноборан ВН 3 неустойчив. Из-за наличия трех связей В-Н и четырех орбиталей атом бора в ВН 3 координационно ненасыщен, и молекула ВН 3 легко присоединяет молекулы или ионы с неподеленными электронными парами, например молекулу аммиака, образуя прочные молекулярные соединения:
Н 3 В + NH 3 = H 3 B:NH 3
Моноборан ВН 3 выделен конденсацией паров таких соединений при температуре жидкого азота.
Особое место среди гидридов бора занимает диборан В 2 Н 6 , являющийся исходным веществом для получения всех остальных боранов. Его синтезируют восстановлением соединений бора гидридом натрия при нагревании (175 °С):
2BF 3 (г.) + 6NaH (тв.) = В 2 Н 6 (г.) + 6NaF (тв.) или алюмогидридом лития в эфирном растворе:
4ВС1 3 + 3LiAlH 4 = 2B 2 H 6 + 3LiCl + ЗА1С1 3
Молекула диборана построена из двух фрагментов ВН 3 (рис. 4.3, а) таким образом, что два атома В и два соединяющих их мостиковых атома Н расположены в одной плоскости (плоскость рисунка), а четыре концевых атома Н, (по два для каждого атома В) - в перпендикулярной плоскости. Химическая связь между атомами бора отсутствует. Каждый атом В имеет по три валентных электрона, два из которых участвуют в образовании обычных двухцентровых двухэлектронных связей с концевыми атомами Н. Таким образом, каждая группа ВН 2 на связывание в фрагменте ВН 3 может предоставить только по одному электрону. Очевидно, что для образования аналогичных связей с двумя мостиковыми атомами Н валентных электронов не хватает - бораны являются электронодефицитными соединениями.
Для описания таких связей предложена схема трехцентровой двухэлектронной связи В- Н- В (рис. 4.3, б). В методе молекулярных орбиталей смешивание двух атомных орбиталей бора ѱ(B 1) и ѱ(B 2) с орбиталью водорода ѱ(Н) приводит к образованию трех МО: связывающей ѱ 1 , несвязывающей ѱ 2 и разрыхляющей ѱ 3 . Пара электронов (один от атома В и второй от атома Н) занимает связывающую МО, создавая устойчивую мостиковую трехцентровую двухэлектронную связь В-Н-В в боранах (рис. 4.3, в).

Высшие бораны.
Высшие бораны - бесцветные, неустойчивые молекулярные соединения, температуры кипения их близки к температурам кипения углеводородов с аналогичной молекулярной массой. По строению и составу их разделяют на несколько типов. Клозо-бораны [В n Н n ] 2- , и = 6 - 12 (от греч.- клетка), представляют собой анионные кластеры); нейтральные молекулы В n Н я+2 пока не получены. Нидо-бораны (от лат. nidus - гнездо) содержат незакрытые с одной стороны, нейтральные, например В 5 Н 9 , В 10 Н 14 , или анионные полиэдры общего состава В n Н n+4 , к их числу относится и диборан В 2 Н 6 . Арахно-бораны (от греч. - паутина) представляют собой полиэдры с двумя свободными вершинами. Они состоят из открытых кластеров, соответствующих формуле В n Н n+6 , например В 4 Н 10 , В 5 Н 11 , В 8 Н 14 . Гифо-бораны (от греч. - сеть) содержат наиболее открытые кластеры, в которых число свободных вершин равно трем: В n Н n+8 , например B 8 H 16 , В 10 Н 18 . Наиболее сложным строением обладают конжункто-бораны (от лат. conjuncto - соединять вместе), состоящие из соединенных друг с другом фрагментов перечисленных выше типов.
Бораны - соединения с высокой реакционной способностью, их активность ослабевает с ростом молекулярной массы и зависит от строения молекул. Высокая химическая устойчивость клозо-боранов объясняется сильной делокализацией электронов.
Тетрагидробораты - типичные восстановители. Среди них наиболее устойчивы соли щелочных металлов МВН 4 . Их получают взаимодействием твердого гидрида натрия с галогенидами бора или эфирами борной кислоты:
4NaH + BCl3 = NaBH 4 + 3NaCl
B(OCH 3) 3 + 4NaH = NaBH 4 + 3NaOCH 3
Тетрагидробораты* - бесцветные кристаллические вещества, растворимые в воде, жидком аммиаке, аминах, а борогидрид лития - в эфире. LiBH 4 термически распадается выше 380 °С, остальные выдерживают нагревание до 580 °С. NaBH 4 является мягким восстановителем. Это ионное соединение, плавящееся без разложения при 505 °С. Его применяют в целлюлозно-бумажном производстве для отбеливания бумажной массы благодаря тому, что при взаимодействии с сернистым газом в щелочной среде образует сильный отбеливающий агент - дитионит натрия Na 2 S 2 0 4:
Na + 8NaOH + 8S0 2 = 4Na 2 S 2 0 4 + NaB0 2 + 6H 2 0
Щелочные тетрагидробораты используются для нанесения металлических покрытий и создания контактов в электронных приборах.
Концентрированная серная кислота разлагает борогидриды:
2Na + 2H 2 S0 4 = 2NaHS0 4 + B 2 H 6 + 2H 2
Реакция протекает настолько энергично, что реакционная смесь часто воспламеняется.
Хлорирование боранов приводит к разрыву связи В-В:
В 2 Н 6 + 6С1 2 = 2ВС1 3 + 6НС1
а взаимодействие с аммиаком - к образованию циклических тримеров: бора- зина (HNBH) 3 или боразола (BNH) 3 .
На воздухе диборан легко воспламеняется:
В 2 Н 6 + зо 2 = в 2 о 3 + зн 2 о
а при нагревании без доступа воздуха разлагается на смесь высших боранов. Разложение протекает через неустойчивые интермедиаты ВН 3 , В 3 Н 7 и др. (приведены в фигурных скобках):
В 2 Н 6 = 2{ВН 3 }
{ВН 3 } + В 2 Н 6 = {В 3 Н 7 } + Н 2
{ВН 3 } + В 3 Н 7 = В4Н10
В 4 Н 10 + {ВН 3 } = В 5 Н 11 + н 2
На последующих стадиях образуются бораны В 5 Н 9 , В 6 Н |0 , В 6 Н 12 и наиболее устойчивый продукт В 10 Н 14 наряду с полимерным (ВН) Х.
Строение и свойства боридов металлов.
При взаимодействии бора с металлами образуются разнообразные бориды, в которых бор проявляет формально отрицательные степени окисления.
В боридах с повышенным содержанием металла атомы бора изолированы и расположены преимущественно в центрах тригональных призм из атомов металлов.
В боридах Сг 5 В 3 и М 3 В 2 (М = V, Nb, Та) присутствуют изолированные пары В-В. Бориды MB (М = Ti, Hf, V, Cr, Mo, Mn, Fe, Ni) образованы изолированными цепями из атомов бора. В структурах боридов М 3 В 4 ((М = V, Nb, Cr, Мn) найдены двойные цепи из атомов бора.
Бориды МВ 2 (М = Mg, А1) и М 2 В 5 (М = Ni, Mo, W) образованы двумерными слоями, а бориды типа LaB 6 - трехмерными каркасами из атомов бора.
В структурах боридов с высоким содержанием бора (МВ 4 , МВ 12) сохраняются трехмерные фрагменты икосаэдров, в пустотах которых размещаются атомы металлов.
Несмотря на большие различия в размерах атомов, входящих в состав различных боридов, межатомные расстояния В-В почти постоянны и определяются прочными связями В-В.
Бориды - исключительно твердые, химически инертные, огнеупорные материалы с температурой плавления и электропроводностью, часто превышающими аналогичные свойства исходных металлов. Например, диборид циркония ZrB 2 плавился выше 3000 °С, тогда как температура плавления циркония равна 1670 °С. По электропроводности борид TiB 2 в пять раз превосходит титан. Твердость карбида бора В 4 С выше твердости карбида кремния и приближается к твердости алмаза.
Бориды металлов используют для создания высокотемпературных реакторов, защитных покрытий реактивных двигателей и лопаток газовых турбин. Эффективность захвата тепловых нейтронов изотопом 10 В более высокая, чем у любых других ядер. Благодаря этому бориды и карбиды бора служат материалом для регулирующих стержней в ядерных реакторах. В 2000 г. японскими исследователями открыты новые сверхпроводники на основе диборида магния MgB 2 с критической температурой t c = -233 °С. Карбид бора в виде волокон используется для упрочнения различных материалов. Такие волокна получают взаимодействием смеси ВС1 3 + Н 2 с углеродными волокнами при 1630°С:
4ВС1 3 + 6Н 2 + С = В 4 С + 12НС1
Бориды металлов синтезируют восстановлением смеси В 2 O 3 с оксидами металлов углеродом при 2000 °С:
V 2 O s + В 2 O 3 + 8С = 2VB + 8СО
взаимодействием простых веществ, а также восстановлением смесей летучих галогенидов металлов и бора водородом:
TiCl 4 +2ВС1 3 + 5Н 2 = TiB 2 + 10НС1
Некоторые бориды активных металлов (MgB 2 , А1В 2) разлагаются водой, образуя смесь различных боранов. Большинство боридов (А1В 12 , СаВ 6 , ZrB 2 и др.) водой не разлагаются.
29. Кислородные соединения бора. Оксид бора (III). Борные кислоты, их соли: мета-, тетра-, ортобораты. Получение, строение буры, ее гидролиз. Переработка буры в борную кислоту .
Для всех элементов 13-й группы характерно образование оксидов и их производных в высшей степени окисления +3. Для таллия устойчивы соединения со степенью окисления +1
Кислородные соединения бора
К важнейшим кислородным соединениям бора относятся оксид бора В 2 0 3 , борные кислоты и их соли - бораты.
Оксид бора В 2 0 3 .
Получают окислением бора кислородом:
4В + 3О 2 = 2В 2 О 3 или тщательным обезвоживанием расплавленной Н 3 ВО 3:
2Н 3 ВО 3 = В 2 О 3 + ЗН 2 О
Кристаллический В 2 O 3 (t ПЛ = 577 °С, t кип = 1860 °С) построен из плоских треугольников ВO 3 , соединенных общими вершинами в трехмерную структуру. Расплав В 2 О 3 склонен к переохлаждению. Образующаяся из него стекловидная масса состоит из частично упорядоченных треугольников ВО 3 , соединенных в циклы. В расплавленном В 2 O 3 легко растворяются оксиды многих металлов, что используют для получения окрашенных стекол (например, синих с СоО), а также при пайке для очистки поверхности металлов от их оксидов. Боратные стекла часто используют в качестве слоев и покрытий, защищающих поверхность изделий от окисления. При нагревании выше 1450 °С оксид бора испаряется в виде мономерных молекул. Летучесть В 2 0 3 значительно повышается в присутствии водяных паров из-за образования летучей метаборной кислоты:
В 2 O 3 (тв.) + Н 2 O(г.)= 2НВО 2 (г.)
При повышенных температурах В 2 О 3 восстанавливается до бора щелочными металлами, магнием, алюминием, а также углеродом.
Аморфный В 2 Оз растворяется в воде с заметным разогреванием (Н° = = -76,3 кДж/моль), превращаясь в смесь борных кислот.
Ортоборная (борная) кислота В(ОН) 3 (Н 3 ВO 3). Это конечный продукт гидролиза растворимых соединений бора, например буры Na 2 8Н 2 0:
Na 2 8Н 2 0 + H 2 S0 4 = 4В(ОН) 3 + Na 2 S0 4 + 5Н 2 0
Борная кислота представляет собой жирные на ощупь чешуйчатые кристаллы, в структуре которых (рис. 4.9, а) молекулы В(ОН) 3 связаны в плоские слои за счет водородных связей -ОН... О. Отдельные слои соединены друг с другом слабыми межмолекулярными связями и находятся на значительном расстоянии друг от друга.
Н 3 ВO 3 растворяется в воде (4,3 г в 100 г воды при 20 °С) и является слабой одноосновной кислотой. В отличие от обычных кислот ее кислотные свойства обусловлены не отщеплением иона водорода, а присоединением гидроксильной группы молекулы воды, выступающей в роли основания Льюиса:
В(ОН) 3 + Н-ОН = [В(ОН) 4 - + Н + , рК а 9,25 (25 °С)
Кислотные свойства Н 3 В0 3 проявляются в том, что в присутствии концентрированной H 2 S0 4 (как водоотнимающего средства) со спиртами она образует эфиры:
В(ОН) 3 + ЗСН 3 ОН = (СН 3 O) 3 В + ЗН 2 O
Благодаря высокой прочности ковалентной связи В-О внутри молекулы и, наоборот, слабому межмолекулярному взаимодействию эти эфиры летучи. Их пары при поджигании на воздухе сгорают зеленым пламенем. Эта реакция служит для качественного обнаружения соединений бора.

При частичной дегидратации выше 100 °С из В(ОН) 3 образуются метаборные кислоты (НВO 2) n Например, в триметаборной кислоте (НВO 2) 3 (или В 3 O 3 (OН) 3) три группы ВO 3 объединены через атомы кислорода в замкнутые циклы:

которые образуют слои за счет водородных связей (рис. 4.9, б).
По сравнению с мономерной В(ОН) 3 в триметаборной кислоте в три раза уменьшается количество - ОН-групп, приходящихся на один атом бора. Мостиковые атомы кислорода оттягивают на себя часть электронной плотности от связей В-ОН, делая связи Н-О более полярными и увеличивая тем самым силу метаборной кислоты за счет индукционного эффекта.
В свободном виде выделены и другие борные кислоты, например тетраборная кислота H 2 B 4 О 7 (pK a 1 4,1, рК а2 5,1). Они образуются в результате процессов поликонденсации:
2В(ОН) 3 + [В(ОН) 4 - = [В 3 O 3 (OН) 4 - + 3H 2 O
2В(ОН) 3 + 2[В(ОН) 4 ] - = [В 4 O 5 (OН) 4 ] 2- + 5Н 2 O
Бораты. Это соли борных кислот. Благодаря легкости перестраивания связей В-О-В и различным комбинациям бора с координационными числами 3 и 4 существуют многочисленные варианты связывания треугольных ВO 3 - и тетраэдрических [В(ОН) 4 ] - групп в многоядерные полиборатные анионы. В этом смысле бораты подобны силикатам и фосфатам.
Строение некоторых боратных анионов представлено на рис. 4.10. Общий заряд аниона определяется числом концевых атомов кислорода и тетраэдрических атомов бора, каждый из которых несет один отрицательный заряд. Мономерные треугольные группы В0 3 (рис. 4.10, а) существуют в ортоборате лития Li 3 B0 3 , циклические группы B 3 O 6 3- (рис. 4.10, б) - в метаборате натрия 3 .
Тетраэдры В(ОН) 4 существуют в тетрагидроксоанионе (рис. 4.10, в), а также в пероксоборате Na 2 . 6H 2 0, который получают при взаимодействии Н 3 В0 3 с пероксидом Н 2 0 2 в щелочной среде. Пероксоборат (известен под названием перборат) - важная составная часть моющих средств. При гидролизе пербората образуется Н 2 0 2 , действующая как мягкое отбеливающее средство.
Таблица 19- Характеристика элементов 3Ап/группы
Алюминий находится в главной подгруппе III группы Периодической таблицы. Атомы элементов подгруппы в основном состоянии имеют следующее строение внешней электронной оболочки: ns 2 np 1 . На внешнем энергетическом уровне атомов имеются свободные р-орбитали, что позволяет атомам переходить в возбужденное состояние. В возбужденном состоянии атомы этих элементов образуют три ковалентные связи или полностью отдают три валентных электрона, проявляя степень окисления +3.
Алюминий является самым распространенным металлом на Земле: его массовая доля в земной коре составляет 8,8%. Основная масса природного алюминия входит в состав алюмосиликатов – веществ, главными компонентами которых являются оксиды кремния и алюминия. Алюмосиликаты входят в состав многих горных пород и глин.
Свойства: Al представляет собой серебристо-белый металл, Это легкоплавкий и легкий металл. Он обладает высокой пластичностью, хорошей электро- и теплопроводностью. Al – химически активный металл. Однако его активность в обычных условиях несколько снижается из-за наличия тонкой пленки оксида, которая образуется на поверхности металла при контакте его с воздухом.
1. Взаимодействие с неметаллами. При обычных условиях алюминий реагирует с хлором и бромом:
2Al + 3Cl 2 = 2AlCl 3
При нагревании алюминий взаимодействует со многими неметаллами:
4Al + 3O 2 = 2Al 2 O 3
2Al + 3I 2 = 2AlI 3
2Al + N 2 = 2AlN
4Al + 3C = Al 4 C 3
2. Взаимодействие с водой. Из-за защитной оксидной пленки на поверхности алюминий устойчив в воде. Однако при удалении этой пленки происходит энергичное взаимодействие:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
2. Взаимодействие с кислотами. Алюминий взаимодействует с хлороводородной и разбавленной серной кислотами:
2Al + 6HCl = 2AlCl 3 + 3H 2
2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2
Азотная и концентрированная серная кислоты пассивирует алюминий: при действии этих кислот увеличивается толщина защитной пленки на металле, и он не растворяется.
4. Взаимодействие со щелочами. Алюминий взаимодействует с растворами щелочей с выделением водорода и образованием комплексной соли:
2Al + 6NaOH + 6H 2 O = 2Na 3 + 3H 2
5. Восстановление оксидов металлов. Алюминий является хорошим восстановителем многих оксидов металлов:
2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
Оксид и гидроксид алюминия. Оксид алюминия, или глинозем, Al 2 O 3 представляет собой белый порошок. Оксид алюминия можно получить, сжигая металл или прокаливая гидроксид алюминия:
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
Оксид алюминия практически не растворяется в воде. Соответствующий этому оксиду гидроксид Al(OH) 3 получают действием гидроксида аммония или растворов щелочей, взятых в недостатке, на растворы солей алюминия:
AlCl 3 + 3NH 3 ∙ H 2 O = Al(OH) 3 ↓ + 3NH 4 Cl
Оксид и гидроксид этого металла являются амфотерными, т.е. проявляют как основные, так и кислотные свойства.
Основные свойства :
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 6H 2 O
Кислотные свойства:
Al 2 O 3 + 6KOH +3H 2 O = 2K 3
2Al(OH) 3 + 6KOH = K 3
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
Производство. Алюминий получают электролитическим методом. Он не может быть выделен из водных растворов солей, т.к. является очень активным металлом. Поэтому основным промышленным методом получения металлического алюминия является электролиз расплава, содержащего оксид алюминия и криолит.
Применение. Металлический алюминий широко используется в промышленности, по объему производства занимает второе место после железа. Основная масса алюминия идет на изготовление сплавов:
Дуралюмин – сплав алюминия, содержащий медь и небольшое количество магния, марганца и других компонентов. Дуралюмины – легкие прочные и коррозионностойкие сплавы. Используют в авиа- и машиностроении.
Магналин – сплав алюминия с магнием. Используют в авиа- и машиностроении, в строительстве. Стоек к коррозии в морской воде, поэтому его применяют в судостроении.
Силумин – сплав алюминия, содержащий кремний. Хорошо подвергается литью. Этот сплав используют в автомобиле-, авиа- и машиностроении, производстве точных приборов.
Алюминий – пластичный металл, поэтому из него изготавливают тонкую фольгу, используемую в производстве радиотехнических изделий и для упаковки товаров. Из алюминия делают провода, краски «под серебро».
Задания с профессиональной направленностью
1. Для очистки корнеплодов от кожицы после мойки их обваривают кипящим раствором кальцинированной соды (W = 4%). При избытке соляной кислоты в желудочном соке животных поят раствором питьевой соды. Напишите формулы этих веществ. Назовите другие области применения солей натрия и калия в сельскохозяйственной практике, в быту.
2. Йодид калия широко используют для подкормки животных микроэлементами и для удаления избыточного количества цветков на яблонях. Составьте уравнение реакции получения йодида калия, укажите окислитель и восстановитель.
3. Почему древесную золу (зола содержит в своем составе ионы калия К + и карбонат – ионы СО 3 2-), применяемую для удобрения полей, рекомендуют хранить в закрытых помещениях или под навесом? Напишите уравнения реакций, происходящих в случае увлажнения золы.
4. Слишком большая кислотность почвы оказывает на растение губительное влияние. В этом случае необходимо проводить известкование почвы. Внесение в почву известняка СаСО 3 понижает кислотность. Напишите уравнение реакции протекающей при этом.
5. Кислотность почвы не изменяется от внесения суперфосфата. Однако кислотность суперфосфата, содержащего избыток фосфорной кислоты, вредна для растений. Для его нейтрализации прибавляют СаСО 3 . Прибавить Са(ОН) 2 нельзя, т.к. суперфосфат перейдет в трудно усвояемое растениями соединение. Составьте уравнения соответствующих реакций.
6. Для борьбы с вредителями зерна, плодов и овощей применяется хлор из расчета 35 г на 1 м 3 помещения. Вычислите массу хлорида натрия, достаточного для обработки 300 м 3 помещения хлором, полученным электролизом расплава данной соли.
7. На каждые 100 ц урожая корнеплодов и ботвы сахарной свеклы из почвы выносится примерно 70 кг оксида калия. Какой массой сильвинита КСl · Na Cl, содержащего хлорид калия с массовой долей 0,56, можно компенсировать эти потери?
8. Для подкормки картофеля применяют раствор хлорида калия с массовой долей 0,04. Вычислите массу калийного удобрения (КCl), которая необходима для получения 20 кг такого раствора.
9. При получении питательного раствора для подкормки растений на 400 мл воды берут 1г КNO 3 ,1г МgSO 4 , 1г КН 2 РО 4 , 1г Са(NO 3) 2 . Вычислите массовую долю (в %) каждого вещества в полученном растворе.
10. Для сохранения влажного зерна от гниения его обрабатывают гидросульфатом натрия NaHSO 4 .Вычислите массу гидросульфата натрия, который получается при взаимодействии 120 г гидроксида натрия с раствором серной кислоты.
11. Какое удобрение содержит больше калия: калийная селитра (КNO 3), поташ (К 2 СО 3) или хлористый калий (КСl)?
12. Для предуборочного обезлиствения хлопчатника при его механической уборке применяется цианамид кальция. Найдите формулу этого соединения, зная, что массовые доли кальция, углерода и азота составляют соответственно 0,5; 0,15; 0,35.
13. При анализе древесной золы, применяемой в животноводстве в качестве подкормки для скота, найдено, что в золе массой 70г содержится 18,4 г кальция,0,07г фосфора и 2,3г натрия. Вычислите массовую долю (в %) каждого элемента в указанной подкормке.
14. Сколько известняка, содержащего 90% карбоната кальция, нужно внести на 30 га, если известкование проводить из расчета 4 т СаО на гектар.
15. Имеются: а) чистая аммиачная селитра, б) технический сильвинит, содержащий 33% калия. Смешением этих материалов надо получить одну тонну азотно-калийного удобрения, содержащего 15% азота. Какие количества обоих материалов следует смешать и сколько процентов калия будет содержать такая смесь?
4.9 Раздел: Главные переходные металлы
Цель: Изучить свойства металлов побочных подгрупп и их соединений
Переходные металлы - элементы побочных подгрупп периодической системы.
С увеличением атомной массы усиливается металлический характер элементов. Бор - неметалл, остальные элементы (подгруппа алюминия) - металлы. Бор значительно отличается по свойствам от остальных элементов и больше похож на углерод и кремний. Остальные элементы - легкоплавкие металлы, In и Тl - чрезвычайно мягкие.
Физические свойства элементов главной подгруппы III группы
Все элементы группы трехвалентны, но с увеличением атомного номера более характерной становится валентность 1 (Тl преимущественно одновалентен).
В ряду В-Аl-Gа-In-Тl уменьшается кислотность и увеличивается основность гидроксидов R(ОН) 3 . Н 3 ВО 3 - кислота, Аl(ОН) 3 и Gа(ОН) 3 - амфотерные основания, In(ОН) 3 и Тl(ОН) 3 - типичные основания. ТlOН - сильное основание.
Рассмотрим свойства только двух элементов: подробно - алюминия, как типичного представителя р-металлов, чрезвычайно широко применяемого на практике, и схематично - бора, как представителя «полуметаллов» и проявляющего аномальные свойства по сравнению со всеми другими элементами подгруппы.
Алюминий - самый распространенный металл на Земле (3-е место среди всех элементов; 8% состава земной коры). В виде свободного металла в природе не встречается; входит в состав глиноземов (Аl 2 О 3), бокситов (Аl 2 О 3 xН 2 О). Кроме того, алюминий обнаруживается в виде силикатов в таких породах, как глины, слюды и полевые шпаты.
Алюминий имеет единственный стабильный изотоп , бор - два: 19,9% и 80,1%.
Получение;
1. Электролиз расплава AlCl 3:
2AlCl 3 = 2Al + 3Cl 2
2. Основной промышленный способ - электролиз расплава Al 2 O 3 (глинозема) в криолите 3NaF AlF 3:
2Al 2 O 3 = 4AI + 3O 2
3. Вакуумтермический:
AlCl 3 + ЗК = Al + 3KCl
Физические свойства .
Алюминий в свободном виде - серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Алюминий имеет невысокую плотность - примерно втрое меньше, чем у железа или меди, и одновременно - это прочный металл.
Бор существует в нескольких аллотропных модификациях. Аморфный бор представляет собой темно-коричневый порошок. Кристаллический бор - серо-черный, с металлическим блеском. По твердости кристаллический бор занимает второе место (после алмаза) среди всех веществ. При комнатной температуре бор плохо проводит электрический ток; так же, как кремний, он обладает полупроводниковыми свойствами.
Химические свойства .
Поверхность алюминия обычно покрыта прочной пленкой оксида Аl 2 О 3 , которая предохраняет его от взаимодействия с окружающей средой. Если эту пленку удаляют, то металл может энергично реагировать с водой:
2Аl + 6Н 2 О = 2Аl(ОН) 3 + ЗН 2 .
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
2Аl + 3/2O 2 = Аl 2 О 3 + 1676 кДж.
Это обстоятельство используется для получения ряда металлов из их оксидов методом алюмотермии. Так назвали восстановление порошкообразным алюминием тех металлов, у которых теплоты образования оксидов меньше теплоты образования Аl 2 О 3 , например:
Сr 2 О 3 + 2Аl = 2Сr + Аl 2 О 3 + 539 кДж.
Бор , в отличие от алюминия, химически инертен (особенно кристаллический). Так, с кислородом он реагирует только при очень высоких температурах (> 700°С) с образованием борного ангидрида В 2 О 3:
2В + ЗО 2 = 2В 2 О 3 ,
с водой бор не реагирует ни при каких обстоятельствах. При еще более высокой температуре (> 1200°С) он взаимодействует с азотом, давая нитрид бора (служит для изготовления огнеупорных материалов):
Лишь со фтором бор реагирует при комнатной температуре, реакции же с хлором и бромом протекают только при сильном нагревании (400 и 600 °С соответственно); во всех этих случаях он образует тригалогениды ВНal 3 - дымящие на воздухе летучие жидкости, легко гидролизующиеся водой:
2В + 3Наl 2 = 2ВНаl 3 .
В результате гидролиза образуется ортоборная (борная) кислота H 3 BO 3:
ВНаl 3 + 3Н 2 О = Н 3 ВО 3 + ЗННаl.
В отличие от бора, алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С):
2Аl + 3S = Аl 2 S 3 (сульфид алюминия),
2Аl + N 2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl 4 С 3 (карбид алюминия).
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана.
Алюминий легко растворяется в соляной кислоте любой концентрации:
2Аl + 6НСl = 2АlСl 3 + ЗН 2 .
Концентрированные серная и азотная кислоты на холоде не действуют на алюминий. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н 2 SО 4(конц) = Аl 2 (SО 4) 3 + 3SО 2 + 6Н 2 О,
Аl + 6НNO 3(конц) = Аl(NO 3) 3 + 3NO 2 + 3Н 2 О.
В разбавленной серной кислоте алюминий растворяется с выделением водорода:
2Аl + 3Н 2 SО 4 = Аl 2 (SО 4) 3 + 3Н 2 .
В разбавленной азотной кислоте реакция идет с выделением оксида азота (II):
Аl + 4HNО 3 = Аl(NО 3) 3 + NO + 2Н 2 О.
Алюминий растворяется в растворах щелочей и карбонатов щелочных металлов с образованием тетрагидроксоалюминатов:
2Аl + 2NаОН + 6Н 2 О = 2Na[Аl(ОН) 4 ] + 3Н 2 .
Кислоты, не являющиеся окислителями, с бором не реагируют и только концентрированная HNO 3 окисляет его до борной кислоты:
В + HNO 3(конц) + Н 2 О = Н 3 ВO 3 + NO
Соединения со степенью окисления +3. Важнейшими соединениями бора являются гидриды, галогениды, оксид, борные кислоты и их соли.
Оксид бора - B 2 O 3 - бесцветная хрупкая стеклообразная масса, кислотный оксид, энергично присоединяет воду с образованием ортоборной кислоты:
B 2 O 3 + 3H 2 O = 2H 3 BO 3
H 3 BO 3 - очень слабая одноосновная кислота, причем ее кислотные свойства проявляются не за счет отщепления катиона водорода, а за счет связывания гидроксид-аниона:
H 3 BO 3 + H 2 O H + + - ; рК а = 9,0
При нагревании борная кислота ступенчато теряет воду, образуя вначале метаборную кислоту, а затем оксид бора:
H 3 BO 3 ¾® HBO 2 ¾® B 2 O 3
При взаимодействии со щелочами образует тетрабораты - соли гипотетической тетраборной кислоты:
4H 3 BO 3 + 2NaOH = Na 2 B 4 O 7 + 7H 2 O
Большинство солей – боратов – в воде нерастворимы, исключение составляют бораты s-элементов. Более других используется тетраборат натрия Na 2 B 4 O 7 . В большинстве своем бораты полимерны, выделяются из растворов в виде кристаллогидратов. Полимерных борных кислот из раствора выделить не удается, в связи с тем, что они легко гидратируются. Поэтому при действии кислот на полибораты обычно выделяется борная кислота (эта реакция используется для получения кислоты):
Na 2 B 4 O 7 + H 2 SO 4 + 5H 2 O = 4H 3 BO 3 + Na 2 SO 4
Безводные метабораты получают сплавлением оксида бора или борной кислоты с оксидами металлов:
CaO + B 2 O 3 = Ca(BO 2) 2
Важнейшими соединениями алюминия является алюминий оксид и алюминий гидроксид.
Алюминий оксид Al2O3 - белая тугоплавкая кристаллической вещество, нерастворимое в воде. В лабораторных условиях алюминий оксид добывают сжигание алюминия или термическими разложением алюминий гидроксида:
4Al + 3O2 → 2Al2O3
2Al (OH) 3→ Al2O3 + 3H2O.
По химическим свойствам алюминий оксид являются амфотерными. Он реагирует с кислотами, проявляя свойства основных оксидов:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Реагируйте со щелочами, он проявляет свойства кислотных оксидов. В растворах щелочей образуются комплексные соединения:
Al2O3 + 2KOH + 3H2O = 2K .
При сплавления образуются соли метаалюминиевой кислоты, например, метаалюминат калия:
Al2O3 + 2KOH→2KAlO2 + H2O.
Естественную кристаллическую модификацию алюминий оксида (корунд) применяются в РАЗЛИчНЫХ областях науки и производства. Рубины, например, является материалом для изготовления рабочих камней точных механизмов. Кристаллы корунда - рабочие тела лазеров. Рубины и сапфиры используют для отделки ювелирных изделий. Алюминий оксид является главной составляющей наждака - абразивного материала. Тугоплавкость и коррозионная стойкость алюминий оксида предопределяет его применение для изготовления термостойких химической посуды, кирпича для кладки стекловаренных печей.
Алюминий гидроксид Al (OH) 3 - это нерастворимые в воде кристаллической вещество белого цвета. В лаборатории алюминий гидроксид добывают из растворимых солей алюминия при их взаимодействии с растворами щелочей, например:
AlCl3 + 3КOH = Al (OH) 3 ↓+ 3КCl.
Полученный алюминий гидроксид имеет вид студенистого осадка.
Алюминий гидроксид проявляет амфотерные свойства и растворяется как в кислотах, так и в щелочах:
Al (OH) 3 + 3HCl →AlCl3 + 3H2O
Al (OH) 3 + NaOH → Na .
При сплавления алюминий гидроксида с натрий гидроксидом образуется натрий метаалюминат:
Al (OH) 3 + NaOH→ NaAlO2 + 2H2O.
Способность алюминий гидроксида реагировать с кислотами используют в терапии. Он входит в состав лекарственных препаратов, Которые используются для снижения кислотности и уменьшение изжоге.
Реакция с хлоридом бария.
Борат-ионы при взаимодействии с хлоридом бария в водных растворах образуют белый кристаллический осадок метабората бария Ba(BO 2) 2
Аналитические реакции катиона алюминия Al 3+
1. Реакция с щелочами:
А1 3+ + 3 ОН→А1(ОН) 3 ↓ (белый)
2. Реакция с нитратом кобальта - образование -тенаровой сини.
Тенаровая синь- - смешанный оксид алюминия и кобальта синего цвета.
2 A1 2 (SO 4) 3 + 2 Co(NO 3) 2 -tT-> 2 Со(А1О 2) 2 + 4 NO 2 + 6 SO 3 + O 2 .
Бор относится к примесным микроэлементам, его массовая доля в организме человека составляет 10-5 %. Бор концентрируется главным образом в легких (0,34 мг), щитовидной железе (0,30 мг), селезенке (0,26 мг), печени, мозге (0,22 мг), почках, сердечной мышце (0,21 мг). Биологическое действие бора еще недостаточно изучено. Известно, что бор входит в состав зубов и костей, очевидно, в виде труднорастворимых солей борной кислоты с катионами металлов.