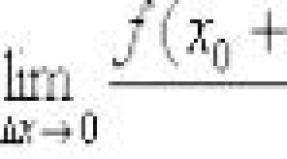3-cü əsas qrup elementlərinin birləşmələri üçün xüsusi adlar. Ümumi xüsusiyyətlər. Xüsusiyyətlər. Bölmə: Əsas keçid metalları
D.I.Mendeleyevin dövri cədvəlinin III qrupunun p-elementlərinə aşağıdakılar daxildir: bor B, alüminium Al, qallium Ga, indium In və tallium Tl. Atomların elektron konfiqurasiyası ns 2 np 1.
Aşağıda nəzərdən keçirilən qrupun p-elementlərinin atomlarının və müvafiq metal maddələrin xassələrini xarakterizə edən bəzi sabitlər müqayisə edilir:
III qrupun p-elementlərinin xassələrinə d-sıxılma (Al dövri sistemdə kiçik III dövrdə, Ga, In və Tl isə d-elementlərdən dərhal sonra böyük dövrlərdə yerləşir) təsir göstərir. Beləliklə, Al-dan Ga-a qədər atom radiusu bir qədər azalır və birinci ionlaşma potensialı artır. Bundan əlavə, f-sıxılma tallium atomlarının xüsusiyyətlərinə də təsir göstərir. Məhz buna görə də Tl atomunun radiusu In atomunun radiusuna yaxındır və ionlaşma enerjisi bir qədər yüksəkdir.
Bor. Atomun elektron quruluşuna (1s 2 2s 2 2p 1) uyğun olaraq bor monovalent ola bilər (2p enerji alt səviyyəsində bir qoşalaşmamış elektron). Bununla belə, bor üçvalentli olduğu birləşmələr üçün ən xarakterikdir (bir atom həyəcanlandıqda, 2s və 2p enerji alt səviyyələrində üç qoşalaşmamış elektron var).
Həyəcanlanmış bor atomunda sərbəst 2p orbital onun bir çox birləşmələrinin akseptor xassələrini müəyyən edir ki, burada mübadilə kovalent mexanizminə uyğun olaraq üç kovalent rabitə əmələ gəlir (məsələn, BBg 3). Bu birləşmələr elektron verən xüsusiyyətlərə malik hissəciklərin əlavə edilməsinə, yəni donor-akseptor mexanizminə uyğun olaraq başqa bir kovalent bağın yaranmasına meyllidirlər. Misal üçün:
BBr 3 + Br - = [BBr 4 ] -
Borun iki izotopu məlumdur: 105 B (19,6%) və 11 5 B (80,4%). İzotopun atomlarının nüvələri (105 V) neytronları asanlıqla udur:
105 V + 1 0 n = 4 2 He + 7 5 Li
Borun neytronları udmaq qabiliyyəti onun nüvə enerjisində istifadəsini müəyyən edir: nüvə reaktorlarının idarəetmə çubuqları bor tərkibli materiallardan hazırlanır.
Bor kristalları qaradır; onlar odadavamlıdır (mp 2300 °C), diamaqnitdir və yarımkeçirici xüsusiyyətlərə malikdir (band boşluğu ΔE = 1,55 eV). Borun elektrik keçiriciliyi digər metallar kimi aşağıdır və temperaturun artması ilə bir qədər də artır.
Otaq temperaturunda bor kimyəvi cəhətdən təsirsizdir və birbaşa yalnız flüorla qarşılıqlı təsir göstərir; Qızdırıldıqda bor xlor, oksigen və bəzi digər qeyri-metallarla oksidləşir. Misal üçün:
4B + 3O 2 = 2B 2 O 3
2В + ЗСl 2 = 2ВСl 3
Qeyri-metallarla birləşmələrdə borun oksidləşmə vəziyyəti +3; bütün bu birləşmələr kovalentdir.
Bor trioksid B 2 O 3 kristal maddədir (mp 450 °C, qaynama nöqtəsi 2250 °C), yüksək entalpiya dəyərləri və Gibbs formalaşma enerjisi ilə xarakterizə olunur. Su ilə qarşılıqlı əlaqədə olduqda, B 2 O 3 bor turşusuna çevrilir:
B 2 O 3 + ZN 2 O = 2H 3 VO 3
H 3 VO 3 çox zəif (K d ≈ 10 -9) bir əsaslı turşudur. H 3 BO 3-ün yalnız bir H + ionunun aradan qaldırılması ilə elektrolitik dissosiasiyası borun əvvəllər təsvir edilmiş qəbuledici xüsusiyyətləri ilə izah olunur: bor atomunun sərbəst 2p orbitalı H-nin dissosiasiyası zamanı əmələ gələn OH elektron donoruna verilir. 2 O molekullar.Proses sxem üzrə gedir
H 3 VO 3 + H 2 O = H[B(OH) 4 ] = H + + [B(OH)4] -
Kompleks anion [B(OH) 4 ] tetraedral quruluşa malikdir (sp 3 -elektron orbitalların hibridləşməsi). Oksidləşmə vəziyyəti + 3 olan birləşmələrdə borun qəbuledici xüsusiyyətləri onun halidlərinin kimyasında da özünü göstərir. Məsələn, reaksiyalar asanlıqla həyata keçirilə bilər
BF 3 + F - = -
BF 3 + NH 3 =
burada BF və F - və ya NH 3 arasındakı kimyəvi bağ donor-akseptor mexanizmi ilə formalaşır. Bor halogenidlərinin elektron qəbuledicisi olmaq xüsusiyyəti onların üzvi birləşmələrin sintezi reaksiyalarında katalizator kimi geniş istifadəsini müəyyən edir.
Bor hidrogenlə birbaşa qarşılıqlı təsir göstərmir, lakin metallarla boridlər əmələ gətirir - adətən qeyri-stexiometrik birləşmələr Me 4 B, Me 2 B, MeV, Me 3 B 4, MeV 2 və MeV 6.
Bor hidridləri (boranlar) çox zəhərlidir və çox xoşagəlməz bir qoxuya malikdir. Onlar çox vaxt dolayı yolla əldə edilir
kimyəvi cəhətdən aktiv boridləri turşularla və ya bor halogenidləri qələvi metal hidridlərlə reaksiya verdikdə:
6MgB 2 + 12HCl = H 2 + 8B + B 4 H 10 + 6MgCl 2
8BF 3 + 6LiH = B 2 H 6 + 6LiBF 4
Borun hidrogen BH 3 ilə ən sadə birləşməsi adi şəraitdə mövcud deyildir, sp 2 - Bor atomunda elektron orbitallarının hibridləşməsi BH3 hissəciyinin koordinasiya doymamasına səbəb olur, nəticədə iki belə hissəcik bir diboran molekuluna birləşir: 2BH3 = B 2 H 6 (ΔG 0 298 = -127 kJ/mol).
Diboran B 2 H 6-da bor 5p 3 hibridləşmə vəziyyətindədir və hər bir bor atomu üçün dörd hibrid orbitaldan biri boşdur, digər üçü isə hidrogen atomlarının s-orbitalları ilə üst-üstə düşür. B 2 H 6 molekulunda BH3 qrupları arasındakı bağlar elektron sıxlığının BH3 qrupunun bir hidrogen atomundan digər BH3 qrupunun boş orbitalına keçməsi nəticəsində hidrogen rabitəsi kimi əmələ gəlir. B n H n+4 və B n H n+6 iki sıra ilə təmsil oluna bilən digər boranlar da məlumdur.
S-metal boridləri reaktivdir və tez-tez turşularla emal yolu ilə bor qarışıqları istehsal etmək üçün istifadə olunur. d- və f-metalların boridlərinin əksəriyyəti istiliyədavamlıdır, çox sərtdir və kimyəvi cəhətdən sabitdir. Onlar reaktiv mühərrik hissələrinin və qaz turbin bıçaqlarının istehsalı üçün birbaşa ərintilər şəklində geniş istifadə olunur. Bəzi boridlər elektron cihazların katodlarını hazırlamaq üçün istifadə olunur.
Alüminium. Alüminium atomunun elektron konfiqurasiyası 1s 2 2s 2 2p 6 3s 2 3p 1 düsturu ilə ifadə edilir. Bir atomun ən xarici elektron təbəqəsi bir qoşalaşmamış elektrona malikdir:
Buna görə alüminium birinə bərabər valentlik nümayiş etdirə bilər. Lakin bu valentlik alüminium üçün xarakterik deyil. Bütün sabit birləşmələrdə alüminiumun oksidləşmə vəziyyəti +3-dür. Üç valentlik Al atomunun həyəcanlanmış vəziyyətinə uyğundur:
Bolluğuna görə alüminium bütün elementlər arasında dördüncü yeri tutur (O, H və Si-dən sonra) və təbiətdə ən çox yayılmış metaldır. Alüminiumun əsas hissəsi alüminosilikatlarda cəmləşmişdir: feldispatlar, slyudalar və s.
Alüminium gümüşü-ağ, yüngül və yüksək istilik və elektrik keçiriciliyinə malik olduqca çevik metaldır.
Alüminium kimyəvi cəhətdən aktivdir; Otaq temperaturunda xlor və bromla, yodla isə qızdırıldıqda və ya katalizator kimi suyun iştirakı ilə reaksiya verir. 800 ° C-də alüminium azotla, 2000 ° C-də isə karbonla reaksiya verir. Alüminium oksigenə yüksək kimyəvi yaxınlıq nümayiş etdirir (ΔG 0 298 = -1582 kJ/mol):
2Al + 0,50 2 = Al 2 O 3, ΔH 0 298 = -1650 kJ/mol
Havada alüminium alüminiumun metal parıltısını bir qədər zəiflədən çox davamlı, nazik (10 -8 m) oksid filmi ilə örtülmüşdür. Oksid filmi sayəsində alüminium səthi yüksək korroziyaya davamlılıq əldə edir. Bu, ilk növbədə alüminiumun suya və su buxarına laqeydliyində özünü göstərir. Qoruyucu bir filmin meydana gəlməsinə görə alüminium konsentratlı azot və sulfat turşularına davamlıdır. Bu turşular soyuqda alüminiumu passivləşdirir. Pasivləşmə meyli, səthini güclü oksidləşdirici maddələrlə (məsələn, K 2 Cr 2 O 7) və ya anodik oksidləşmədən istifadə etməklə alüminiumun korroziyaya davamlılığını artırmağa imkan verir. Bu zaman oksid plyonkasının qalınlığı 3·10 -5 m-ə qədər artır.Yüksək temperaturda qoruyucu təbəqənin möhkəmliyi kəskin şəkildə azalır. Oksid filmi mexaniki qüvvə ilə çıxarılarsa, alüminium son dərəcə reaktiv olur. Su və turşuların və qələvilərin sulu məhlulları ilə güclü reaksiya verir, hidrogeni yerindən çıxarır və kationlar və ya anionlar əmələ gətirir. Alüminiumun turşu məhlulları ilə qarşılıqlı təsiri reaksiya tənliyinə uyğun olaraq davam edir
Al + 6H 2 O + ZH + = [Al(H 2 O) 6 ] 3+ + 0.5H 2
və qələvi məhlullarla
Al + ZH 2 O + OH - = [Al(OH) 4 ] - + 0,5H 2
Alüminium kationları və anionları məhlulun pH-ı dəyişdikdə asanlıqla bir-birinə çevrilir:
[Al(H 2 O) 6 ] 3+ + 4OH - = [Al (OH) 4 ] - + 6H 2 O
[Al(OH) 4 ] - + 4H + + 2H 2 O = [Al(H 2 O) 6 ] 3+
Qarışıq birləşmələr də məhlulda əmələ gələ bilər, məsələn [Al(H 2 O) 5 (OH)] 2+ , [Al (H 2 O) 4 (OH) 2 ] + , [Al (H 2 O) 3 (OH) ) 3]. Sonuncu asanlıqla (xüsusilə qızdırıldıqda) susuzlaşır və Al(OH)3 hidroksidinə çevrilir:
[Al(H 2 O) 3 (OH) 3 ] = Al (OH) 3 + ZH 2 O
Texnologiyada alüminiumdan ən geniş istifadə onun qiymətli fiziki və kimyəvi xassələrinə və yer qabığında yüksək bolluğuna əsaslanır. Yüksək elektrik keçiriciliyinə (4·10 -5 Ohm -1 sm -1) və aşağı sıxlığa görə elektrik naqillərinin istehsalı üçün istifadə olunur. Alüminiumun yüksək çevikliyi ondan kondansatörlərdə istifadə olunan və kabel örtüklərində qurğuşunu alüminiumla əvəz edən ən incə folqa hazırlamağa imkan verir. Alüminium ərintiləri maqnitsizliyə görə radiotexnikada istifadə olunur.
Alüminiumun əsas hissəsi yüngül ərintilərin istehsalı üçün istifadə olunur - duralumin (94% Al, qalan Cu, Mg, Mn, Fe və Si), silumin (85-90% Al, 10-14% Si, qalan Na) və s. Alüminium ərintilərə istilik müqavimətini artırmaq üçün əlavə olaraq ərintilərə əlavə olaraq istifadə olunur. Alüminium və onun ərintiləri təyyarə konstruksiyasında, raketqayırmada, maşınqayırmada və s. struktur materialları kimi əsas yerlərdən birini tutur. Alüminiumun (xüsusilə anodlaşdırılmış) korroziyaya davamlılığı poladın korroziyaya davamlılığını əhəmiyyətli dərəcədə üstələyir. Buna görə də onun ərintiləri konstruksiya materialları kimi və gəmiqayırmada istifadə olunur. d-elementləri ilə alüminium kimyəvi birləşmələr əmələ gətirir - intermetalidlər (alüminidlər): NiAl, Ni 3 Al, CoAl və s., İstiliyədavamlı materiallar kimi istifadə olunur. Alüminium aluminotermiyada bir sıra metallar istehsal etmək və termit üsulu ilə qaynaq etmək üçün istifadə olunur. Aluminotermiya alüminiumun oksigenə yüksək yaxınlığına əsaslanır. Məsələn, tənliyə görə gedən reaksiyada
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
Təxminən 3500 kJ istilik ayrılır və temperatur 3000 ° C-ə çatır.
Alüminium oksidi bir neçə modifikasiya şəklində tanınır. Ən stabil α-Al 2 O 3-dür. Bu modifikasiya yer qabığında mineral korund şəklində olur, ondan üyüdmə diskləri və zümrüd tozları hazırlanır. Korundun aşındırıcı material kimi istifadəsi onun yüksək sərtliyinə əsaslanır, almaz, SiC karborund və BN borazonun sərtliyindən sonra ikincidir. Al 2 O 3-ü Cr 2 O 3 ilə birləşdirərək süni yaqutlar alınır. Onlar dəqiq mexanizmlərdə dayaq daşları hazırlamaq üçün istifadə olunur. Son zamanlar kvant generatorlarında (lazerlərdə) süni yaqutlardan istifadə edilir. Al 2 O 3-dən hazırlanmış məhsullar odadavamlı və dielektriklər kimi istifadə olunur.
Alüminium hidroksid Al(OH) 3 polimer birləşməsidir. O, laylı kristal qəfəsə malikdir. Hər bir təbəqə Al(OH) 6 oktaedrdən ibarətdir (şək. 1); Qatlar arasında hidrogen bağı var. Mübadilə reaksiyası nəticəsində əldə edilən alüminium hidroksid, turşularda və qələvilərdə yaxşı həll olunan jelatinli ağ çöküntüdür. Dayanarkən çöküntü "qocalır" və kimyəvi aktivliyini itirir. Kalsine edildikdə, hidroksid su itirir və Al 2 O 3 oksidinə çevrilir. Susuzlaşdırılmış hidroksid formalarından biri olan alüminium gel texnologiyada adsorbent kimi istifadə olunur.
Alüminium birləşmələri - aluminosilikatlar ilə əlaqəli seolitlər olduqca böyük maraq doğurur. Onların tərkibi Me x E y O 2y ·nH 2 O ümumi düsturu ilə ifadə edilə bilər, burada Me-Ca və ya Na (daha az hallarda Ba, Sr, K); E - Si və Al dəyişən nisbətdə. Seolit kristallarında H2O molekullarının nüfuz edə biləcəyi kanallar var.Seolitlərdəki suyun tərkibi su buxarının təzyiqindən asılı olaraq geniş şəkildə dəyişir. Seolitlər tərkibində olan suyu başqa mayelərlə (spirt və s.) dəyişdirmək qabiliyyətinə malikdirlər. Zərif isitmə ilə su tədricən seolitlərdən çıxarılır. Amma hətta tam dehidrasiya seolit kristallarının məhvinə səbəb olmur. Seolitlərdəki Ca 2+ və ya Na + kationları diffuziya təbəqəsi əmələ gətirir; onlar kristal qəfəsdə sabit deyil, su ilə birlikdə kristalın boşluqlarında yerləşirlər. Bu, seolitlərdə texniki məqsədlər üçün vacib olan kation mübadiləsi xüsusiyyətlərinin olmasını izah edir. Bəzi kationları digərləri ilə əvəz etmək qabiliyyəti seolitlərdən ion dəyişdirici kimi istifadə etməyə imkan verir.
düyü. 1. Oktaedral struktur vahidləri AB 6, birləşmə AB 3 ilə əmələ gələn təbəqənin quruluşu
Bir sıra süni seolitlərdən molekulyar ələklər kimi istifadə olunur. Sonuncuların kristalları diametri 3·10 -10 ilə 13·10 -10 m arasında olan dar kanalların olması ilə xarakterizə olunur.Molekulyar ələklər molekulları bu dəliklərə daxil ola bilən maddələri udur.
Məsələn, deşik diametri 3,5·10 -10 m olan molekulyar ələk H 2, O 2, N 2 molekullarını qəbul edə bilər, lakin CH 4 və ya Ar-ın daha böyük molekullarını udmur. Molekulyar ələklərdən istifadə edərək, karbohidrogenləri, quru qazları və s.
Qallium, indium və tallium sadə maddələr şəklində əriyən gümüşü-ağ metallardır. Ga, In və Tl-in fiziki-kimyəvi xassələri, nəzərdən keçirilən elementlərin atomlarının xarici enerji səviyyəsinin elektron quruluşunun oxşarlığına baxmayaraq, Al-ın xüsusiyyətlərindən kəskin şəkildə fərqlənir.
Bu, yəqin ki, Al atomlarının xarici enerji səviyyəsinin elektron strukturunda fərqlə bağlıdır: bir tərəfdən (n-1)s 2 (n-1)p 6, digər tərəfdən Ga, In və Tl atomları. : (n-1)s 2 (n-1)р 6 (n-1)d 10 .
Sabit birləşmələrdə qalium və indiumun oksidləşmə vəziyyəti +3-dür. +1 oksidləşmə vəziyyəti tallium üçün daha xarakterikdir.Metalın oksidləşmə vəziyyəti +3 olan tallium birləşmələri güclü oksidləşdirici maddələrdir.
Qallium maye halının mövcudluğunun geniş temperatur diapazonuna malikdir. Aşağı ərimə nöqtəsi (təxminən 30 ° C).
İndium bütün dalğa uzunluqlarının işıq dalğalarını bərabər şəkildə əks etdirir və buna görə də güzgülərin istehsalı üçün dəqiq cihazlarda istifadə olunur. Bundan əlavə, In bəzi aşağı ərimə ərintilərinin bir hissəsidir.
Tallium da bəzi ərintilərə, əsasən qalay və qurğuşun (turşuya davamlı, daşıyıcı) ilə ərintilərə daxil edilir.
Ga 2 O 3, In 2 O 3 və Tl 2 O 3 oksidləri suda praktiki olaraq həll olunmur. Ga 2 O 3 - 2 O 3 - Tl 2 O 3 seriyasında əsas xassələrin nəzərəçarpacaq dərəcədə artması oksidlərin turşularda artan həllində özünü göstərir.
Ga(OH) 3, In(OH) 3, Tl(OH) 3 hidroksidləri oksidlər kimi suda həll olunmur. Ga(OH) 3-ün ağ çöküntüsü turşularda və qələvilərdə eyni dərəcədə həll olunur, qırmızı-qəhvəyi Tl(OH) 3 isə yalnız turşularda həll olunur.
Qallium və indium dövri sistemin V qrupunun p-elementləri ilə A III B V tipli ikili birləşmələrlə əmələ gəlir (məsələn, GaP, GaAs, InSb və s.). A III B V tipli birləşmələrin böyük əksəriyyətində elektron orbitallar sp 3 -hibridləşmişdir; bu birləşmələrin kristal qəfəsləri kimyəvi bağların tetraedral düzülüşü ilə xarakterizə olunan bir quruluşa malikdir. Bu almaza bənzər birləşmələrin çoxu yarımkeçiricilərdir. Onlar AC rektifikatorları, sensorlar, termoelektrik generatorlar və s. üçün material kimi istifadə olunur.
4. d-elementlərinə atomlarında (n – 1)d ns-səviyyələrində valent elektronları olan və tipik s-metallar (IA, IIA) və p-elementləri. Dövri sistemdəki 109 elementdən 37-si d elementidir; bunlardan sonuncu 7-si radioaktivdir və natamam yeddinci dövrə daxildir. d-elementlərin atomlarının elektron quruluşu onların kimyəvi xassələrini müəyyən edir. 3d elementləri 4d və 5d elementlərindən əhəmiyyətli dərəcədə fərqlənən kimyəvi xüsusiyyətlərə malikdir. Üstəlik, IVB-VIIB alt qruplarının elementləri bir çox kimyəvi xüsusiyyətlərə görə çox oxşardır. Bu oxşarlıq, 4f orbitalları doldurarkən radiusların monotonik azalması səbəbindən sirkonium və hafnium, niobium və tantal, molibden və volfram, texnesium və renium radiuslarının praktiki şəkildə üst-üstə düşməsinə səbəb olan lantanidlərin büzülməsi ilə əlaqədardır. Bu cütlərin elementləri fiziki və xüsusilə kimyəvi xüsusiyyətlərə görə çox oxşardır; ilk altı element bəzi filiz yataqlarında tapılır və onları ayırmaq çətindir; onları bəzən əkiz elementlər də adlandırırlar.
d-elementlərinin atomları ümumi elektron düstur (n – 1)d 1–10 ns 0–2 ilə xarakterizə olunur. Bəzi ağır d elementləri tam elektron analoq deyil. Cədvəldə 8.10 bütün d-elementlərin elektron düsturlarını və onların nümayiş etdirdiyi mümkün oksidləşmə dərəcələrini göstərir. Elektronların sayının artması bəzən d-orbitalların populyasiyasında qeyri-monotonluqla müşayiət olunur. Bu (n – 1)d- və ns-orbitalların enerjilərinin yaxınlaşması və dövrün sonuna doğru elektron-elektron qarşılıqlı təsirinin güclənməsi ilə bağlıdır.
d-elementlərində valentlik elektronlarının yalnız kiçik bir hissəsi bütün kristalda delokalizasiya olunur (qələvi və qələvi torpaq metallarında isə valentlik elektronları tamamilə paylaşılır). Qalan d-elektronlar qonşu atomlar arasında yönəldilmiş kovalent rabitələrin formalaşmasında iştirak edir. Beləliklə, kristallıq vəziyyətində olan bu elementlər sırf metal rabitəsinə malik deyil, kovalent-metal rabitəlidir. Buna görə də onların hamısı sərt (Hg istisna olmaqla) və odadavamlı (Zn, Cd istisna olmaqla) metallardır
Doldurulmamış d-qabıqlar və enerji baxımından yaxın olan doldurulmamış ns- və np-səviyyələrinin olması səbəbindən d-elementləri kompleks əmələ gəlməyə meyllidir; onların kompleks birləşmələri adətən rəngli və paramaqnit olur.
d-Elementlər əsas altqrupların elementlərindən daha çox dəyişkən tərkibli birləşmələr (oksidlər, hidridlər, karbidlər, silisidlər, nitridlər, boridlər) əmələ gətirir. Bundan əlavə, onlar bir-biri ilə və digər metallarla, həmçinin intermetal birləşmələrlə ərintilər əmələ gətirirlər.
D-elementləri valentlik vəziyyətlərinin böyük dəsti ilə xarakterizə olunur (Cədvəl 8.10) və nəticədə geniş diapazonda turşu-əsas və redoks xassələrində dəyişikliklər olur.
d-elementlərinin E(0) əsas altqruplarının elementləri ilə oxşarlığı ns 2 np 1 və (n – 1)d 1 ns 2 üçüncü qrupun elementlərində tam şəkildə özünü göstərir. Qrup sayı artdıqca azalır; VIIIA yarımqrupunun elementləri qazlar, VIIIB metallardır. Birinci qrupda yenidən uzaq oxşarlıq görünür (bütün elementlər metaldır) və IB alt qrupunun elementləri yaxşı keçiricilərdir; bu oxşarlıq ikinci qrupda gücləndirilir, çünki d-elementləri Zn, Cd və Hg kimyəvi rabitənin yaranmasında iştirak etmir.
Daha yüksək oksidləşmə dərəcələrində olan alt qrupların IIIB–VIIB d-elementləri xassələrinə görə müvafiq p-elementlərinə oxşardır. Beləliklə, daha yüksək oksidləşmə vəziyyətlərində Mn (VII) və Cl (VII) elektron analoqlardır. Elektron konfiqurasiyaların oxşarlığı (s 2 p 6) heptavalent manqan və xlor birləşmələrinin oxşar xüsusiyyətlərinə səbəb olur. Normal şəraitdə Mn 2 O 7 və Cl 2 O 7 ümumi düstur NEO 4 olan güclü turşuların anhidridləri olan qeyri-sabit mayelərdir. Aşağı oksidləşmə vəziyyətlərində manqan və xlor müxtəlif elektron strukturlara malikdir, bu da onların birləşmələrinin xassələrində kəskin fərqə səbəb olur. Məsələn, aşağı xlor oksidi Cl 2 O (s 2 p 4) hipoklor turşusu anhidridi (HClO) olan qazlı bir maddədir, aşağı manqan oksidi MnO (d 5) isə əsas kristal bərk maddədir.
Məlum olduğu kimi, metalın reduksiya qabiliyyəti təkcə onun ionlaşma enerjisi (M – ne – → M n+ ; +∆H ionlaşması) ilə deyil, həm də əmələ gələn kationun hidratasiya entalpiyası (M n+ + mH 2) ilə müəyyən edilir. O → M n+ mH 2 O; –∆ H hid). d-elementlərinin ionlaşma enerjiləri digər metallarla müqayisədə yüksəkdir, lakin onlar ionlarının nəmləndirilməsinin böyük entalpiyaları ilə kompensasiya edilir. Nəticədə, əksər d elementlərinin elektrod potensialları mənfi olur.
Z artdıqca metalların azaldıcı xüsusiyyətləri azalır, IB qrup elementləri üçün minimuma çatır. VIIIB və IV qrup ağır metallar inertliyinə görə nəcib adlanır.
d-elementlərinin birləşmələrinin redoks meylləri onların dövri sistemdəki mövqeyindən asılı olaraq daha yüksək və aşağı oksidləşmə dərəcələrinin sabitliyinin dəyişməsi ilə müəyyən edilir. Elementin oksidləşmə vəziyyəti ən yüksək olan birləşmələr yalnız oksidləşdirici, ən aşağı azaldıcı xüsusiyyətlərə malik olan birləşmələr nümayiş etdirir. Mn(OH) 2 havada asanlıqla oksidləşir Mn(OH) 2 + 1/2O 2 = MnO 2 + H 2 O. Mn(IV) birləşmələri asanlıqla Mn (II)-ə qədər azalır: MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O, lakin güclü oksidləşdirici maddələrlə Mn (VII) qədər oksidləşir. Permanqanat ionu MnO 4 yalnız oksidləşdirici maddə ola bilər.
Altqrup daxilindəki d elementləri üçün yüksək oksidləşmə dərəcələrinin sabitliyi yuxarıdan aşağıya doğru artdığından, ən yüksək oksidləşmə dərəcələrinə malik birləşmələrin oksidləşmə xassələri kəskin şəkildə azalır. Beləliklə, xrom (VI) (CrO 3, K 2 CrO 4, K 2 Cr 2 O 7) və manqan (VII) (Mn 2 O 7, KMnO 4) birləşmələri güclü oksidləşdirici maddələrdir və WO 3, Re 2 O 7 və onlara uyğun olan turşuların duzları (H 2 WO 4, HReO 4) çətinliklə azaldılır.
d-element hidroksidlərinin turşu-əsas xassələrinə p-element hidroksidləri kimi eyni amillər (ion radiusu və ion yükü) təsir edir.
d-elementlərinin aşağı oksidləşmə dərəcələrinin hidroksidləri adətən əsas xassələri, yüksək oksidləşmə vəziyyətlərinə uyğun olanları isə turşu xassələri nümayiş etdirirlər. Aralıq oksidləşmə vəziyyətlərində hidroksidlər amfoterdir. Oksidləşmə dərəcəsinin dəyişməsi ilə hidroksidlərin turşu-qələvi xassələrinin dəyişməsi xüsusilə manqan birləşmələrində özünü göstərir. Mn(OH) 2 – Mn(OH) 3 – Mn(OH) 4 – H 2 MnO 4 – HMnO 4 silsiləsində hidroksidlərin xassələri zəif əsas Mn(OH) 2-dən amfoter Mn(OH) 3-ə qədər dəyişir. və Mn(OH) 4-dən güclü turşulara H 2 MnO 4 və HMnO 4.
Bir altqrup daxilində eyni oksidləşmə vəziyyətinin d-elementlərinin hidroksidləri yuxarıdan aşağıya doğru hərəkət edərkən əsas xüsusiyyətlərin artması ilə xarakterizə olunur. Məsələn, IIIB qrupunda Sc(OH) 3 zəif əsas, La(OH) 3 isə güclü əsasdır. IVB qrupu elementləri Ti, Zn, Hf amfoter hidroksidlər E(OH) 4 əmələ gətirir, lakin Ti-dən Hf-ə keçdikdə onların turşuluq xassələri zəifləyir.
Keçid elementlərinin fərqli xüsusiyyəti dəyişkən tərkibli fazaların formalaşmasıdır. Bunlar, birincisi, interstisial və əvəzedici bərk məhlullar, ikincisi, dəyişkən tərkibli birləşmələrdir. Bərk məhlullar oxşar elektronmənfiliyə, atom radiusuna və eyni kristal qəfəslərə malik elementlərdən əmələ gəlir. Təbiətdə nə qədər çox elementlər fərqlənirsə, onlar bir o qədər az həll olur və kimyəvi birləşmələr əmələ gətirməyə bir o qədər meyilli olurlar. Belə birləşmələr həm sabit, həm də dəyişkən tərkibə malik ola bilər. Komponentlərdən birinin qəfəsinin qorunub saxlanıldığı bərk məhlullardan fərqli olaraq, birləşmələr yeni qəfəsin və yeni kimyəvi bağların əmələ gəlməsi ilə xarakterizə olunur. Başqa sözlə, yalnız quruluşu və xassələri ilə orijinaldan kəskin şəkildə fərqlənən dəyişkən tərkibli fazalar kimyəvi birləşmələr kimi təsnif edilir.
Dəyişən tərkibli birləşmələr aşağıdakı xüsusiyyətlərlə xarakterizə olunur:
a) Bu birləşmələrin tərkibi hazırlanma üsulundan asılıdır. Beləliklə, sintez şəraitindən asılı olaraq, titan oksidləri TiO 1,2-1,5 və TiO 1,9-2,0; titan və vanadium karbidləri - TiC 0,6-1,0 və VС 0,58-1,09, titan nitridi TiN 0,45-1,00.
b) Birləşmələr kəmiyyət tərkibində əhəmiyyətli tərəddüdlər olsa belə, kristal qəfəslərini saxlayır, yəni geniş homojenliyə malikdirlər. Beləliklə, TiC 0.6-1.0, düsturdan göründüyü kimi, tərkibində 40% -ə qədər karbon atomunun olmaması ilə titan karbid qəfəsini saxlayır.
c) Belə birləşmələrdə əlaqənin xarakteri metalın d-orbitallarının doldurulma dərəcəsi ilə müəyyən edilir. Daxil edilmiş qeyri-metalın elektronları boş d-orbitalları tutur, bu da bağların kovalentliyinin artmasına səbəb olur. Buna görə d seriyasının (IV-V qrupları) ilkin elementlərinin birləşmələrində metal bağların nisbəti azalır.
Onlarda kovalent bağların olması birləşmələrin əmələ gəlməsinin böyük müsbət entalpiyaları, onları əmələ gətirən metallarla müqayisədə daha yüksək sərtlik və ərimə nöqtəsi, aşağı elektrik keçiriciliyi ilə təsdiqlənir.
Əlaqədar məlumat.
Dövri sistemdə 30 p - elementi məlumdur, bunlar III-A - VIII-A qruplarında yerləşən elementlərdir. P-elementlərdə xarici elektron səviyyənin p-alt səviyyəsi elektronlarla doldurulur.
III-A qrupu – B, Al, Ga, In, Tl – atomun xarici elektron təbəqəsində 3 elektronun olması, atomun xarici təbəqəsində borun 2 elektron, alüminiumun 8 elektron olması ilə xarakterizə olunur. Ga, In, Tl – 18 elektron. III qrup elementi ən intensivdir - lantanidlər və aktinidlər daxil olmaqla 37 elementdən ibarətdir. Bor istisna olmaqla, bütün elementlər metaldır.
Al-dan Ga-ya gedərkən atom radiusu azalır. Bu onunla bağlıdır ki, Ga-da p-alt səviyyənin doldurulması 3d 10 elektron qabığı doldurulduqdan sonra başlayır. 3d 10 - elektronların təsiri altında bütün atomun elektron qabığı sıxılır və atomun ölçüsü azalır (d - sıxılma effekti).
Metal xassələrdə monoton (ardıcıl) dəyişiklik müşahidə olunmur. Bordan alüminiuma keçdikdə metal xassələri kəskin şəkildə artır, qalliumda bir qədər zəifləyir, taliuma keçdikdə isə tədricən yenidən artır. Bu, Ga atomunun elektron qabığının d-elektronların (d-sıxılma effekti) hesabına sıxılması ilə əlaqədardır.In, Tl (B və Al-dan fərqli olaraq) hər birində sondan əvvəlki təbəqədə 18 elektron var. Buna görə də Al-dan Ga-ya xassələrin (siçovul, Tmelt və s.) xətti dəyişməsi pozulur.
Qaynama nöqtəsi təbii olaraq B-dən Tl-ə qədər azalır. Kristal qəfəsin struktur xüsusiyyətlərinə görə ərimə nöqtəsi qeyri-müntəzəmdir.
Ən çox əriyən metal Ga (Tm = 29.8˚C).
Həyəcansız vəziyyətdə, xarici təbəqənin konfiqurasiyası ns 2 n.p. 1 , həyəcanlı vəziyyətdə - ns 1 np 2.
Həyəcanlanmamış vəziyyətdə 1 qoşalaşmamış elektron var, lakin oksidləşmə vəziyyəti +1 olan bu elementlərin əksəriyyətinin birləşmələri çox qeyri-sabitdir və həyəcanlanmış vəziyyətdə +3 oksidləşmə vəziyyəti onlara ən xarakterikdir, çünki Bir elektronu s vəziyyətindən p vəziyyətinə köçürmək üçün bir az enerji lazımdır.
B qeyri-metaldır, Al hələ tipik metal deyil, Ga, In, Tl tipik metallardır. Qarışıqlar: EN 3, E 2 O 3, E(OH) 3.
B 2s 2 2p 1 IN 2 N 6
A
Regenerativ qabiliyyət və sabitlik artır
Ga [ Ar]4 s 2 4 səh 1 (GaH 3 ) n
In [ Kr]5 s 2 5 səh 1 (InH 3 ) n
Tl [ Xe]6 s 2 6 səh 1 TlH 3
E 2 HAQQINDA 3
B 2 O 3 turşu oksidi
Al 2 O 3 amfoter oksid
Ga 2 O 3
In 2 O 3 amfoter oksid (əsas xüsusiyyətləri üstünlük təşkil etməklə)
Tl 2 O(Tl 2 O 3) əsas oksid
E(OH) 3
H
böyüyürlər əsas xassələri
Al(OH) 3 amfoter hidroksid
Ga(OH) 3 amfoter hidroksid
In(OH) 3 amfoter hidroksid TlOHəsas hidroksid
Onlar halogenlər EG 3, kükürd E 2 S 3, azot EN ilə birləşmələr əmələ gətirirlər.
Bor və silisiumun oksigen birləşmələrinin kimyasında çoxlu ümumi cəhətlər var: oksidlərin və hidroksidlərin asidik təbiəti, çoxsaylı polimer strukturları əmələ gətirmə qabiliyyəti və oksidlərin şüşə əmələ gəlməsi.
13-cü qrupun elementləri: bor 5 B, alüminium 13 Al, qalium 31 Ga, indium 49 In və tallium 81 Tl - tək atom nömrələri olan atomlar üçün xarakterik olan bir neçə sabit izotop var. Yer vəziyyətinin elektron konfiqurasiyası ns 2 np 1 tək qoşalaşmamış elektronun olması ilə xarakterizə olunur. Həyəcanlı vəziyyətdə, sp 2 hibridləşməsində olan, üç kovalent bağın meydana gəlməsində iştirak edən üç qoşalaşmamış elektron ehtiva edir. Bu halda 13-cü qrupun elementlərinin atomları bir boş orbitalda qalır və valent elektronların sayı enerjidə mövcud olan orbitalların sayından az olur. Buna görə də, 13-cü qrup elementlərinin bir çox kovalent birləşmələri Lyuis turşularıdır - elektron cütünün qəbulediciləri, əldə edərək, onlar yalnız koordinasiya sayını dördə çatdırmır, həm də ətraf mühitin həndəsəsini dəyişir - planardan tetraedra dəyişir ( sp 3 hibridləşmə vəziyyəti).
Bor digər qrup 13 elementlərindən çox fərqli xüsusiyyətlərə malikdir. O, yeganə qeyri-metaldır, kimyəvi cəhətdən inertdir və B-F, B-N, B-C və s. kovalent bağlar əmələ gətirir ki, onların çoxluğu tez-tez bu səbəbdən artır. rπ-rπ - bağlayıcı. Borun kimyası silisiumun kimyasına daha yaxındır, bu, diaqonal oxşarlıq göstərir.
Alüminium atomlarında və onun ağır analoqlarında boş d-orbitallar görünür, atomun radiusu artır və buna görə də koordinasiya sayı altıya (və ya daha çox) qədər artır.
Qallium, indium və tallium D-bloklu metalların Dövri Cədvəlin altında yerləşir, buna görə də onları tez-tez adlandırırlar. keçiddən sonrakı elementlər. D qabığının doldurulması atomların ardıcıl sıxılması ilə müşayiət olunur, 3d cərgəsində o qədər güclü olur ki, dördüncü enerji səviyyəsi görünəndə radius artımını neytrallaşdırır. Nəticə olaraq d-sıxılma Alüminium və qalliumun ion radiusları yaxındır və qalliumun atom radiusu alüminiumdan daha kiçikdir.
Əsas altqrupun 3-cü (13-cü) qrupunun elementlərinin atomlarının ionlaşma enerjisi ikincil altqrupun 3-cü (13) qrupunun elementlərininkindən daha yüksəkdir, bu da qarşılıqlı təsirin artması ilə əlaqədardır. ns- və doldurulması səbəbiylə nüvə ilə np elektronlar d- və nüvə yükünü zəif qoruyan elektronların f-qabıqları.
13-cü qrupun elementlərinin birləşmələri üçün oksidləşmə vəziyyəti +3-dür. B-AI-Ga-In-Tl seriyasında belə birləşmələrin dayanıqlığı azalır, oksidləşmə vəziyyəti +1 olan birləşmələrin sabitliyi isə əksinə artır. Halogenidlərdə M-G rabitəsinin enerjisi yüngül elementlərdən daha ağır elementlərə keçid zamanı azalır, oksidlərin və hidroksidlərin amfoter xassələri daha böyük əsaslığa doğru dəyişir.
İndiumun və xüsusilə qalliumun kimyası ümumiyyətlə alüminium kimyasına çox yaxındır. Bu metalların sulu məhlullarda daha aşağı oksidləşmə vəziyyətində olan birləşmələri (Ga 2 0, Ga 2 S, InCl, In və s.) qeyri-mütənasibdir: 3lnСl = InС1 3 + 2 In. Tallium üçün +1 vəziyyəti, əksinə, elektron cütünün hərəkətsizliyinə görə ən sabitdir. 6s 2 .
Bor yer qabığında nisbətən nadirdir (9 10 -4 wt.%), burada oksigen birləşmələri: boratlar və borosilikatlar şəklində baş verir. Onlardan birinin adından - borax Na 2 B 4 0 7. H 2 O (lat. boraks) - və elementin adı ondan gəlir.
Alüminium yer qabığında tərkibinə görə üçüncü yeri (8,3 kütlə %), oksigen (45,5 kütlə %) və silisiumdan (25,7 kütlə %) sonra ikinci yeri tutur. Alüminium ən çox yayılmış metaldır; onun ən əhəmiyyətli filizləri və mineralları boksit A1 2 O 3-dür. 2H 2 O korund A1 2 O 3 və nefelin Na 3 K 4, həmçinin feldispatların, mikaların, gillərin və s.
Qallium (4,6 10 -4 ağırlıq%), indium (2 10 -6 ağırlıq%) və tallium (8 10 -7 wt.%) nadir elementlərdir. İon radiuslarının yaxınlığına görə boksitlərdə qallium alüminiumla, alüminosilikatlarda tallium kaliumla müşayiət olunur.
Bor qara (kristal) və ya qəhvəyi (amorf) rəngli odadavamlı diamaqnit tozudur, zəif istilik və elektrik keçiricisidir. Alüminium, qallium, indium və tallium xarakterik parıltıya və yüksək elektrik və istilik keçiriciliyinə malik gümüşü metallardır. Havada saxlandıqda tallium oksid filmi ilə örtüldüyü üçün tez qaralır.
Kristal bor kimyəvi cəhətdən təsirsizdir. B 2 0 3 oksidi yaratmaq üçün yalnız təxminən 750 ° C-də oksigenlə reaksiya verir. HF, HC1 və NaOH-un qaynar konsentratlı məhlulları ona heç bir təsir göstərmir. Amorf bor kimyəvi cəhətdən daha aktivdir və isti konsentrasiyalı HN0 3, H 2 S0 4, xrom qarışığı, H 2 0 2 və (NH 4) 2 S 2 O8 konsentratlı məhlulları ilə yavaş-yavaş oksidləşir:
B + 3HN0 3 = H3BO3 + 3N0 2
Ərinmiş Na 2 0 2 və KNO ilə reaksiya verir 3 /Na 2 CO 3 və oksidləşdirici maddənin iştirakı ilə - və qələvilərlə:
4B + 4NaOH + 30 2 = 4NaB0 2 + 2H 2 0
Amorf borun KMn0 4 və Pb0 2 ilə qarışıqları sürtüldükdə alovlanır, HİO 3 ilə qarışıqlar isə partlayır. Yüksək temperaturda bor H2, Ge, Te, inert qazlar və civə istisna olmaqla, əksər sadə maddələrlə reaksiya verir.
Alüminium, qallium və indium qeyri-metallarla (0 2 , N 2 , S, X 2 halogenlər və s. Həddindən artıq metalda daha aşağı sulfidlər (GaS, InS) və halidlər (InBr, In) əldə edilə bilər. Bu şəraitdə tallium oksidləşmə dərəcəsi +1 olan birləşmələr əmələ gətirir.
Alüminiumun oksigenlə oksidləşmə reaksiyası çox miqdarda istilik yayılması ilə müşayiət olunur və bir çox metalı oksidlərindən azaltmaq üçün istifadə olunur, məsələn:
2Al + Fe 2 0 3 = Al 2 0 3 + 2Fe
Alüminium və onun analoqları bir çox metallarla kimyəvi birləşmələr əmələ gətirir - intermetal birləşmələr, məsələn CuA1 2, Al 2 CuMg və s.
Al, Ga, In, Tl metalları gərginlik sırasında hidrogenin solunda yerləşir və onların su və oksidləşdirici olmayan turşularla oksidləşməsi termodinamik cəhətdən mümkündür:
2А1 + 6Н + + 12Н 2 0 = 2[Аl(Н 2 0) 6 ] 3+ + ЗН 2
İndium və tallium da turşularda həll olur, lakin tallium (Tl(III) birləşmələrinin dayanıqlığının azalması səbəbindən oksidləşdirici olmayan turşularla qarşılıqlı əlaqədə olduqda T1(1) duzlarını əmələ gətirir. Talliumun hidroxal turşuları ilə reaksiyası HX (). X = Cl, Br, I ) halogenidlərin aşağı həll olması səbəbindən inhibə edilir.Tl-ə “aqua regia” (üç həcm HCl(kons.) + bir həcm HNO3(kons.) məruz qaldıqda Tl(III) törəmələri əmələ gəlir. .)) və digər güclü oksidləşdirici maddələr.
Al - Ga - In - Tl silsiləsində birləşmələrin əsas xassələri artır, turşu xassələri isə azalır. Alüminium və qallium, bəzi tipik qeyri-metallar kimi, qoruyucu oksid təbəqəsini həll edən qələvilərlə reaksiya verir:
2A1 + 2NaOH + 10Н 2 0 = 2Na + ЗН 2
Bor. Borda qeyri-metal xüsusiyyətlərin üstünlük təşkil etməsinin səbəbi. Borun alınması, onun fiziki və kimyəvi xassələri. Borun metallar və qeyri-metallarla birləşmələri. bor karbid; bor nitridi, altıbucaqlı və kubik (borazon). Bor halogenidləri. Bor birləşmələrinə əsaslanan qeyri-üzvi polimerlər. Tetraflorobor turşusu, onun duzları. Borazol benzolun analoqudur.
Bor üçüncü qrupun əsas yarımqrupunun elementi, D.İ.Mendeleyevin kimyəvi elementlərinin dövri sisteminin ikinci dövrünün atom nömrəsi 5. Bor qara (kristal) və ya qəhvəyi (amorf) rəngli odadavamlı diamaqnit tozudur. istilik və elektrikin zəif keçiricisidir. Borun 10-dan çox allotropik modifikasiyası məlumdur. İlk dəfə 1808-ci ildə fransız fizikləri J. Gay-Lussac və L. Thénard tərəfindən bor anhidridi B2O3-ü kalium metalı ilə qızdırmaqla əldə edilmişdir. Bir neçə aydan sonra bor H. Davy tərəfindən ərimiş B2O3-ün elektrolizi yolu ilə əldə edilmişdir. Həddindən artıq sərt maddə (almaz, karbon nitridi, bor nitridi (borazon), bor karbid, bor-karbon-silikon ərintisi, skandium-titan karbidindən sonra ikinci). Təbiətdə bor iki izotop 10 B (20%) və 11 B (80%) şəklində olur.
10 V istilik neytronları üçün çox yüksək udma kəsiyinə malikdir, buna görə də reaktivliyə nəzarət etmək üçün nüvə reaktorlarında bor turşusunda 10 V istifadə olunur.
Kimyəvi xassələri.
Bir çox fiziki və kimyəvi xüsusiyyətlərə görə qeyri-metal bor silikona bənzəyir.
Kimyəvi cəhətdən bor olduqca təsirsizdir və otaq temperaturunda yalnız flüorla qarşılıqlı təsir göstərir:
Qızdırıldıqda bor digər halogenlərlə reaksiyaya girərək trihalidlər əmələ gətirir, azotla bor nitridi BN, fosforla - fosfid BP, karbonla - müxtəlif tərkibli karbidlər (B4C, B12C3, B13C2) əmələ gətirir. Oksigen atmosferində və ya havada qızdırıldıqda bor, B2O3 oksidini əmələ gətirərək böyük bir istilik buraxaraq yanır:
Bor hidrogenlə birbaşa qarşılıqlı təsir göstərmir, baxmayaraq ki, qələvi və ya qələvi torpaq metallarının boridlərini turşu ilə müalicə etməklə əldə edilən kifayət qədər çox sayda müxtəlif tərkibli borhidridlər (boranlar) məlumdur:
Güclü qızdırıldıqda, bor bərpaedici xüsusiyyətlər nümayiş etdirir. Məsələn, silikon və ya fosforu oksidlərindən azaltmağa qadirdir:
Borun bu xassəsini bor oksidi B2O3-də kimyəvi bağların çox yüksək möhkəmliyi ilə izah etmək olar.
Oksidləşdirici maddələr olmadıqda, bor qələvi məhlullara davamlıdır. Qaynar azot və sulfat turşularında və su regiyində bor bor turşusu əmələ gətirmək üçün əriyir.
Bor oksidi tipik bir turşu oksididir. Bor turşusu yaratmaq üçün su ilə reaksiya verir:
Bor turşusu qələvilərlə qarşılıqlı əlaqədə olduqda, duzlar bor turşusunun özündən deyil - boratlar (BO3 3− anionu olan) deyil, tetraboratlar əmələ gəlir, məsələn:
Qəbz.
Metal boridlərlə çox çirklənmiş amorf bor oksidin və ya susuzlaşdırılmış boranın metalotermik reduksiyasından əldə edilir:
B 2 0 3 + 3Mg = 2B + 3MgO
1150 °C-ə qədər qızdırılan tantal məftildə uçucu bor birləşmələrinin hidrogenlə reduksiyası nəticəsində daha təmiz məhsul əmələ gəlir:
2BBr 3 + ZN 2 = 2B + 6HBr və ya onların termal parçalanması zamanı:
2BI 3 +2H 2 = 2B + 3I 2
Bor birləşmələri.
Bor sulfid (B2S3) bor kükürd buxarında qızdırıldıqda rəngsiz şüşəvari kütlə şəklində əmələ gəlir. Su ilə tamamilə borik turşusu və H2 S-ə parçalanır.
Bor azotla yalnız 1200 °C-dən yuxarı birləşir. Bor nitridi (BN) yalnız təxminən 3000 °C-də (təzyiq altında) əriyən ağ tozdur. BN-nin kristal quruluşu qrafitə bənzəyir.
Bor karbid (B4C) bor (və ya B2 O3) və kömür qarışığı elektrik sobasında qızdırıldıqda qara parlaq kristallar şəklində əmələ gəlir. O, odadavamlılığı (mp 2550 °C) və həddindən artıq sərtliyi (almazın sərtliyinə yaxın) ilə fərqlənir. Həm bor nitridi, həm də karbid müxtəlif kimyəvi təsirlərə qarşı böyük müqaviməti ilə xarakterizə olunur.
BOR NİTRİD, BN, kristal, üç modifikasiyaya malikdir: altıbucaqlı a-BN, kubik b-BN (borazon) və rombedral g-BN.
Altıbucaqlı bor nitridi alfa-BN.
a-BN-nin kristal quruluşu, qrafitin strukturundan fərqli olaraq, bir-birinin ardınca bir-birinin altında, bir-birini əvəz edən bor və azot atomları olan qrafitebənzər şəbəkələrdən ibarətdir. 2000 °C-dən yuxarı temperaturda elementlərdən ağ, talka bənzər a-BN tozu alınır. Bor nitridi ammonyak atmosferində borun (və ya B2O3) kalsifikasiyası və ya B2O3 qarışığının ammonyak atmosferində reduksiyaedici maddələrlə (kömür, maqnezium) qızdırılması ilə də əldə edilə bilər. Yağlama xüsusiyyətlərinə görə a-BN qrafitdən üstündür. Sıxılmış vəziyyətdə bor nitridi yarımkeçirici xüsusiyyətlərə malikdir və az miqdarda çirklərin mövcudluğunda lüminesans xüsusiyyətlərə malikdir. Bor nitridi otaq temperaturunda kimyəvi cəhətdən təsirsizdir və oksigen və ya xlor, turşular və ya qələvilərlə reaksiya vermir. 700 °C-dən yuxarı temperaturda oksigen və xlor ona təsir etməyə başlayır. Flüor (BF3 və N2 əmələ gətirir) və HF (NH4BF4 əmələ gətirir) ilə reaksiya verir; isti qələvi məhlulları onu parçalayaraq NH3-ü buraxır.
1000°C-dən yuxarı temperaturda elementlərə parçalanmağa başlayır.
Beta-BN-nin (borazonun) almaza bənzər forması.
62 min atm-dən yuxarı təzyiqlərdə və 1350 °C-dən yuxarı temperaturda qrafitşəkilli altıbucaqlı b-BN modifikasiyasının kub almaz kimi b-BN strukturuna polimorfik çevrilməsi baş verir. Qələvi və qələvi torpaq metalları belə bir transformasiya üçün yaxşı katalizatorlardır. Qrafit-almaz keçidi vəziyyətində olduğu kimi, polimorf çevrilmə bor nitridin xassələrinin kəskin dəyişməsi ilə müşayiət olunur.
Yüksək təzyiqlərdə allotropik keçid BN (hex.) - BN (kub.) vasitəsilə əldə edilən borazon kristalları çoxüzlü, adətən tetraedr və ya oktaedr formasına malikdir. Onlar şəffafdır və rəngləri çirklərin mövcudluğundan və növündən asılıdır. Yaranan borazon kristallarının ölçüsü prosesin təzyiqindən və temperaturundan asılıdır. Reaksiya qarışığında borun artıq olması nəticəsində yaranan borazon kristallarına qəhvəyi və ya qara rəng, berilyum mavi, kükürd isə sarı rəng verdi.
Mohs şkalası ilə qiymətləndirildikdə, onun sərtliyi almazın sərtliyinə (təxminən 10 bal) mütənasibdir, lakin borazon istilik müqavimətində (2000 ° C-ə qədər) və təsir gücündə almazdan çox üstündür.
Borazonun kimyəvi müqaviməti bor nitridin adi formasından əhəmiyyətli dərəcədə yüksəkdir.
Rombedral qamma-BN.
Bor nitridin hazırlanmasında natrium boratın kalium sianidlə qarşılıqlı təsiri nəticəsində altıbucaqlı modifikasiya ilə yanaşı g-BN-nin rombedral modifikasiyası aşkar edilmişdir.
Bor nitridi və ona əsaslanan materiallar ən mühüm instrumental materiallar arasında görkəmli yer tutur və bir çox müasir texnologiyaların əsasını təşkil edir. Sənaye üzvi sintez reaksiyalarında və neftin krekinqində, yüksək temperatur texnologiyası məhsullarında, yarımkeçiricilərin istehsalında, yüksək təmiz metalların, qaz dielektriklərinin istehsalında və yanğınsöndürmə vasitəsi kimi geniş tətbiq tapmışdır. Həm yarımkeçirici, həm də dielektrik xüsusiyyətləri nümayiş etdirən yüksək odadavamlı materiallar bor nitriddən hazırlanır.
Borazonun alətlərdə geniş yayılmasının əsası onun ən böyük sərtliyi, almazın sərtliyinə yaxınlaşması idi. Borazon yüksək temperatur texnologiyasında istifadə olunan məhsulların hazırlanması üçün istifadə olunur (tiçələr, izolyatorlar, yarımkeçirici kristalların istehsalı üçün tigelər, elektrik vakuum cihazlarının hissələri); yarımkeçirici cihazların və inteqral sxemlərin (bor çirkinin bərk cisimli planar mənbələri, kondansatörlərin dielektrik contaları), elektrik vakuum cihazlarının hissələrinin (enerji çıxışları üçün pəncərələr, istilik qəbuledici çubuqlar) istehsalı üçün istifadə olunur.
Halidlər bor strukturuna və xassələrinə görə 13-cü qrupun digər elementlərinin halidlərindən əhəmiyyətli dərəcədə fərqlənir.
Dörd yüksək bor halogenidləri məlumdur. Onların hamısı müntəzəm üçbucaq formasına malik olan, mərkəzində sp2 hibridləşmə vəziyyətində bir bor atomu olan BX 3 molekullarından ibarətdir. B-X istiqrazları tək siqma istiqrazı üçün hesablananlardan daha qısa olur.
Halojen atomlarının ölçüsü artdıqca, B-X bağlarının gücü və BX 3 molekullarının sabitliyi azalır.

Ftoriddən yodidə qədər bor halogenidləri seriyasında molekullararası qarşılıqlı təsirlər güclənir, bunun nəticəsində ərimə və qaynama nöqtələri artır (bax Cədvəl 4.4). Normal şəraitdə BF 3 və BC1 3 qaz, BBg 3 maye, BI 3 isə uçucu bərk maddədir.
Trifluoride BF 3 boratların flüorlaşdırılması ilə əldə edilir:
6CaF 2 + Na 2 B 4 0 7 + 8H 2 S0 4 (konk.) = 4BF 3 t + 2NaHS0 4 + 6CaS0 4 + 7H 2 0
bor turşusu və ya onun anhidridi:
B 2 0 3 + 6NaBF 4 + 3H 2 S0 4 (konk.) = 8BF 3 + 3Na 2 S0 4 + 3H 2 0
a BCl 3 və BBr 3 - bor oksidi və karbon qara qarışığının birbaşa sintezi, halogenləşdirilməsi ilə:
700 °C
В 2 0 3 + ЗС + ЗС1 2 (Br 2) = ЗСО + 2ВС1 3 (ВВг 3)
və ya bor trifluoridi alüminium halid üzərindən keçirərək:
A1Br 3 + BF 3 = BBr 3 + A1F 3
Triiodide BI 3, -78 ° C-də litium borhidrid LiBH 4-ün yod ilə qarşılıqlı təsiri nəticəsində əmələ gəlir:
LiBH 4 + 4I 2 = BI 3 + 4HI + LiI
Bor trihalidləri güclü Lyuis turşularıdır (elektron qəbulediciləri) və elektron donor molekulları, yəni Lyuis əsasları ilə asanlıqla qarşılıqlı əlaqədə olurlar:
BF 3 + NH 3 = F 3 B:NH 3
BF 3 + 0(C 2 H 5) 2 =F 3 B:0(C 2 H 5) 2
bu zaman orbitalların sp2 hibridləşməsi sp3 hibridləşməsinə çevrilir, yastı molekul piramidal konfiqurasiya əldə edir və bor atomunun koordinasiya nömrəsi dördə qədər artır.
BX 3 birləşmələrinin turşuluğu onların hidrolizə meylində də özünü göstərir. Xlorid, bromid və yodid nəmli havada tüstülənir və su ilə dərhal parçalanır:
BX 3 + 3H 2 O = H 3 B0 3 + ZNX (X = Cl, Br, I)
Flüor su ilə yavaş-yavaş reaksiya verir:
4BF 3 + ZN 2 0 = N 3 B0 3 + 3HBF 4
BF 3 buzlu sudan keçirildikdə, BF 3 hidrat buraxıla bilər. 2H 2 0, ion quruluşuna malikdir: H 3 0 + -.
Tetraflorobor turşusu HBF 4 BF 3-ün hidrolizi zamanı əmələ gələn hidrofluorik turşudan (pKa -0,2-yə bərabərdir) çox güclüdür və onun kimi zəhərlidir. Yalnız bor turşusunun 40% HF məhlulunda həll edilməsi ilə hazırlanan məhlullarda mövcuddur:
H 3 B0 3 + 4HF = HBF 4 + ZN 2 0
Tetraflorobor turşusunun məhlullarını neytrallaşdırmaqla onun duzları, tetrafloroboratlar alınır. Onlar turşudan daha sabitdir və parçalanmadan əriyir. Boranın flüorlaşdırılması ilə Na əldə etmək rahatdır:
14HF + Na 2 B 4 0 7 + 2NaF = 4NaBF 4 + 7H 2 O
Qələvi metal tetrafloroboratların təzə hazırlanmış məhlulları neytral mühitə malikdir, lakin saxlama zamanı zəif hidroliz səbəbindən tədricən qələvi olurlar.
HBF 4 turşusu və onun duzları korroziyaya qarşı örtüklərin komponentləri kimi, qoruyucu metal filmlərin tətbiqi üçün, ion dəyişdirici və ion seçici membranların istehsalında, metallurgiyada Al - B ərintilərinin və paslanmayan polad istehsalı üçün istifadə olunur. . Bəzi tetrafloroboratlar üzvi reaksiyalar üçün katalizator kimi aktivdir.
Borazol.
Borazol (borazin, triborin triimid) rəngsiz maye olan B3H6N3 kimyəvi formulu olan kimyəvi maddədir. Molekul, bor və azot atomlarının bir-birini əvəz etdiyi, hər biri bir hidrogen atomuna bağlı olan altı üzvlü düz halqadır.
Benzolun qeyri-üzvi analoqu olmaqla, borazol fiziki xassələrinə görə benzola bənzəyir (aqreqasiya vəziyyəti, qaynama diapazonu, sıxlıq və s.); eyni zamanda borazol və benzolun kimyəvi xassələri kəskin şəkildə fərqlənir.
Borazolun reaktivliyi bağların polaritesinə görə benzoldan daha yüksəkdir (üç azot atomu bor atomlarının sərbəst orbitallarına tək elektron cütlərini verir). Beləliklə, o, havada oksidləşir, suda həll olur, onunla tədricən reaksiyaya girərək B(OH)3, NH3 və H2 əmələ gətirir və benzoldan daha az istilik dayanıqlıdır.
B atomlarına bağlanmış H atomları halqanı pozmadan dəyişdirilə bilər. Beləliklə, BCl3 və ya BBr3 qızdırıldıqda borazola təsir etdikdə bərk sabit birləşmələr - trihaloborazollar B3N3H3Hal3 əmələ gəlir.
N-dəki H atomları əvəzetmə reaksiyalarına gedə bilməz.
Qəbz.
Borazol litium tetrahidroborat və ammonium xlorid qızdırılaraq hazırlana bilər:
Diboranın ammonyak ilə reaksiyasına görə, qızdırıldıqda da həyata keçirilir:
Bor trixloridin ammonium xlorid ilə reaksiyası. Reaksiya iki mərhələdə baş verir:
Borazol BN almaq üçün istifadə olunur, onun org. törəmələri - istiliyədavamlı polimerlərin sintezi üçün. Məsələn, N-trifenilborazolun pirolizi [-(C6H5)3N3B3H-] 23 tərkibli polimeri əmələ gətirir ki, orada borazol halqaları bor atomları vasitəsilə bağlanır.
28. Diboranın alınması, quruluşu, xassələri (üç mərkəzli iki elektron rabitəsi). Bor hidridlərinin homoloji sıraları: B n H n+4 və B n H n+6. Metal boridlər.
Bor hidridləri (və ya boranlar)- kimyəvi bağların təşkili üçün xüsusi struktur prinsipləri, mürəkkəb stoxiometriya və müxtəlif kimyəvi reaksiyalara malik qeyri-üzvi birləşmələrin ən qeyri-adi siniflərindən biridir.
Boranlar zəhərli, qeyri-sabit molekulyar birləşmələrdir, son dərəcə xoşagəlməz qoxuya malikdir, üzvi həlledicilərdə yüksək dərəcədə həll olunur. Artan molekulyar çəki ilə onların ərimə və qaynama nöqtələri artır: otaq temperaturunda diboran B 2 H 6 qazdır, pentaboran B 5 H 9 maye, dekaboran B 10 H 14 isə bərkdir. Borlar kimyəvi cəhətdən aktivdir, havada asanlıqla oksidləşir və su ilə parçalanır.
Monoborane VN 3 qeyri-sabitdir. Üç B-H bağının və dörd orbitalın mövcudluğuna görə, BH 3-də bor atomu koordinativ olaraq doymamışdır və BH 3 molekulu güclü molekulyar birləşmələr əmələ gətirərək, məsələn, ammonyak molekulu kimi tək elektron cütləri olan molekulları və ya ionları asanlıqla birləşdirir:
H 3 B + NH 3 = H 3 B: NH 3
Monoborane BN 3 maye azot temperaturunda belə birləşmələrin buxarlarının kondensasiyası ilə təcrid olunur.
Bor hidridləri arasında xüsusi yeri bütün digər borların istehsalı üçün başlanğıc material olan diboran B 2 H 6 tutur. Qızdırıldıqda (175 ° C) natrium hidridlə bor birləşmələrinin reduksiyası ilə sintez olunur:
2BF 3 (g) + 6NaH (sol) = B 2 H 6 (g) + 6NaF (sol) və ya litium alüminium hidrid efir məhlulunda:
4ВС1 3 + 3LiAlH 4 = 2B 2 H 6 + 3LiCl + ЗА1С1 3
Diboran molekulu BH 3-ün iki fraqmentindən qurulmuşdur (Şəkil 4.3, A) elə bir şəkildə ki, iki B atomu və onları birləşdirən iki körpü H atomu eyni müstəvidə (şəklin müstəvisi) və dörd terminal H atomu (hər B atomu üçün iki) perpendikulyar müstəvidə yerləşir. Bor atomları arasında kimyəvi bağ yoxdur. Hər bir B atomunun üç valent elektronu vardır ki, onlardan ikisi son H atomları ilə adi iki mərkəzli iki elektronlu rabitələrin yaranmasında iştirak edir.Beləliklə, hər BH 2 qrupu BH 3 fraqmentində birləşmə üçün yalnız bir elektron təmin edə bilər. Aydındır ki, iki körpü H atomu ilə oxşar bağlar yaratmaq üçün kifayət qədər valentlik elektronları yoxdur - boranlar elektron çatışmazlığı olan birləşmələrdir.
Belə bağları təsvir etmək üçün üç mərkəzli iki elektronlu B-H-B rabitəsinin sxemi təklif edilmişdir (şək. 4.3, b). Molekulyar orbital üsulda borun iki atom orbitalının ѱ(B 1) və ѱ(B 2) hidrogen orbitalı ѱ(H) ilə qarışdırılması üç MO-nun əmələ gəlməsinə gətirib çıxarır: bağlanma ѱ 1, bağlanmayan ѱ 2 və antibond ѱ 3. Bir cüt elektron (biri B atomundan, ikincisi H atomundan) boranlarda sabit körpülü üç mərkəzli iki elektronlu B-H-B rabitəsi yaradaraq MO bağını tutur (Şəkil 4.3, V).

Daha yüksək boranlar.
Daha yüksək boranlar rəngsiz, qeyri-sabit molekulyar birləşmələrdir, onların qaynama nöqtələri oxşar molekulyar çəkiyə malik karbohidrogenlərin qaynama nöqtələrinə yaxındır. Quruluşuna və tərkibinə görə onlar bir neçə növə bölünür. Closo-boranes [B n H n ] 2-, və = 6 - 12 (yunan dilindən - qəfəsdən), anion qruplarıdır); neytral molekullar B n H i + 2 hələ əldə edilməmişdir. Nido-boranlar (latınca nidus - yuva) bir tərəfdən açıq, neytral, məsələn B 5 H 9, B 10 H 14 və ya ümumi tərkibli B n H n + 4 anion polihedralarını ehtiva edir, bunlara diboran B 2 daxildir. N 6. Araxno-boranlar (yunan dilindən - şəbəkə) iki sərbəst təpəsi olan çoxüzlülərdir. Onlar B n H n+6 düsturuna uyğun açıq klasterlərdən ibarətdir, məsələn, B 4 H 10, B 5 H 11, B 8 H 14. Hypho-borans (yunan dilindən - şəbəkə) sərbəst təpələrin sayı üç olan ən açıq qrupları ehtiva edir: B n H n+8, məsələn, B 8 H 16, B 10 H 18. Ən mürəkkəb quruluşa yuxarıda sadalanan növlərin bir-biri ilə əlaqəli fraqmentlərindən ibarət konyunkto-boranlar (latınca konyunktodan - bir-birinə qoşulmaq) malikdir.
Boranlar yüksək reaktiv birləşmələrdir, onların aktivliyi artan molekulyar çəki ilə zəifləyir və molekulların quruluşundan asılıdır. Klozoboranların yüksək kimyəvi sabitliyi elektronların güclü delokalizasiyası ilə izah olunur.
Tetrahidroboratlar tipik azaldıcı maddələrdir. Onların arasında ən sabit olanı MVN 4 qələvi metal duzlarıdır. Onlar bərk natrium hidridi bor halidləri və ya bor turşusu esterləri ilə reaksiyaya salmaqla hazırlanır:
4NaH + BCl3 = NaBH 4 + 3NaCl
B(OCH 3) 3 + 4NaH = NaBH 4 + 3NaOCH 3
Tetrahidroboratlar* suda, maye ammonyakda, aminlərdə, litium borhidrid isə efirdə həll olan rəngsiz kristal maddələrdir. LiBH 4 380 °C-dən yuxarı istilikdə parçalanır, qalanları 580 °C-ə qədər istiləşməyə davam edə bilər. NaBH 4 mülayim reduksiyaedicidir. Bu, 505 °C-də parçalanmadan əriyən ion birləşməsidir. Qələvi mühitdə kükürd dioksidi ilə qarşılıqlı əlaqədə olduqda güclü ağartma agenti - natrium ditionit Na 2 S 2 0 4 əmələ gətirdiyinə görə kağız pulpasını ağartmaq üçün sellüloz və kağız sənayesində istifadə olunur:
Na + 8NaOH + 8S0 2 = 4Na 2 S 2 0 4 + NaB0 2 + 6H 2 0
Qələvi tetrahidroboratlar metal örtüklər və elektron cihazlarda kontaktlar üçün istifadə olunur.
Konsentratlaşdırılmış sulfat turşusu borhidridləri parçalayır:
2Na + 2H 2 S0 4 = 2NaHS0 4 + B 2 H 6 + 2H 2
Reaksiya o qədər güclü gedir ki, reaksiya qarışığı tez-tez alovlanır.
Borların xlorlanması B-B bağının parçalanmasına səbəb olur:
B 2 H 6 + 6C1 2 = 2BC1 3 + 6HC1
və ammonyak ilə qarşılıqlı təsir siklik trimerlərin əmələ gəlməsinə səbəb olur: borazin (HNBH) 3 və ya borazol (BNH) 3.
Diboran havada çox alovlanır:
B 2 N 6 + zo 2 \u003d 2 o 3 + zn 2 o
və hava çıxışı olmadan qızdırıldıqda, daha yüksək boranların qarışığına parçalanır. Parçalanma qeyri-sabit ara məhsullar BH 3, B 3 H 7 və s. vasitəsilə baş verir (buruq mötərizədə göstərilir):
B 2 H 6 = 2 (BH 3)
(VN 3) + B 2 H 6 = (B 3 H 7) + H 2
(VN 3) + V 3 N 7 = V4H10
B 4 H 10 + (VN 3) = B 5 H 11 + N 2
Sonrakı mərhələlərdə polimer (BH) X ilə birlikdə B 5 H 9, B 6 H |0, B 6 H 12 və ən stabil məhsul olan B 10 H 14 boranlar əmələ gəlir.
Metal boridlərin quruluşu və xassələri.
Bor metallarla qarşılıqlı əlaqədə olduqda, borun formal olaraq mənfi oksidləşmə vəziyyətini nümayiş etdirdiyi müxtəlif boridlər əmələ gəlir.
Yüksək metal tərkibli boridlərdə bor atomları təcrid olunur və əsasən metal atomlarının triqonal prizmalarının mərkəzlərində yerləşir.
Boridlərdə Cr 5 IN 3 onlar 3 IN 2 (M = V, Nb, Ta) təcrid olunmuş B-B cütləri mövcuddur. MB boridləri (M = Ti, Hf, V, Cr, Mo, Mn, Fe, Ni) bor atomlarının təcrid olunmuş zəncirlərindən əmələ gəlir. Boridlərin strukturlarında M 3 IN 4 ((M = V, Nb, Cr, Mn) bor atomlarının qoşa zəncirləri aşkar edilmişdir.
Borides MV 2 (M = Mg, A1) və M 2 IN 5 (M = Ni, Mo, W) ikiölçülü təbəqələrdən və LaB tipli boridlərdən əmələ gəlir. 6 - bor atomlarının üçölçülü çərçivələri.
Tərkibində yüksək bor olan (MB 4, MB 12) boridlərin strukturlarında ikosaedranın üçölçülü fraqmentləri qorunub saxlanılır. , metal atomlarının yerləşdiyi boşluqlarda.
Müxtəlif boridləri təşkil edən atomların ölçülərində böyük fərqlərə baxmayaraq, atomlararası B-B məsafələri demək olar ki, sabitdir və güclü B-B bağları ilə müəyyən edilir.
Boridlər ərimə nöqtəsi və elektrik keçiriciliyi ilə olduqca sərt, kimyəvi cəhətdən təsirsiz, odadavamlı materiallardır ki, bu da çox vaxt ana metalların keçiriciliyini üstələyir. Məsələn, sirkonium diborid ZrB 2 3000 ° C-dən yuxarı əriyir, sirkoniumun ərimə nöqtəsi isə 1670 ° C-dir. TiB 2 boridinin elektrik keçiriciliyi titandan beş dəfə yüksəkdir. Bor karbidinin B 4 C sərtliyi silisium karbidinin sərtliyindən daha yüksəkdir və almazın sərtliyinə yaxınlaşır.
Metal boridlər yüksək temperaturlu reaktorlar, reaktiv mühərriklər və qaz turbinlərinin bıçaqları üçün qoruyucu örtüklər yaratmaq üçün istifadə olunur. 10 V izotopu ilə termal neytronların tutulmasının səmərəliliyi digər nüvələrdən daha yüksəkdir. Buna görə bor boridləri və karbidləri nüvə reaktorlarında idarəetmə çubuqları üçün material kimi xidmət edir. 2000-ci ildə yapon tədqiqatçıları kritik temperatura malik maqnezium diborid MgB 2 əsasında yeni superkeçiricilər kəşf etdilər. t c =-233 °C. Liflər şəklində bor karbid müxtəlif materialları gücləndirmək üçün istifadə olunur. Belə liflər BC1 3 + H 2 qarışığının karbon lifləri ilə 1630 ° C-də reaksiya verməsi ilə əldə edilir:
4ВС1 3 + 6Н 2 + С = В 4 С + 12НС1
Metal boridlər B 2 O 3 qarışığının metal oksidləri ilə karbonla 2000 ° C-də azaldılması ilə sintez olunur:
V 2 O s + B 2 O 3 + 8С = 2VB + 8СО
sadə maddələrin qarşılıqlı təsiri, həmçinin uçucu metal halidləri və borun hidrogenlə qarışıqlarının azaldılması:
TiCl 4 + 2ВС1 3 + 5Н 2 = TiB 2 + 10HC1
Aktiv metalların bəzi boridləri (MgB 2, A1B 2) su ilə parçalanır və müxtəlif borların qarışığı əmələ gətirir. Boridlərin əksəriyyəti (A1B 12, CaB 6, ZrB 2 və s.) su ilə parçalanmır.
29. Borun oksigen birləşmələri. Bor (III) oksidi. Bor turşuları, onların duzları: meta-, tetra-, ortoboratlar. Boranın alınması, quruluşu, hidrolizi. Bor turşusuna boraksın işlənməsi.
13-cü qrupun bütün elementləri +3 ən yüksək oksidləşmə vəziyyətində oksidlərin və onların törəmələrinin əmələ gəlməsi ilə xarakterizə olunur. Oksidləşmə vəziyyəti +1 olan birləşmələr tallium üçün sabitdir
Bor oksigen birləşmələri
Borun ən vacib oksigen birləşmələrinə bor oksidi B 2 0 3, bor turşuları və onların duzları - boratlar daxildir.
Bor oksidi B 2 0 3 .
Borun oksigenlə oksidləşməsi nəticəsində əldə edilir:
4B + 3O 2 = 2B 2 O 3 və ya ərimiş H 3 VO 3-ün hərtərəfli susuzlaşdırılması ilə:
2H 3 VO 3 = B 2 O 3 + ZN 2 O
Kristal B 2 O 3 (tPL = 577 °C, t bp = 1860 °C) ümumi təpələrlə birləşdirilən BO3 düz üçbucaqlarından üçölçülü quruluşa çevrilir. Melt B 2 O 3 həddindən artıq soyumağa meyllidir. Ondan əmələ gələn şüşəvari kütlə dövrlərə bağlanmış qismən düzülmüş BO 3 üçbucaqlarından ibarətdir. Bir çox metalın oksidləri rəngli şüşələr (məsələn, CoO ilə mavi) əldə etmək üçün istifadə olunan ərimiş B 2 O 3-də asanlıqla həll olunur, həmçinin metalların səthini oksidlərindən təmizləmək üçün lehimləmə zamanı. Borat şüşələri tez-tez məhsulların səthini oksidləşmədən qoruyan təbəqələr və örtüklər kimi istifadə olunur. 1450 °C-dən yuxarı qızdırıldıqda bor oksidi monomerik molekullar şəklində buxarlanır. B 2 0 3-ün uçuculuğu uçucu metabolik turşunun əmələ gəlməsi səbəbindən su buxarının mövcudluğunda əhəmiyyətli dərəcədə artır:
B 2 O 3 (bərk) + H 2 O (q) = 2HVO 2 (q)
Yüksək temperaturda B 2 O 3 qələvi metallar, maqnezium, alüminium və karbon tərəfindən bora çevrilir.
Amorf B 2 Oz nəzərəçarpacaq dərəcədə istiliklə suda həll olunur ( N° = = -76,3 kJ/mol), bor turşularının qarışığına çevrilir.
Ortoborik (bor) turşusu B(OH) 3 (H 3 VO 3). Bu, həll olunan bor birləşmələrinin, məsələn, borax Na 2 8H 2 0 hidrolizinin son məhsuludur:
Na 2 8H 2 0 + H 2 S0 4 = 4B(OH) 3 + Na 2 S0 4 + 5H 2 0
Bor turşusu toxunduqda yağlı olan pulcuqlu kristallardır, onların strukturunda (şək. 4.9, a) B(OH) 3 molekulları hidrogen bağları hesabına -OH... O. Ayrı-ayrı təbəqələr bir-biri ilə zəif molekullararası bağlarla bağlıdır və bir-birindən xeyli məsafədə yerləşir.
H 3 BO 3 suda həll olunur (20 ° C-də 100 q suda 4,3 q) və zəif bir əsaslı turşudur. Adi turşulardan fərqli olaraq, onun turşu xassələri hidrogen ionunun aradan qaldırılması ilə deyil, Lyuis əsası kimi çıxış edən su molekulunun hidroksil qrupunun əlavə edilməsi ilə bağlıdır:
B(OH) 3 + H-OH = [B(OH) 4 - + H +, s K a 9,25 (25 °C)
H 3 B0 3-ün turşu xassələri, konsentratlaşdırılmış H 2 S0 4 (su çıxaran bir vasitə kimi) spirtlərlə birlikdə efirlər əmələ gətirməsi ilə özünü göstərir:
B(OH) 3 + ZCH 3 OH = (CH 3 O) 3 B + ZN 2 O
Molekulun daxilində B-O kovalent bağının yüksək gücünə və əksinə, zəif molekullararası qarşılıqlı təsirə görə bu efirlər uçucudur. Onların buxarları havada alovlandıqda yaşıl alovla yanır. Bu reaksiya bor birləşmələrinin keyfiyyətcə aşkarlanmasına xidmət edir.

100 °C-dən yuxarı qismən susuzlaşdırma ilə B(OH) 3 n-dən metabolik turşular (HBO 2) əmələ gəlir. Məsələn, trimetabor turşusunda (HBO 2) 3 (və ya B 3 O 3 (OH) 3), üç BO 3 qrupu Qapalı dövrlərdə oksigen atomları vasitəsilə birləşir:

hidrogen rabitəsi hesabına laylar əmələ gətirir (şək. 4.9, b).
Trimetabor turşusunda monomer B(OH) 3 ilə müqayisədə bor atomuna düşən -OH qruplarının sayı üç dəfə azalır. Körpü oksigen atomları elektron sıxlığının bir hissəsini B-OH bağlarından udur, H-O bağlarını daha qütblü edir və bununla da induktiv təsirə görə metabolik turşunun gücünü artırır.
Digər bor turşuları da sərbəst formada təcrid edilmişdir, məsələn tetrabor turşusu H 2 B 4 O 7 (pK a 1 4.1, pK a2 5.1). Onlar polikondensasiya prosesləri nəticəsində əmələ gəlir:
2B(OH) 3 + [B(OH) 4 - = [B 3 O 3 (OH) 4 - + 3H 2 O
2B(OH) 3 + 2[B(OH) 4 ] - = [B 4 O 5 (OH) 4 ] 2- + 5H 2 O
Boratlar. Bunlar borik turşularının duzlarıdır. B-O-B bağlarının və koordinasiya nömrələri 3 və 4 olan müxtəlif bor kombinasiyalarının yenidən təşkili asanlığına görə, üçbucaqlı BO 3 və tetraedral [B(OH) 4 ] qruplarını polinüvəli poliborat anionlarına birləşdirmək üçün çoxsaylı variantlar mövcuddur. Bu mənada boratlar silikatlar və fosfatlara bənzəyir.
Bəzi borat anionlarının quruluşu Şəkildə göstərilmişdir. 4.10. Anionun ümumi yükü hər biri bir mənfi yük daşıyan terminal oksigen atomlarının və tetraedral bor atomlarının sayı ilə müəyyən edilir. Monomer üçbucaqlı qruplar B0 3 (Şəkil 4.10, A) litium ortoboratda mövcuddur Li 3 B0 3, siklik qruplar B 3 O 6 3- (Şəkil 4.10, b) - natrium metaboratda 3.
Tetrahidr B(OH) 4 tetrahidroksoanionda mövcuddur (Şəkil 4.10, V), eləcə də Na 2 peroksoboratda. 6H 2 0, H 3 B0 3 ilə H 2 0 2 peroksidin qələvi mühitdə reaksiyası nəticəsində əldə edilir. Peroksoborat (ümumiyyətlə perborat kimi tanınır) yuyucu vasitələrin mühüm tərkib hissəsidir. Perboratın hidrolizi H 2 0 2 əmələ gətirir ki, bu da yumşaq ağardıcı kimi çıxış edir.
Cədvəl 19 - 3Ап/qrup elementlərinin xarakteristikası
Alüminium dövri sistemin III qrupunun əsas alt qrupundadır. Əsas vəziyyətdə olan alt qrup elementlərinin atomları xarici elektron qabığın aşağıdakı quruluşuna malikdir: ns 2 np 1. Atomların xarici enerji səviyyəsində atomların həyəcanlanmış vəziyyətə keçməsinə imkan verən sərbəst p-orbitalları var. Həyəcanlı vəziyyətdə bu elementlərin atomları üç kovalent rabitə yaradır və ya +3 oksidləşmə vəziyyətini nümayiş etdirərək üç valent elektrondan tamamilə imtina edir.
Alüminium yer üzündə ən çox yayılmış metaldır: yer qabığında onun kütlə payı 8,8% təşkil edir. Təbii alüminiumun əsas hissəsi alüminosilikatların bir hissəsidir - əsas komponentləri silikon və alüminium oksidləri olan maddələr. Alüminosilikatlar bir çox qayalarda və gillərdə olur.
Xüsusiyyətləri: Al gümüşü-ağ metaldır, əriyən və yüngül metaldır. Yüksək çevikliyə, yaxşı elektrik və istilik keçiriciliyinə malikdir. Al reaktiv metaldır. Bununla belə, onun normal şəraitdə fəaliyyəti metalın hava ilə təmasda olduğu zaman səthində əmələ gələn nazik oksid filminin olması səbəbindən bir qədər azalır.
1. Qeyri-metallarla qarşılıqlı əlaqə. Normal şəraitdə alüminium xlor və brom ilə reaksiya verir:
2Al + 3Cl 2 = 2AlCl 3
Qızdırıldıqda alüminium bir çox qeyri-metallarla reaksiya verir:
4Al + 3O 2 = 2Al 2 O 3
2Al + 3I 2 = 2AlI 3
2Al + N 2 = 2AlN
4Al + 3C = Al 4 C 3
2. Su ilə qarşılıqlı əlaqə. Səthdəki qoruyucu oksid filmi sayəsində alüminium suya davamlıdır. Lakin, bu film çıxarıldıqda, güclü bir qarşılıqlı təsir meydana gəlir:
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
2. Turşularla qarşılıqlı əlaqə. Alüminium xlorid və seyreltilmiş sulfat turşuları ilə reaksiya verir:
2Al + 6HCl = 2AlCl3 + 3H2
2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2
Nitrik və konsentratlı sulfat turşuları alüminiumu passivləşdirir: bu turşuların təsiri metal üzərində qoruyucu filmin qalınlığını artırır və o, həll olunmur.
4. Qələvilərlə qarşılıqlı təsir. Alüminium qələvi məhlullarla reaksiyaya girərək hidrogeni buraxır və kompleks duz əmələ gətirir:
2Al + 6NaOH + 6H 2 O = 2Na 3 + 3H 2
5. Metal oksidlərinin reduksiyası. Alüminium bir çox metal oksidləri üçün yaxşı reduksiyaedicidir:
2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
Alüminium oksidi və hidroksid. Alüminium oksidi və ya alüminium oksidi, Al 2 O 3 ağ tozdur. Alüminium oksidi metalın yandırılması və ya alüminium hidroksidinin kalsifikasiyası ilə əldə edilə bilər:
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
Alüminium oksidi suda praktiki olaraq həll olunmur. Bu oksidə uyğun olan hidroksid Al(OH) 3, ammonium hidroksid və ya çatışmazlıqda alınan qələvi məhlullarının alüminium duzlarının məhlullarına təsirindən əldə edilir:
AlCl 3 + 3NH 3 ∙ H 2 O = Al(OH) 3 ↓ + 3NH 4 Cl
Bu metalın oksidi və hidroksidi amfoterdir, yəni. həm əsas, həm də turşu xassələri nümayiş etdirir.
Əsas xüsusiyyətlər:
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O
2Al(OH) 3 + 3H 2 SO 4 = Al 2 (SO 4) 3 + 6H 2 O
Turşu xüsusiyyətləri:
Al 2 O 3 + 6KOH + 3H 2 O = 2K 3
2Al(OH) 3 + 6KOH = K 3
Al 2 O 3 + 2NaOH = 2NaAlO 2 + H 2 O
İstehsal. Alüminium elektrolitik üsulla istehsal olunur. Duzların sulu məhlullarından təcrid oluna bilməz, çünki çox aktiv metaldır. Buna görə də, alüminium metal istehsalının əsas sənaye üsulu alüminium oksidi və krioliti olan bir ərimənin elektrolizidir.
Ərizə. Alüminium metal sənayedə geniş istifadə olunur və istehsal həcminə görə dəmirdən sonra ikinci yeri tutur. Alüminiumun əsas hissəsi ərintilərin istehsalı üçün istifadə olunur:
Duralumin mis və az miqdarda maqnezium, manqan və digər komponentləri ehtiva edən alüminium ərintidir. Duraluminlər yüngül, davamlı və korroziyaya davamlı ərintilərdir. Təyyarə və maşınqayırmada istifadə olunur.
Magnalin alüminium və maqnezium ərintisidir. Təyyarə və maşınqayırmada, tikintidə istifadə olunur. Dəniz suyunda korroziyaya davamlıdır, buna görə də gəmiqayırmada istifadə olunur.
Silumin, tərkibində silisium olan alüminium ərintidir. Yaxşı tökmə. Bu ərinti avtomobil, təyyarə və maşınqayırmada, dəqiq alətlərin istehsalında istifadə olunur.
Alüminium çevik bir metaldır, ona görə də ondan nazik folqa hazırlanır, radiotexnika məhsullarının istehsalında və malların qablaşdırılmasında istifadə olunur. Tellər və gümüş boyalar alüminiumdan hazırlanır.
Peşəkar diqqəti olan tapşırıqlar
1. Yuyulduqdan sonra kök tərəvəzləri soymaq üçün soda külü (W = 4%) qaynar məhlulu ilə qaynadılır. Mədə şirəsində xlorid turşusu artıq olarsa, heyvanlara çörək soda məhlulu verilir. Bu maddələrin düsturlarını yazın. Natrium və kalium duzlarının kənd təsərrüfatı praktikasında və məişətdə tətbiqinin digər sahələrini adlandırın.
2. Kalium yodid heyvanları mikroelementlərlə qidalandırmaq və alma ağaclarında artıq çiçəkləri çıxarmaq üçün geniş istifadə olunur. Kalium yodidin əmələ gəlməsi reaksiyasının tənliyini yazın, oksidləşdirici və reduksiyaedicini göstərin.
3. Nə üçün odun külü (külün tərkibində K + kalium ionları və karbonat – CO 3 2- ionları var) tarlaları gübrələmək üçün istifadə olunur, qapalı yerlərdə və ya örtük altında saxlanılması tövsiyə olunur? Külü nəmləndirdikdə baş verən reaksiyaların tənliklərini yazın.
4. Torpaqda həddindən artıq turşuluq bitkiyə zərərli təsir göstərir. Bu vəziyyətdə torpağı əhəngləmək lazımdır. Torpağa CaCO 3 əhəng daşının əlavə edilməsi turşuluğu azaldır. Bu vəziyyətdə baş verən reaksiyanın tənliyini yazın.
5. Torpağın turşuluğu superfosfat əlavə edildikdə dəyişmir. Bununla belə, həddindən artıq fosfor turşusu olan superfosfatın turşuluğu bitkilər üçün zərərlidir. Onu zərərsizləşdirmək üçün CaCO 3 əlavə edilir. Ca(OH) 2 əlavə etmək mümkün deyil, çünki superfosfat bitkilər üçün çətin mənimsənilən bir birləşməyə çevriləcəkdir. Müvafiq reaksiyalar üçün tənlikləri yazın.
6. Taxıl, meyvə və tərəvəzlərin zərərvericiləri ilə mübarizə aparmaq üçün 1 m 3 otaq üçün 35 q nisbətində xlor istifadə olunur. Ərinmiş duzun elektrolizi nəticəsində əldə edilən xlorla 300 m 3 otağın təmizlənməsi üçün kifayət qədər natrium xlorid kütləsini hesablayın.
7. Kök bitkilərin və şəkər çuğundurunun zirvələrinin hər 100 sentneri üçün torpaqdan təxminən 70 kq kalium oksidi çıxarılır. Kütləvi payı 0,56 olan kalium xlorid olan silvinit KCl NaCl-in hansı kütləsi bu itkiləri kompensasiya edə bilər?
8. Kartofu qidalandırmaq üçün kütlə payı 0,04 olan kalium xlorid məhlulundan istifadə edin. Belə məhluldan 20 kq almaq üçün lazım olan kalium gübrəsinin (KCl) kütləsini hesablayın.
9. Bitkilərin qidalanması üçün qida məhlulu hazırlayarkən 400 ml suya 1 q KNO 3, 1 q MgSO 4, 1 q KN 2 PO 4, 1 q Ca(NO 3) 2 götürün. Nəticədə məhluldakı hər bir maddənin kütlə payını (%) hesablayın.
10. Yaş taxılı çürümədən qorumaq üçün onu natrium hidrogen sulfat NaHSO 4 ilə müalicə edir.
11. Hansı gübrənin tərkibində daha çox kalium var: kalium nitrat (KNO 3), kalium (K 2 CO 3) və ya kalium xlorid (KCl)?
12. Kalsium siyanamid mexaniki yığım zamanı pambığın yığımdan əvvəl defoliasiyası üçün istifadə olunur. Kalsiumun, karbonun və azotun kütlə paylarının müvafiq olaraq 0,5 olduğunu bilərək, bu birləşmənin düsturunu tapın; 0,15; 0,35.
13. Heyvandarlıqda heyvandarlıqda yem kimi istifadə olunan odun külü analiz edilərkən məlum olmuşdur ki, çəkisi 70 q olan külün tərkibində 18,4 q kalsium, 0,07 q fosfor və 2,3 q natrium vardır. Göstərilən gübrənin hər bir elementinin kütlə hissəsini (%) hesablayın.
14. Hər hektara 4 ton CaO nisbətində əhəngləmə aparılarsa, 30 hektara 90% kalsium karbonat olan əhəngdaşı tətbiq edilməlidir.
15. Bunlar var: a) təmiz ammonium nitrat, b) tərkibində 33% kalium olan texniki silvinit. Bu materialları qarışdırmaqla, tərkibində 15% azot olan bir ton azot-kalium gübrəsi almaq lazımdır. Hər iki material hansı miqdarda qarışdırılmalıdır və belə bir qarışıqda neçə faiz kalium olacaq?
4.9 Bölmə: Əsas keçid metalları
Məqsəd: Yan alt qrupların metallarının və onların birləşmələrinin xassələrini öyrənmək
Keçid metalları dövri cədvəlin ikinci dərəcəli alt qruplarının elementləridir.
Atom kütləsi artdıqca elementlərin metal xarakteri də artır. Bor qeyri-metaldır, qalan elementlər (alüminiumun alt qrupu) metallardır. Bor digər elementlərdən əhəmiyyətli dərəcədə fərqli xüsusiyyətlərə malikdir və daha çox karbon və silikona bənzəyir. Qalan elementlər aşağı əriyən metallardır, In və Tl olduqca yumşaqdır.
III qrupun əsas yarımqrupunun elementlərinin fiziki xassələri
Qrupun bütün elementləri üçvalentdir , lakin artan atom nömrəsi ilə valentlik 1 daha xarakterik olur(Tl əsasən monovalentdir).
B-Al-Ga-In-Tl seriyasında R(OH) 3 hidroksidlərinin turşuluğu azalır və əsaslığı artır. H 3 VO 3 turşu, Al(OH) 3 və Ga(OH) 3 amfoter əsaslar, In(OH) 3 və Tl(OH) 3 tipik əsaslardır. TlON güclü bazadır.
Yalnız iki elementin xassələrini nəzərdən keçirək: ətraflı - praktikada olduqca geniş istifadə olunan p-metalların tipik nümayəndəsi kimi alüminium və sxematik olaraq - "yarı metalların" nümayəndəsi kimi və müqayisədə anomal xüsusiyyətlər nümayiş etdirən bor. alt qrupun bütün digər elementləri ilə.
Alüminium Yer kürəsində ən çox yayılmış metaldır (bütün elementlər arasında 3-cü yer; yer qabığının tərkibinin 8%-i). Təbiətdə sərbəst metal kimi baş vermir; alüminium oksidinin (Al 2 O 3), boksitin (Al 2 O 3 xH 2 O) bir hissəsidir. Bundan əlavə, alüminium gil, slyuda və feldispat kimi süxurlarda silikatlar şəklində olur.
Alüminiumun tək sabit izotopu var, borun ikisi var: 19,9% və 80,1%.
Qəbz;
1. AlCl 3 əriməsinin elektrolizi:
2AlCl 3 = 2Al + 3Cl 2
2. Əsas sənaye üsulu Al 2 O 3 (alüminium oksidi) əriməsinin 3NaF AlF 3 kriolitdə elektrolizidir:
2Al 2 O 3 = 4AI + 3O 2
3. Vakuum termal:
AlCl 3 + ZK = Al + 3KCl
Fiziki xassələri.
Alüminium sərbəst formada yüksək istilik və elektrik keçiriciliyinə malik gümüşü-ağ metaldır. Alüminium aşağı sıxlığa malikdir - dəmir və ya misdən təxminən üç dəfə azdır və eyni zamanda davamlı bir metaldır.
Bor bir neçə allotropik modifikasiyada mövcuddur. Amorf bor tünd qəhvəyi tozdur. Kristal bor boz-qaradır, metal parıltılıdır. Sərtliyə görə kristal bor bütün maddələr arasında ikinci (almazdan sonra) yeri tutur. Otaq temperaturunda bor elektrikin zəif keçiricisidir; silisium kimi yarımkeçirici xüsusiyyətlərə malikdir.
Kimyəvi xassələri.
Səthi alüminium adətən Al 2 O 3 oksidin davamlı bir filmi ilə örtülür, bu da onu ətraf mühitlə qarşılıqlı təsirdən qoruyur. Bu film çıxarılarsa, metal su ilə güclü reaksiya verə bilər:
2Al + 6H 2 O = 2Al(OH) 3 + ZH 2.
Talaş və ya toz şəklində havada parlaq şəkildə yanır, çox miqdarda istilik buraxır:
2Al + 3/2O 2 = Al 2 O 3 + 1676 kJ.
Bu hal alüminotermiya yolu ilə onların oksidlərindən bir sıra metallar almaq üçün istifadə olunur. Oksidlərin əmələ gəlmə istiliyi Al 2 O 3 əmələ gəlmə istiliyindən az olan metalların toz alüminium ilə reduksiyasına belə ad verilir, məsələn:
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3 + 539 kJ.
Bor, alüminiumdan fərqli olaraq, kimyəvi cəhətdən təsirsizdir (xüsusilə kristaldir). Beləliklə, oksigenlə yalnız çox yüksək temperaturda (> 700°C) bor anhidrid B 2 O 3 əmələ gəlməsi ilə reaksiya verir:
2B + ZO 2 = 2B 2 O 3,
Bor heç bir halda su ilə reaksiya vermir. Daha yüksək temperaturda (> 1200°C) azotla reaksiyaya girərək bor nitridi (oddavamlı materialların istehsalı üçün istifadə olunur) verir:
Bor otaq temperaturunda yalnız flüorla reaksiya verir, xlor və brom ilə reaksiyalar yalnız güclü qızdırma ilə baş verir (müvafiq olaraq 400 və 600 ° C); bütün bu hallarda, BHal 3 trihalidləri - havada dumanlanan və su ilə asanlıqla hidrolizə olunan uçucu mayelər əmələ gətirir:
2B + 3Hal 2 = 2BAl 3.
Hidroliz nəticəsində ortoborik (borik) turşusu H 3 BO 3 əmələ gəlir:
VNal 3 + 3H 2 O = H 3 VO 3 + ZNNAl.
Bordan fərqli olaraq, alüminium Artıq otaq temperaturunda bütün halogenlərlə aktiv şəkildə reaksiya verir, halogenidlər əmələ gətirir. Qızdırıldıqda kükürd (200 ° C), azot (800 ° C), fosfor (500 ° C) və karbon (2000 ° C) ilə reaksiya verir:
2Al + 3S = Al 2 S 3 (alüminium sulfid),
2Al + N 2 = 2AlN (alüminium nitridi),
Al + P = AlP (alüminium fosfid),
4Al + 3C = Al 4 C 3 (alüminium karbid).
Bütün bu birləşmələr alüminium hidroksid və müvafiq olaraq hidrogen sulfid, ammonyak, fosfin və metan yaratmaq üçün tamamilə hidrolizə olunur.
Alüminium istənilən konsentrasiyanın xlorid turşusunda asanlıqla həll olunur:
2Al + 6HCl = 2AlCl 3 + ZN 2.
Konsentratlaşdırılmış kükürd və azot turşularının soyuqda alüminiuma heç bir təsiri yoxdur. Qızdırıldıqda, alüminium hidrogen buraxmadan bu turşuları azalda bilir:
2Al + 6H 2 SO 4 (konk) = Al 2 (SO 4) 3 + 3SO 2 + 6H 2 O,
Al + 6HNO 3(conc) = Al(NO 3) 3 + 3NO 2 + 3H 2 O.
Alüminium seyreltilmiş sulfat turşusunda həll olunaraq hidrogeni buraxır:
2Al + 3H 2 SO 4 = Al 2 (SO 4) 3 + 3H 2.
Seyreltilmiş azot turşusunda reaksiya azot oksidinin (II) sərbəst buraxılması ilə davam edir:
Al + 4HNO 3 = Al(NO 3) 3 + NO + 2H 2 O.
Alüminium qələvilər və qələvi metal karbonatların məhlullarında həll olunaraq tetrahidroksialüminatlar əmələ gətirir:
2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2.
Oksidləşdirici maddələr olmayan turşular borla reaksiya vermir və yalnız konsentrasiya edilmiş HNO 3 onu bor turşusuna oksidləşdirir:
B + HNO 3 (konc) + H 2 O = H 3 VO 3 + NO
Oksidləşmə vəziyyəti +3 olan birləşmələr. Ən əhəmiyyətli bor birləşmələri hidridlər, halidlər, oksidlər, bor turşuları və onların duzlarıdır.
Bor oksidi- B 2 O 3 - rəngsiz, kövrək şüşəli bir kütlə, turşu oksidi, ortobor turşusu yaratmaq üçün güclü şəkildə su əlavə edir:
B 2 O 3 + 3H 2 O = 2H 3 BO 3
H 3 BO 3 çox zəif monoprotik turşudur və onun turşu xassələri hidrogen kationunun aradan qaldırılması ilə deyil, hidroksid anionunun bağlanması səbəbindən özünü göstərir:
H 3 BO 3 + H 2 OH + + - ; pK a = 9.0
Qızdırıldıqda, bor turşusu tədricən su itirir, əvvəlcə metabolik turşu, sonra isə bor oksidi əmələ gətirir:
H 3 BO 3 ¾® HBO 2 ¾® B 2 O 3
Qələvilərlə qarşılıqlı əlaqədə olduqda tetraboratlar - hipotetik tetrabor turşusunun duzları əmələ gətirir:
4H 3 BO 3 + 2NaOH = Na 2 B 4 O 7 + 7H 2 O
Duzların çoxu - boratlar - s-elementlərinin boratları istisna olmaqla, suda həll olunmur. Natrium tetraborat Na 2 B 4 O 7 digərlərindən daha çox istifadə olunur. Çox hissəsi üçün boratlar polimerdir və kristal hidratlar şəklində məhlullardan təcrid olunur. Polimer bor turşularını məhluldan təcrid etmək mümkün deyil, çünki onlar asanlıqla nəmlənirlər. Buna görə turşular poliboratlara təsir etdikdə adətən bor turşusu ayrılır ( bu reaksiya turşu istehsal etmək üçün istifadə olunur):
Na 2 B 4 O 7 + H 2 SO 4 + 5H 2 O = 4H 3 BO 3 + Na 2 SO 4
Susuz metaboratlar bor oksidi və ya bor turşusunu metal oksidləri ilə birləşdirərək hazırlanır:
CaO + B 2 O 3 = Ca(BO 2) 2
Ən əhəmiyyətli alüminium birləşmələri alüminium oksidi və alüminium hidroksiddir.
Alüminium oksidi Al2O3 ağ rəngli, odadavamlı kristal maddədir, suda həll olunmur. Laboratoriya şəraitində alüminium oksidi alüminiumun yandırılması və ya alüminium hidroksidinin termik parçalanması nəticəsində əldə edilir:
4Al + 3O2 → 2Al2O3
2Al (OH) 3 → Al2O3 + 3H2O.
Kimyəvi xassələrinə görə alüminium oksid amfoterdir. Əsas oksidlərin xüsusiyyətlərini nümayiş etdirən turşularla reaksiya verir:
Al2O3 + 6HCl = 2AlCl3 + 3H2O.
Qələvilərlə reaksiya verir, asidik oksidlərin xüsusiyyətlərini nümayiş etdirir. Qələvi məhlullarda mürəkkəb birləşmələr əmələ gəlir:
Al2O3 + 2KOH + 3H2O = 2K.
Birləşdikdə meta-alüminium turşusunun duzları əmələ gəlir, məsələn, kalium meta-alüminat:
Al2O3 + 2KOH→2KAlO2 + H2O.
Alüminium oksidin (korund) təbii kristal modifikasiyası istifadə olunur MÜXTƏLİF elm və istehsal sahələri. Məsələn, yaqutlar, dəqiq mexanizmlər üçün işləyən daşların istehsalı üçün bir materialdır. Korund kristalları lazerlərin iş mühitidir. Yaqut və sapfir zərgərlik məmulatlarını bitirmək üçün istifadə olunur. Alüminium oksid zümrüdün əsas komponentidir - aşındırıcı material. Alüminium oksidin odadavamlılığı və korroziyaya davamlılığı onun istiliyədavamlı kimyəvi şüşə məmulatlarının və şüşə sobaları üçün kərpiclərin istehsalı üçün istifadəsini əvvəlcədən müəyyənləşdirir.
Alüminium hidroksid Al (OH) 3 suda həll olunmayan ağ kristal maddədir. Alüminium hidroksid laboratoriyada istehsal olunur həll olunan alüminium duzlarından qələvi məhlullarla qarşılıqlı əlaqədə olduqda, məsələn:
AlCl3 + 3KOH = Al (OH) 3 ↓+ 3KCl.
Yaranan alüminium hidroksid jelatinli çöküntü görünüşünə malikdir.
Alüminium hidroksid amfoter xüsusiyyətlərə malikdir və həm turşularda, həm də qələvilərdə həll olunur:
Al(OH)3 + 3HCl →AlCl3 + 3H2O
Al (OH) 3 + NaOH → Na.
Alüminium hidroksid natrium hidroksidlə birləşdikdə, natrium metaalüminat əmələ gəlir:
Al (OH) 3 + NaOH → NaAlO2 + 2H2O.
Alüminium hidroksidinin turşularla reaksiya vermə qabiliyyəti terapiyada istifadə olunur. Bu, turşuluğu azaltmaq və ürək yanmasını azaltmaq üçün istifadə olunan dərmanların bir hissəsidir.
Barium xlorid ilə reaksiya. Borat ionları, sulu məhlullarda barium xlorid ilə qarşılıqlı əlaqədə olduqda, barium metaborat Ba (BO 2) 2-nin ağ kristal çöküntüsünü əmələ gətirir.
Alüminium kation Al 3+ analitik reaksiyaları
1. Qələvilərlə reaksiya:
A1 3+ + 3 OH→A1(OH) 3 ↓ (ağ)
2. Kobalt nitratla reaksiya -tenar mavisinin əmələ gəlməsi.
Tenar mavisi mavi qarışıq alüminium və kobalt oksiddir.
2 A1 2 (SO 4) 3 + 2 Co(NO 3) 2 -tT-> 2 Co(A1O 2) 2 + 4 NO 2 + 6 SO 3 + O 2.
Bor bir iz elementidir, onun insan orqanizmindəki kütlə payı 10-dur -5 %. Bor əsasən ağciyərlərdə (0,34 mq), qalxanvari vəzdə (0,30 mq), dalaqda (0,26 mq), qaraciyərdə, beyində (0,22 mq), böyrəklərdə, ürək əzələsində (0,21 mq) cəmləşmişdir. Borun bioloji təsiri hələ kifayət qədər öyrənilməmişdir. Məlumdur ki, bor dişlərin və sümüklərin tərkibinə, görünür, bor turşusunun metal kationları ilə az həll olunan duzları şəklində daxildir.